Оценка кардиомиопатии у цыплят-бройлеров при сочетанном микотоксикозе на ультраструктурном уровне
Автор: Кашеваров Г.С., Тарасова Е.Ю., Юсупова К.В., Саитов В.Р., Матросова Л.Е., Софронова А.В.
Статья в выпуске: 3 т.259, 2024 года.
Бесплатный доступ
Цель нашего исследования заключалась в раскрытии вопроса проявления изменений сердечной мышцы цыплят-бройлеров при сочетанном микотоксикозе на ультраструктурном уровне. По результатам исследования отмечаются морфологические изменения сердечной ткани на фоне сочетанного микотоксикоза, регистрируемые на ультраструктурном уровне как морфологически, так и морфометрически. Кардиомиоциты цыплят-бройлеров в условиях сочетанного микотоксикоза утрачивают существенную часть функциональных митохондрий спустя 21 сутки подострого микотоксикоза; в этих условиях доля нефункциональных митохондрий в кардиомиоцитах может превышать половину от всех наблюдаемых. Данное исследование подтверждает наличие серьёзных патологических изменений в ткани сердца в виду воздействия сочетания микотоксинов.
Цыплята-бройлеры, микотоксины, ультраструктура, кардиомиоциты, митохондрии, статистический анализ, морфометрия
Короткий адрес: https://sciup.org/142242519
IDR: 142242519 | УДК: 619:615.9:57.012.4:57.087.1: 636.5.033 | DOI: 10.31588/2413_4201_1883_3_259_83
Текст научной статьи Оценка кардиомиопатии у цыплят-бройлеров при сочетанном микотоксикозе на ультраструктурном уровне
Согласно результатам различных мониторинговых исследований по Республике Татарстан большинство комбикормов поражаются микроскопическими плесневыми грибами. При лабораторном исследовании в таких кормах находят в основном микотоксины, продуцируемые микроскопическими грибами рода Fusarium и Aspergillus [6, 12]. В их число входят такие особо опасные микотоксины, как Т-2 токсин, афлатоксин В 1 и зеараленон .
Широко известно пагубное влияние сочетания различных микотоксинов на организм не только сельскохозяйственных животных [4, 8], но и человека, как конечного потребителя продукции агропромышленного комплекса. Постоянное поступление низких доз микотоксинов цыплятам -бройлерам может привести к ухудшению иммунитета и снижению устойчивости животных к инфекционным заболеваниям, что приведет к потерям продуктивности [9, 14] . В таком случае важно изучить возможные изменения, происходящие на морфологическом уровне.
Несмотря на то, что в описание патоморфологических изменений на фоне микотоксикоза обычно включается упоминание патологий миокарда (включая дистрофию и некроз) [2, 3, 5], в литературе встречаются также иные мнения. Например, в обзоре по вопросу влияния охратоксина А на сердечномышечную ткань Pohland соавторы однозначно указывают на наличие патологических изменений в сердце вследствие индуцированного микотоксикоза [11], однако в более позднем обзоре по влиянию того же вещества на домашнюю птицу другой коллектив авторов не находит видимых изменений скелетной и сердечной мускулатуры и приходит к выводу, что чувствительность мышечных тканей к этому токсическому агенту низка [10].
Таким образом, целью нашего исследования стало выяснение ответа на вопрос, проявляются ли на ультраструктурном уровне изменения сердечной мышцы цыплят-бройлеров на фоне микотоксикоза.
Материал и методы исследований. Для проведения исследования было сформировано две группы цыплят-бройлеров двадцатиоднодневного возраста кросса КОББ 500 живой массой 0,8–0,9 кг: группа биологического контроля (БК) и токсического рациона (ТР), по 10 особей в каждой. Цыплята-бройлеры БК получали полнорационный комбикорм для бройлеров «Финиш CHICK» (ООО «Глазовский комбикормовый завод»), в то время как в ТР задавали корм, контаминированный смесью микотоксинов (Т-2 токсин – 2,5 мг/кг, афлатоксин В1 – 3,3 мг/кг, зеараленон – 1,7 мг/кг). В конце эксперимента, длившегося 21 сутки, цыплят-бройлеров выводили из опыта с соблюдением норм гуманного обращения с подопытными животными.
Для морфологических исследований ткани миокарда были отобраны кусочки размером до 1 мм3. Ткань фиксировали 1 % забуференным глутаровым альдегидом (фосфатный буфер) и готовили к просмотру на электронном микроскопе в соответствии с принятыми протоколами (с дегидратацией ацетоном и этиловым спиртом) [1, 7, 13].
Срезы (полутонкие и ультратонкие) получали на ультрамикротоме LKB – III 8800. С целью выбора участка для ультраструктурного исследования полутонкие срезы (в пределах 1,5 мкм) предварительно просматривали на световом микроскопе (окрашивание метиленовым синим). Ультратонкие срезы (ориентировочно 80 нм) окрашивали солями тяжёлых металлов (уранилацетат, цитрат свинца) методом капли на медных сеточках с полимерной подложкой, их просмотр осуществляли при ускоряющем напряжении 60-80 кВ с использованием электронного микроскопа JEM 100 CX-II («Jeol», Япония). Обработка микрофотографий и оформление иллюстративного материала производились в специализированной программе FIJI/ImageJ [13].
На электронограммах поля зрения электронного микроскопа, полученных методом случайных бесповторных полей, подсчитывалось количество митохондрий, имеющих нормальное строение, и митохондрии с патологическими изменениями (такими, как резкое снижение количества или полная утрата крист, выпадение матрикса, лизис). Если поле зрение не содержало митохондрий или было перекрыто сеткой, оно исключалось из анализа и заменялось на другое по таблице случайных чисел. В каждой группе таким образом было отобрано для анализа по 50 полей зрения. Также была проведена морфометрия, включавшая вычисление длины и ширины (большой и малый диаметры Фере), периметра, площади и коэффициента округлости митохондрий.
Статистическая обработка полученных данных проводилась в программной среде MS Excel. Для проверки гипотезы о наличии отличий между выборками использовали точный критерий Фишера (в случае качественных признаков) и тест Манна–Уитни (для количественных признаков) при уровне статистической значимости α = 0,05.
Результат исследований. В группе токсического контроля наблюдался падёж. За всё время эксперимента пало 20,0 % цыплят. Клинический осмотр не выявил особенностей у животных группы БК, в то время как в группе ТР клинические признаки токсикоза наблюдались на шестые сутки и проявлялись отказом от корма, угнетением, потерей блеска перьевого покрова, диареей.
На ультраструктурном уровне нами наблюдалась следующая картина (Рисунок 1–2).
Кардиомиоциты группы БК в целом демонстрировали нормальное строение. В основном митохондрии с электронноплотным матриксом, содержат большое количество плотно расположенных крист (насчитывается более десятка на срезе каждой митохондрии). При этом наблюдается и некоторое количество митохондрий с нарушениями строения (в том числе лизированных). Почти вся площадь среза заполнена митохондриями.
В группе ТР (у цыплят-бройлеров на фоне микотоксикоза) клетки сердечной мышцы содержат явные маркеры патологических изменений: в большом количестве наблюдаются лизированные митохондрии и митохондрии с малым количеством крист. Количество митохондрий патологического строения на срезах в зрительном поле микроскопа составляет около половины от общего числа видимых митохондрий (а в некоторых случаях их больше, чем нормальных митохондрий).
Митохондрии в обеих группах характеризовались схожими морфометрическими особенностями. Их форма была довольно округлой (коэффициент округлости составил 0,89±0,09 в группе БК и 0,86±0,12 в группе ТК). Размеры митохондрий также были близки и составили 0,85±0,39 × 0,57±0,23
мкм и 0,94±0,34 × 0,61±0,2 мкм в группах БК и ТК соответственно. Хотя различия между группами и невелики, тем не менее они статистически значимы (Таблица 1).
Следует особо отметить, что митохондрии с патологическими изменениями встречались в клетках и в группе БК, и в группе ТР, однако отличается их соотношение (рис. 3). Для статистической проверки данной гипотезы нами был проведён статистический анализ.
Митохондрии с просветлённым матриксом и отсутствием крист и митохондрии нормального строения были подсчитаны на 50 полях зрения для обеих групп. В группе БК доля патологических митохондрий составила в среднем 8,2±6,6 %, в то время как в группе ТР – 50,3±13,2 %. Эти различия обладают высокой статистической значимостью (p = 0,2×10-98).
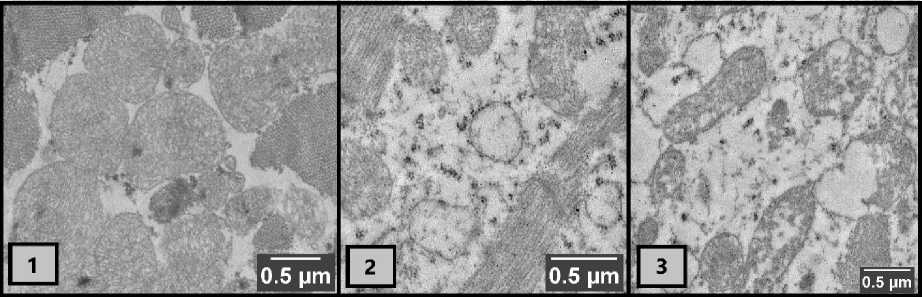
Рисунок 1 – Характерные участки ультратонких срезов кардиомиоцитов цыплят-бройлеров (1 – группа биологического контроля, видны митохондрии со множеством хорошо различимых крист; 2–3 – группа токсического рациона. Видны митохондрии с частично либо полностью утраченными кристами).
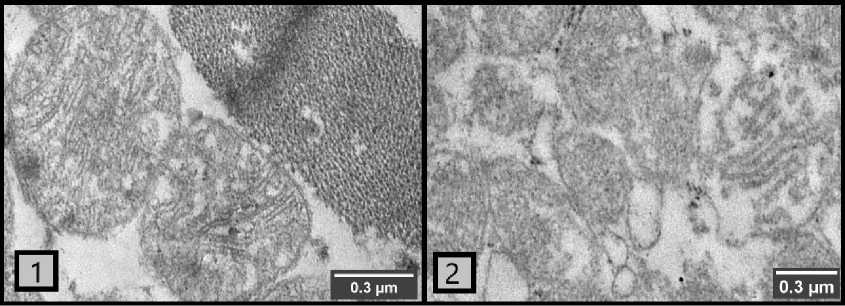
Рисунок 2 – Митохондрии нормального и патологического строения в кардиомиоцитах цыплят-бройлеров (1 – группа биологического контроля; 2 – группа токсического рациона).
Таблица 1 – Морфометрические показатели митохондрий в кардиомиоцитах цыплят- бройлеров
|
Показатель |
БК |
ТК |
p |
|
Площадь |
0,42±0,33 |
0,46±0,26 |
0,025* |
|
Периметр |
2,30±0,98 |
2,52±0,84 |
0,007* |
|
Длина |
0,85±0,39 |
0,94±0,34 |
0,003* |
|
Ширина |
0,57±0,23 |
0,61±0,2 |
0,088 |
|
Коэффициент округлости |
0,89±0,09 |
0,86±0,12 |
0,016* |
|
* – значение P < 0,05 |
|||
Доля повреждённых митохондрий в % выборке
БК ТР
Рисунок 3 – Соотношение долей повреждённых и нормальных митохондрий в выборке (тёмно-серая заливка соответствует митохондриям нормального строения, светло-серая – повреждённым). Условные обозначения : БК – биологический контроль, ТР – токсический рацион.
Заключение. Полученные нами данные свидетельствуют о том, что в условиях поступления микотоксинов в организм цыплят-бройлеров действительно наблюдаются морфологические изменения сердечной ткани, регистрируемые на ультраструктурном уровне как морфологически, так и морфометрически. Кардиомиоциты цыплят-бройлеров в условиях сочетанного микотоксикоза утрачивают существенную часть функциональных митохондрий спустя 21 сутки подострого микотоксикоза; в этих условиях доля нефункциональных митохондрий в кардиомиоцитах может превышать половину от всех наблюдаемых.
Список литературы Оценка кардиомиопатии у цыплят-бройлеров при сочетанном микотоксикозе на ультраструктурном уровне
- Иванов, А. В. Методические рекомендации по электронно- микроскопическим исследованиям биологических объектов / А. В. Иванов, А. А. Иванов, А. Н. Чернов [и др.]. – Москва: Росинформагротех, 2011. – 67 с.
- Идиятов, И. И. Изучение токсического действия трихотеценового микотоксина продуцента Fusarium sporotrichioides в опыте на свиньях / И. И. Идиятов, И. Р. Кадиков, В. Р. Саитов [и др.] // Юг России: экология, развитие. – 2022. – Т. 17. – № 1(62). – С. 62-79. – DOI 10.18470/1992-1098-2022-1-62-79. – EDN ESGGTR.
- Кудряшов, А. А. Патологоанатомическая диагностика болезней поросят в группах доращивания и откорма / А. А. Кудряшов, В. И. Балабанова, Ю. В. Иванов [и др.] // Актуальные вопросы ветеринарной биологии. – № 1(37). - 2018. – С. 56-62.
- Потехина, Р. М. Случай микоза птиц, вызванный токсигенным изолятом Fusarium proliferatum / Р. М. Потехина, Л. Е. Матросова, Е. Ю. Тарасова, Э. И. Семенов // Вестник Марийского государственного университета. Серия: Сельскохозяйственные науки. Экономические науки. – 2019. – Т. 5. – № 3(19). – С. 316-322. – DOI 10.30914/2411- 9687-2019-5-3-316-321.
- Прудников, В. С. Патоморфология и диагностика Т-2 и нитратного токсикоза телят / В. С. Прудников, А. И. Василенко, А. В. Прудников // В сборнике: Аграрная наука – сельскому хозяйству. Сборник материалов XIII Международной научно- практической конференции: в 2 кн. ФГБОУ ВО «Алтайский государственный аграрный университет». – 2018. – С. 426-427.
- Сагдеева, З. Х. Оценка общей токсичности кормов Республики Татарстан / З. Х. Сагдеева О. К. Ермолаева, А. Р. Валиев [и др.] // Ветеринарный врач. – 2020. – № 5. – С. 59-65.
- Сальникова, М. М. Трансмиссионная электронная микроскопия в биологии и медицине: монография / М. М. Сальникова, Л. В. Малютина, В. Р. Саитов, А. И. Голубев. – Казань: КФУ (Казанский (Приволжский) федеральный университет), 2016. – 125 с. – ISBN 978–5–00019–601–4 URL: http://e.lanbook.com/books/element.php?pl1_id=77306 (Дата обращения 06.05.2024).
- Семенов, Э. И. Экспериментальный сочетанный микотоксикоз свиней на фоне инфекционной нагрузки / Э. И. Семенов, Л. Е. Матросова, С. А. Танасева [и др.] // Сельскохозяйственная биология. – 2022. – Т. 57. – № 2. – С. 371-383. – DOI 10.15389/agrobiology.2022.2.371rus.
- Тарасова, Е. Ю. Нанотрубки галлуазита – новое эффективное средство для борьбы с микотоксикозами / Е. Ю. Тарасова, Э. И. Семенов, Л. Е. Матросова, М. И. Канин // Научная жизнь. – 2020. – Т. 15. – № 4(104). – С. 561-571. – DOI 10.35679/1991-9476-2020-15-4-561-571.
- Ghimpeţeanu, O. M. Aflatoxin and ochratoxin contamination in poultry. A review / O. M. Ghimpeţeanu, A. Tolescu, M. Militaru // Scientific Works. C Series. Veterinary Medicine. – Vol. LVIII, ISS 3P. – 2012. – P. 308–317.
- Pohland, A. E. Ochratoxin A: A Review / A. E. Pohland, S. Nesheim, L. Friedman // Pure & Appl. Chern. – 1992. – Vol. 64. – № 7. – P. 1029-1046.
- Potekhina, R. M. Analysis of preserved feed from individual farms of the Republic of Tatarstan / R. M. Potekhina, Yu. M. Tremasov, F. Kh. Kalimullin [et al.] // В сборнике: XV International Scientific Conference «Interagromash 2022». – Springer, 2023. – P. 1784-1789.
- Schindelin, J. Fiji: an opensource platform for biological-image analysis / J. Schindelin, I. Arganda-Carreras, E. Frise [et al.] // Nature methods. – 9(7). – 2012. – P. 676–682. –DOI: 10.1038/nmeth.2019.
- Semenov, E. I. Effect of Bee Brood and Zeolite on Broiler Chickens Exposed by Mycotoxin T-2 / E. I. Semenov, N. N. Mishina, V. R. Saitov [et al.] // Natural Volatiles and Essential Oils. – 2021. – Vol. 8. – № 4. – P. 3520-3531.


