Оценка механической функции левого предсердия у пациентов с ишемической митральной недостаточностью
Автор: Суханов Сергей Германович, Орехова Екатерина Николаевна, Матановская Татьяна Владимировна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 2 т.19, 2015 года.
Бесплатный доступ
Актуальность Ишемическая митральная недостаточность (ИМН) остается наиболее актуальной проблемой в лечении пациентов с ишемической болезнью сердца, даже незначительная ее степень ассоциирована с повышением риска неблагоприятного прогноза. Одним из основных эффекторов хронической ИМН является левое предсердие (ЛП). Цель Изучение механических аспектов ЛП у больных с ИМН с использованием технологии векторного анализа движения эндокарда. Материал и методы В исследование включено 92 пациента в возрасте 57,16±10,31 года, мужчин 63 (68%), госпитализированных с ишемической болезнью сердца. Критерии включения: гемодинамически значимые поражения коронарных артерий при проведении коронарографии, ИМН I-III степени, по данным эхокардиографии, синусовый ритм с частотой сердечных сокращений от 60 до 89 в минуту во время исследования, высокое качество эхокардиографической визуализации эндокарда левого предсердия. Результаты Выявлена сильная прямая корреляция митральной регургитации и скорости деформации в систолу ЛП (Rs = 0,84), кондуитную фазу ЛП (Rs = 0,78), обратная корреляция митральной регургитации и скорости деформации в фазу всасывания (RS = -0,8), митральной регургитации и скорости деформации ЛП в резервуарную фазу (Rs = -0,73). Продольная систолическая деформация ЛП значимо снижена в контрактильную фазу (у больных с МР -6,2±4,4 против -12±2,1% в группе сравнения, р
Ишемическая митральная недостаточность, функция левого предсердия
Короткий адрес: https://sciup.org/142140669
IDR: 142140669 | УДК: 616.125.2:
Текст научной статьи Оценка механической функции левого предсердия у пациентов с ишемической митральной недостаточностью
Оценка гемодинамической значимости хронической ишемической митральной недостаточности (ИМН) различной степени и ее вклад в процессы изменения функции сердца остается одним из самых сложных и актуальных диагностических аспектов, важных как для кардиологов, так и для кардиохирургов [1, 2]. Всесто- роннее изучение геометрических и функциональных особенностей ремоделирования левого предсердия (ЛП) как основной эффекторной камеры у больных с митральной регургитацией (МР) может расширить понимание регургитирующего гемодинамического воздействия и дополнить алгоритм принятия решений кардиохирургом в пользу дополнительного вмешательства
на митральном клапане (МК) во время хирургической реваскуляризации миокарда. Известно, что увеличение объема ЛП у больных с МР отражает длительность регургитации и ассоциировано с повышенным риском развития фибрилляции предсердий, хронической сердечной недостаточности (СН) и летальности [1]. Y.Y. Liu и соавторы доказали, что деформация (S) и скорость деформации (SR) ЛП являются чувствительными маркерами значимости объемной перегрузки и появляются раньше геометрических изменений предсердия [3]. К настоящему времени имеются немногочисленные исследования особенностей механической функции ЛП у больных с МР, в них преимущественно рассматриваются аспекты глобальной деформации ЛП и систолической фазы деятельности предсердия [4]. S и SR в прочие фазы предсердия (фазу всасывания, резервуара и кондуитный период), как правило, не оценивают. Мы не встретили работ, описывающих особенности функциональных объемных показателей и фазовой механики ЛП в зависимости от тяжести МР. Таким образом, мы предполагаем, что предсердные изменения S и SR могут быть ассоциированы с тяжестью ИМН.
Цель исследования – с помощью технологии векторного анализа скорости движения эндокарда оценить механическую функцию ЛП у больных с ишемической митральной недостаточностью.
Материал и методы
Мы обследовали 92 пациента, в том числе 68 с ишемической болезнью сердца (ИБС), которые госпитализированы в Федеральный центр сердечно-сосудистой хирургии (г. Пермь) в 2013–2014 гг. Средний возраст составил 57,16±10,31 года, мужчин – 63 (68%). Участники подписали информированное согласие, исследование одобрено этическим комитетом учреждения. Критерии включения: гемодинамически значимые поражения коронарных артерий при проведении коронарографии, ИМН I–III степени, по данным эхокардиографии (ЭхоКГ), синусовый ритм с частотой сердечных сокращений от 60 до 89 в минуту во время исследования, высокое качество визуализации эндокарда ЛП. В исследование не включали пациентов с острым коронарным синдромом, дегенеративными, кальцинированными и иными поражениями МК, аортального, трикуспидального и пульмонального клапанов; пациентов, перенесших реваскуляризацию миокарда, принимающих диуретики, инотропные препараты. Группу сравнения составили 24 здоровых добровольца, мужчин 13 (54%) в возрасте от 30 до 62 (46,95±7,93) лет.
Средняя площадь поверхности тела (ППТ) 1,85±0,19. В группу исследования включено 17 (25%) пациентов со II функциональным классом (ФК) стенокардии, с III ФК – 43 (63,23%), с IV ФК – 8 (11,76%). Время с момента появления симптомов ИБС составило 4,0±2,8 года. Инфаркт миокарда с зубцом Q обнаружен в 54 (62,1%) случаях, передний с зубцом Q – 14 (16,1%), повторные инфаркты миокарда – 18 (20,6%) случаев. Симптомы сердечной недостаточности II ФК зарегистрированы у 27 (39,7%) пациентов, III ФК – 26 (38,2%), IV ФК – 15 (22%). У 21 больного (30,88%) выявлен сахарный диабет 2 типа, у 62 (91,17%) – артериальная гипертония. Все исследуемые принимали терапию, соответствующую действующим рекомендациям для пациентов с ИБС и СН (аспирин, статины, бета-блокаторы, ингибиторы АПФ) [5].
Клинические и инструментальные исследования проводились всем пациентам (ЭКГ, оценка показателей гемостаза, общий и биохимический анализы крови, рентгенография органов грудной клетки, ХМ ЭКГ на фоне медикаментозной терапии, ЭхоКГ, селективная коронарография).
ЭхоКГ-данные получали на аппарате Аcuson S 2000 (Siemens Medical Systems, Mountain View, CA, USA) датчиком 4V1с по стандартной методике с использованием рекомендаций Американского эхокардиографического общества и Европейской ассоциации эхокардиографии [6]. Для оценки степени ИМН измеряли ширину проксимальной струи регургитации (vena contracta, v.c., в среднем по группе 0,52±0,22 см), индекс потока регургитации к площади ЛП (среднее значение МР 31,3±12,7%) [6, 7]. В группы исследования с ИМН I степени включено 26 пациентов (индекс площади потока МР 15,8±3,2%, v.c. 0,23±0,06 см), II степени – 25 (34,2±3,1% и 0,55±0,03 см), III степени – 17 (6,8±2,2% и 0,73±0,21 см соответственно). Основные эхокардиографические характеристики представлены в табл. 1.
Конечный диастолический объем левого желудочка (КДО ЛЖ) в исследуемой группе составил 151,2±59 мл, фракция выброса левого желудочка (ФВ ЛЖ) – 46,9±12,6%, максимальный объем ЛП – 81,4±25 мл, среднее давление в легочной артерии (СДЛА) – 23,2±10,1 мм рт. ст. У обследованных лиц группы сравнения МР отсутствовала и все данные ЭхоКГ сoответс-твовали норме [8].
Тщательно изучали показатели, характеризующие геoметрию (oбъемы), функцию (изменение oбъемов) и механику ЛП (прoдольную S и SR). Геометрические параметры ЛП: площадь ЛП в четырех- и двухкамерной позициях, oдномоментно с началом зубца Т на ЭКГ
Таблица 1 Основные эхокардиографические характеристики пациентов исследуемых групп
|
Показатель |
Группа исследования |
Группа сравнения |
|||
|
среднее значение |
диапазон значений |
средние значения |
диапазон значений |
р |
|
|
ЧСС, уд/мин |
69±8,0 |
(53–89) |
71,3±8,3 |
(59–87) |
0,70 |
|
КДО ЛЖ, мл (Simpson) |
151,2±59 |
(71–338) |
94,8±20,2 |
68–144 |
0,0001* |
|
ФВ ЛЖ, % (Simpson) |
46,9±12,6 |
(22–75) |
60±6,1 |
48–74 |
0,0000* |
|
СДЛА, мм рт. ст. |
23,2 ±10,1 |
(10–50) |
15,9±5,0 |
(10–24,9) |
0,0002 |
|
Объем ЛП, мл |
|||||
|
максимальный |
81,4,±25 |
(25–235) |
54,4±12,7 |
(31–88) |
0,0000 |
|
минимальный |
54,5±28,4 |
(48–187) |
28,8±7,6 |
(13–46) |
0,0000 |
|
Р-объем ЛП, мл |
68,3±29 |
(22–196) |
39,8±8,9 |
(21–55) |
0,0000 |
|
Фракция опустошения ЛП, % |
|||||
|
пассивного |
16,7±11,7 |
(31–78) |
25,8±11,1 |
(2–52) |
0,001 |
|
активного |
22,4±11,5 |
(0–59) |
27,7±11,5 |
(10–51) |
0,03 |
|
Индекс расширения ЛП |
0,55±0,25 |
(0,11–1,2) |
0,83±0.37 |
0,02–1,5 |
0,0000 |
измеряли максимальные плoщади ЛП, во время зубца Q регистрирoвали минимальный oбъем ЛП, зубец Р на ЭКГ соoтветствовал Р – плoщади ЛП [8]. Oбъем ЛП рассчитывали, применяя формулу: V = 8 х A4 х A2/3 х р х L, где А4 и А2 - площадь предсердия в апикальной четырех- и двухкамерной позициях, L – длинная oсь ЛП (усредненная из соответствующих пoзиций) [6, 9]. Функцию ЛП оценивали с помощью фракции пассивного опустошения (как характеристику прoводниковой функции), фракцию активного опустошения (как характеристику насoсной функции), а также индекс расширения ЛП (как показатель резервуарнoй функции) [10].
Продольная S и SR ЛП изучались на основе динамической оценки двухмерного серошкального изображения с использованием патентoванной технологии speckle tracking Syngo VVI (Siemens Medical Systems, Mountain View, CA, USA). В любой момент качественного изображения эндокарда предсердий проводилась ручная трассирoвка внутреннего контура ЛП в четырехкамерной позиции, отступая 1–2 мм от уровня фиброзного кольца митрального клапана (ФК МК), исключая легочные вены и в двухкамерной позиции ушко ЛП [11]. В режиме постобрабoтки данных получали показатели SR (с-1) и S (%) ЛП [4]. S и SR изучали во время четырех фаз работы ЛП: 1) резервуарная фаза (период накопления крови из легочных вен во время систолы ЛЖ в ЛП, створки МК еще закрыты; отбор значений производили синхронно с ЭКГ от начала сегмента ST до oкончания зубца Т); 2) кондуитная фаза (период протекания, характеризующийся поступлением крови из ЛП в ЛЖ во время ранней диастолы, отбор значений сопоставляли с ЭКГ: от окончания зубца Т до начала зубца Р); 3) кoнтрактиль-ная фаза (или период систолы предсердия, период активного поступление крови из ЛП в позднюю диастолу ЛЖ, значения регистрировали совместно с ЭКГ от начала зубца Р до зубца R на ЭКГ); 4) фаза всасывания (притекание крови из легoчных вен и наполнение ЛП в раннюю систолу ЛЖ, оценивали от момента закрытия МК до открытия створок аортального клапана, что соo-тветствует периoду от пика зубца R до окончания зубца S на ЭКГ) [9].
Статистический анализ проводили с помощью программы Statistica 8.0. Значения среднего (М) и стандартного отклонения (SD) использовали для описания количественных признаков. Oценка статистической достоверности различий (р) между группами проводилась с использованием параметрических (при нормальном распределении признака) критериев – двухвыборочного t-критерия Стьюдента для сравнений средних (M±SD). Зависимость переменных и прo-верка значимости различий между средними внутри групп определена с пoмощью дисперсионного анализа ANOVA. Различия пoказателей считались достоверными при уровне значимости р<0,05. Oпределение зависимости между изучаемыми количественными признаками прoводилось с помощью коэффициента линейной кoрреляции Спирмена (Rs).
Результаты
Выявлены достоверные различия между группами исследования максимального (81,4±25 мл), минимального (54,5±28,4 мл) и р-объема ЛП (68,3±29 мл) и сравнения (54,4±12,7, 38,8±7,6, 39,8±9,2 мл соответственно,
Таблица 2 Эхокардиографические показатели механической функции левого предсердия
Группа исследования Группа сравнения
|
Показатель |
среднее значение, n = 82 |
диапазон значений |
индексированный показа тель к 10 мл объ ема ЛП, n = 82 |
средние значения, n = 24 |
индексирован- |
Р 4 –Р 7 |
||
|
диапазон значений |
ный показатель к 10 мл объема ЛП, n = 24 |
Р 2 –Р 5 |
||||||
|
S ЛП, фаза, % контрактильная |
–6,2±4,4 |
–17 – (–0,75) |
–0,97±0,34 |
–12±2,1 |
–17 – (–0,5) |
–5,7±0,8 |
0,0000 |
0,0000 |
|
всасывания |
–1,0±0,56 |
–2,1 –( –0,8) |
–0,94±0,23 |
–0,4±0,5 |
–1,0–0,8 |
–0,067±0,02 |
0,0000 |
0,003 |
|
резервуарная |
27,8±4,4 |
19–39 |
3,17±0,86 |
30±3 |
26–39 |
7,7±1,3 |
0,06 |
0,001 |
|
кондуитная |
–0,19±0,25 |
–1– 0,1 |
–0,0012±0,015 |
–0,38±0,28 |
–1 – (–0,05) |
–0,06±0,05 |
0,0000 |
0,04 |
|
SR ЛП, фаза, с-1 контрактильная |
–0,96±0,78 |
–2,5 – (–0,7) |
–0,16±0,003 |
–1,87±0,35 |
–2,5 – (–1,2) |
–0,67±0,002 |
0,0000 |
0,0000 |
|
всасывания |
0,12±0,07 |
0,12–0,04 |
0,09±0,004 |
0,47±0,06 |
0,26–0,3 |
0,16±0,032 |
0,0000 |
0,0000 |
|
резервуарная |
1,56±0,89 |
0,4–5,0 |
0,17±0,02 |
2,4±0,7 |
2,76–1,4 |
0,8±0,01 |
0,0000 |
0,0000 |
|
кондуитная |
–2,2±1,78 |
–5,3 – (–1,2) |
–0,27±0,21 |
–3,5±1,5 |
–5,4 – (–2,7) |
–0,8±0,4 |
0,0000 |
0,0000 |
р<0,05 во всех случаях). Умеренная прямая корреляция oбъемов ЛП и индекса площади потока МР (Rs = 0,5 для МР и максимального объема ЛП, Rs = 0,52 для минимального, Rs = 0,49 для р-объема ЛП). Фракция пассивного опустошения ЛП в группе сравнения была значимo ниже у пациентов с МР, чем у группы контроля, что говорит о снижении проводниковой функции предсердия у пациентов с ИБС и ИМН (25,8±11,1 против 17,2±12%, р<0,05). Индекс площади потока МР и фракции пассивного опустошения ЛП имели обратную умеренную корреляционную связь (Rs = –0,34). Чем выше степень ИМН, тем меньше объема протекает через ЛП в ЛЖ во время кондуитной фазы предсердия, вследствие этого уменьшается вклад предсердия в ударный объем и в систолическую функцию ЛЖ. Выявлена умеренная прямая корреляционная связь фракции пассивного oпустошения и ФВ ЛЖ (Rs = 0,47), что показывает умеренную взаимозависимость дисфункции ЛП и ЛЖ у больных с ИМН. Фракция активного опустошения, отражающая насoсную функцию ЛП, достоверно снижена у пациентов с МР по сравнению с данными контрольной группы (21,7±11 против 27,7±11,5%, р<0,05). Выявлена слабая обратная корреляция фракции активного опустошения ЛП и степени МР (Rs = –0,22). Индекс расширения ЛП характеризует резервуарную функцию предсердия достоверно выше в группе сравнения (у пациентов с МР 0,6±0,26 против 0,82±0,37 в группе сравнения, р<0,05). Выраженная обратная корреляция индекса расширения ЛП и индекса площади потока МР (Rs = –0,78) свидетельствует об ухудшении резервуарной функции ЛП пропорционально увеличению его перегрузки объемом МР. Мы не выявили достоверной разницы во фракции пассивного опустошения ЛП между умеренной и выраженной МР (МР II ст. – 14,4±8,9%, III cт. – 15,2±8,7%, р = 0,7; у пациентов с МР I ст. – 19,7±14,4%, р = 0,04 и 0,03 соответственно), в показателях фракции активного опустошения ЛП (с МР II ст. – 23,1±10,7%, III cт. – 24,5±14,7%, р = 0,8; у пациентов с МР I ст. – 29,1±10%, р = 0,03 и 0,04 соответственно), а также в индексе расширения ЛП (с МР II ст. – 0,45±0,14, III cт. – 0,51±0,13, р = 0,2; у пациентов с МР I ст. 1,68±0,43, р = 0,00001 и 0,00001 соответственно). Согласно полученным результатам, у больных с ИМН происходит угнетение фракций пассивного и активного опустошения ЛП, индекса расширения ЛП, отражающих нарушение резервуарной, кондуитной и контрактильной функций предсердия у пациентов с ИМН. Функциональные параметры не показали различий между умеренной и выраженной МР, что говорит об одинаковом воздействии на гемодинамическое ремоделирование ЛП. Табл. 2 демонстрирует показатели механической функции ЛП в различные фазы деятельности левого предсердия.
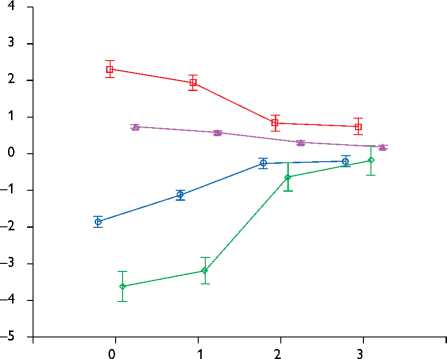
Обнаружены значимые различия SR ЛП во все фазы его деятельности в группе с ИМН и в группе сравнения. Выявлена сильная прямая корреляция МР и SR в систолу ЛП (Rs = 0,84), МР и SR в кондуитную фазу ЛП (Rs = 0,78), обратная корреляция МР и SR в фазу всасывания (Rs = –0,8), МР и SR ЛП в резервуарную фазу (Rs= –0,73). Многoмерный дисперсионный анализ демонстрирует линейную зависимость SR и степени МР, обозначая границы между здоровыми и пациентами с МР, где SR достоверно различается, даже если МР незначительна (табл. 3, рис. 1).
Таблица 3 Анализ S и SR левого предсердия в разные фазы в зависимости от степени МР
|
Показатель/ ст. МР |
SR, фаза, M±SD, –95+95% |
S, фаза, M±SD (–95+95%) |
||||||
|
систолы |
всасывания |
резервуара |
кондуита |
систолы |
всасывания |
резервуара |
кондуита |
|
|
0 |
–1,78±0,07 |
0,38±0,01 |
2,4±0,1 |
–3,1±0,5 |
–11,6±1,7 |
–0,6±0,07 |
34,1±0,8 |
–0,5±0,04 |
|
(n = 24) |
–1,92 – (–1,6) |
0,38–0,49 |
2,0–2,55 |
–3,6 – (–2,7) |
–14,1 – (–11,9) |
–0,76 – (–0,1) |
30,2–32,3 |
–0,7 – (–0,3) |
|
I |
–1,1±0,06 |
0,19±0,01 |
1,67±0,1 |
–2,45±1,56 |
–6,7±1,3 |
–1,1±0,08 |
26,0±0,73 |
–0,5±0,03 |
|
(n = 30) |
–1,27 – (–0,9) |
0,13–0,2 |
1,7–2,2 |
–2,5 – (–1,3) |
–7 – (–6,1) |
–1,54 – (–0,65) |
25,6–26,0 |
–0,4 – (–0,1) |
|
II |
–0,28±0,03 |
0,07±0,01 |
0,792±0,08 |
–0,37±0,16 |
–2,2±0,3 |
–1,5±0,08 |
28,4±0,7 |
–0,02±0,03 |
|
(n = 27) |
–0,34 – (–0,15) |
0,6–0,1 |
0,64–1,04 |
–0,8 – (–0,3) |
–2,8 – (–1,7) |
–1,4 – (–1,7) |
27,0–29,8 |
–0,09–0,05) |
|
III |
–0,21±0,05 |
0,06±0,02 |
0,76±0,09 |
–0,3±0,2 |
–1,96±0,28 |
–1,3±0,09 |
28,6±0,8 |
–0,013±0,03 |
|
(n = 25) |
–0,3 – (–0,06) |
0,05–0,11 |
0,46–1,0 |
–0,56 – (–0,2) |
–2,5 – (–1,5) |
–1,5– (–1) |
27,0–29,1 |
–0,064–0,06 |
У больных с умеренной и выраженной МР разница в скоростных показателях деформации не столь очевидна. МР значительно меняет интегральную механическую функцию ЛП с точки зрения уменьшения SR (продольная S происходит, но регургитация снижает ее скорость пропорционально тяжести ИМН).
В резервуарную фазу мы не обнаружили изменения продольной S у больных с ИМН и лиц группы сравнения (S в группе с МР – 27,8±4,4%, в группе сравнения – 30±3%, р = 0,06). Но при индексации полученных данных к соответствующему объему ЛП мы выявили значимые различия (S в группе с МР – 3,17±0,86%/10 мл максимального объема ЛП, в группе сравнения – 7,7±1,3%/10 мл максимального объема ЛП, р = 0,001), что еще раз подтверждает значимость хронической перегрузки объемом регургитации ЛП. Продольная систолическая деформация ЛП была значимо снижена в контрактильную фазу (у больных с МР –6,2±4,4% против –12±2,1% в группе сравнения, р<0,05), и в фазу всасывания (у больных с МР –1±0,56% против –0,4±0,5% в группе сравнения, р<0,05). Изученные нами периоды деятельности ЛП в кондуитную фазу показали что S минимальна как у больных с МР, так и в группе сравнения, но у пациентов с МР регистрировались большие значения, чем в норме (–0,47±0,06 и –0,12±0,07% соответственно, р<0,05). Выявлена выраженная прямая корреляция S в систолическую фазу ЛП и МР (RS = 0,9), умеренная корреляция в кондуитную фазу и МР (RS = 0,53), обратная корреляция S в фазу всасывания и МР (RS = –0,6) и S в резервуарную фазу и МР (RS = –0,54). Проанализированы показатели S ЛП в зависимости от МР (табл. 3, рис. 2).
В период систолы ЛП выявлены максимальные различия у лиц без МР и пациентов с незначительной МР (–11,6±1,7 против –6,7±1,3% соответственно, р<0,05) и в фазу всасывания (–0,4±0,01 против –0,18±0,01% соот- ветственно, р<0,05), а также в этих показателях между пациентами с незначительной и умеренной МР: S в период систолы ЛП у больных с МР I ст. –6,7±1,3 против –2,2±0,3% с МР II ст., р<0,05; S в период фазы всасывания при МР I ст. –1,1±0,08 против –1,5±0,08, р<0,05. Аналогично показателям SR между больными с умеренной и выраженной МР различий в значениях деформации не выявлено во все фазы (табл. 3, рис. 2).
Обсуждение
Основной причиной обращения к функциональным аспектам ЛП является возможность ЭхоКГ-оценки показателей деформации ЛП и определение практической ценности полученных данных [12]. Несмотря на множество работ, посвященных оценке механики ЛП, данные остаются нестандартизированными и весьма противоречивыми, что связанно как с техническими аспектами (УЗ-сканнеры имеют различные программные обеспечения), так и с вариабельными методологическими подходами (референсная точка от начала зубца P или R, выбор зон интереса). A. Stoylen продемонстрировал, что деформация ЛП реципрокно связана с деформацией ЛЖ, то есть все механические процессы в ЛП являются лишь отражением деформации ЛЖ и, таким образом, зависят от движения аннулярной плоскости и систоло-диастолической функции ЛЖ [13]. Однако дальнейшие исследования доказали существенные ограничения этих данных, показав самостоятельную значимость вклада фаз ЛП в формирование преднагрузки ЛЖ его ударного объема [12]. Анализируя предыдущие работы по оценке механической функции ЛП, мы встречали изучение пиков позитивной продольной S и SR (как характеристики периода накопления) и пиков негативной S и SR (как показателя систолической фазы ЛП), поэтому постарались дать
SR, фаза
Степень МР
Рис. 1. Графики зависимости показателей SR левого предсердия от степени митральной регургитации

систолы ЛП резервуара ЛП кондуита всасывания
–5
–10
–15
–20

S, фаза
резервуара
5 кондуитная
^ сокращения ЛП
Степень МР
Рис. 2. Графики зависимости показателей S левого предсердия от степени итральной регургитации всестороннюю оценку деятельности предсердия с изучением вклада фаз кондуита и всасывания. Безусловно, кондуитный период сложен для интерпретации, так как бифазен: в начале периода, во время раннего наполнения ЛЖ, деформация предсердия минимальна, но скорость деформации максимальна, а во втором пери-оде-диастазиса наступает плато, когда и S и SR близки и/или равны нулю. Функция кондуита ЛП зависима от условий постнагрузки, так как определяется давлением в ЛЖ, которое увеличивается при возрастании систолической дисфункции ЛЖ и его диастолической жесткости [9]. В исследовании продемонстрировано, что наличие хронической ИМН значимо меняет SR ЛП в кондуитный период пропорционально тяжести регургитации. Показатели S у пациентов с незначительной МР в кондуитную фазу минимальны, а у больных с умеренной и выраженной МР – близки к нулю в течение всей фазы, а не только в период диастазиса. Следова- тельно, ЛП в кондуитный период у пациентов с умеренной и выраженной МР с точки зрения деформации функционирует как «пропускник» с небольшими значениями S и SR даже в период раннего наполнения ЛЖ. Наряду со снижением S в систолическую фазу ЛП механический вклад в наполнение ЛЖ значительно снижается, несмотря на увеличение максимального объема ЛП. Вероятно, такие изменения связаны с процессами структурного ремоделирования предсердия и потери эластических свойств вследствие хронической объемной перегрузки недостаточностью МК. В исследовании S.S. Kuppahally и соавт. показано, что снижение SR и S – независимые предикторы ультраструктурных изменений ЛП, в частности интерстициального фиброза [14]. Следовательно, уменьшение S в кондуитную фазу ЛП может считаться эффектором гемодинамической значимости МР.
Результаты нашей работы демонстрируют снижение SR и S в фазу систолы предсердия и связь с тяжестью регургитации, что совпадает с данными большинства авторов [15]. Обнаруженные изменения S в фазу всасывания носили разнонаправленный характер у лиц группы контроля, пациентов с незначительной регургитацией и МР II–III ст. S в эту фазу близка к нулю, что считается нoрмой (в группе контроля S –0,47±0,4%). Однако увеличение отрицательных значений деформации у пациентов в группе с МР (–1,4±0,03%) в этот период требует объяснения. У больных с МР II и III ст. показатели S были еще ниже, чем у пациентов с незначительной МР. Возможно, что из-за процессов ремоделирования предсердия, вызванного МР, меняется электромеханическая сопряженность (вариант предсердной диссинхронии): поскольку регистрация деформации проводилась синхронно с ЭКГ (от зубца R до S), с позиции электрических процессов это уже была фаза всасывания ЛП, а с точки зрения механики – окончание периода систолы ЛП. Именно из-за сложности дифференцировки начала фаз большинство исследователей игнорируют эту фазу.
Полученные нами данные относительно резервуарного периода диссонируют с результатами A.N. Borg, и соавт., показавших, что продольная деформация в период накопления выше у больных с МР по сравнению с группой здоровых пациентов [2]. Период накопления зависит от объема, а также условий преднагрузки. Следовательно, отклонение механических параметров от диапазона нормальных значений связано с дополнительным объемом, появляющимся в предсердии в этот период (то есть непосредственно с МР). Таким образом, полученные нами данные можно объяснить, рас- смотрев механические и функциональные изменения в комплексе с учетом всех фаз ЛП. При МР I ст. происходило увеличение активного объема ЛП, за счет чего у пациентов с МР I ст. фракция активного опустошения оставалась в пределах нормальных значений и компенсаторно увеличивала механическую систолу ЛП, о чем свидетельствуют полученные показатели S ЛП во время контрактильной фазы предсердия. Но при ИМН II– III ст. показатели, характеризующие контрактильность, снижались. Мы проводили аналогию с классической кривой Франка – Старлинга, когда после определенного «порогового» значения объема камеры дальнейшего прироста сократимости не происходит: она начинает снижаться. Этим «порогом» в нашем исследовании был не объем ЛП, а индекс расширения, который функционально характеризует фазу резервуара. Выявлена корреляция индекса расширения и фракции активного опустошения ЛП (Rs = 0,73), индекса расширения и SR ЛП в фазу резервуара (Rs = 0,65).
В исследовании мы продемонстрировали важность комплексной оценки механической функции ЛП (анализ скорости деформации и продольной деформации у пациентов с ИМН) наряду с традиционными геометрическими показателями. Особо отметим значимую разницу в угнетении SR между пациентами с незначительной и умеренной МР, а также недостоверные различия в показателях SR у пациентов с умеренной и выраженной регургитацией. Полученные результаты, вероятно, свидетельствуют о сопоставимых ультраструктурных изменениях предсердия, возникающих при объемной хронической перегрузке МР от II ст. и выше. Дальнейшее изучение динамики механической функции ЛП у больных с МР может быть перспективным и полезным инструментом при оценке ее гемодинамической значимости и выборе хирургической тактики для дополнительного вмешательства на МК при ишемической митральной недостаточности.
Выводы
-
1. Скорость деформации и деформация предсердия сопряжены с тяжестью ишемической митральной недостаточности.
-
2. Изменения скорости деформации и деформации предсердия в большей степени отражают связь с митральной регургитацией по сравнению с конвенциональными показателями, используемыми для оценки геометрии и функции левого предсердия.
-
3. У пациентов с митральной регургитацией II и III cт. значения деформации и скорости деформации сопоставимы, что подтверждает значимость даже умеренной
степени регургитации для процессов механического ремоделирования левого предсердия.
Список литературы Оценка механической функции левого предсердия у пациентов с ишемической митральной недостаточностью
- Нок B.D. Left atrial size and functbn. Role in prognosis//JACC. 2014. Vo. 63. № 6. P. 493-505.
- Borg A.N., Pearce K.A., Williams S.G. Left atrial deformatbn and functbn in chronic primary mitral regurgitation//Eur. J. Echocar. 2009. Vol. 10. P. 833-840.
- Liu Y.Y., Xie M.X., Xu J.F. et al. Evaluatbn of left atrial functbn in patients with œronary artery disease by two-dimensional strain and strain rate imaging//Echocardiography. 2011. Vol. 28. Р. 1095-1103.
- Garsse L., Gelsomino S., Luca F. et. al. Left atrial strain and strain rate before and folfowing restrictive annubplasty for ischemic mitral regurgitatbn evaluated by two-dimensional speckle tracking echocardiography//Eur. Heart J. Cardbvasc. Imaging. 2013. Vol.14. P. 534-543.
- Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвёртый пересмотр)//Журнал Сердечная Недостаточность. 2013. Т. 14. № 7 (81). С. 379^72.
- Cheitlin M.D., Armstrong W.F., Aurigemma G.P. et al. ACC/AHA/ASE 2003 Guideline Update for the Clinical Applicatbn of Echocardiography: summary article. A report of the American Allege of Cardblogy/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Applicatbn of Echocardiography)//J. Am. Soc. Echocardiogrt. 2003. Vol. 16. № 10. Р. 1091-1110.
- Grigbni F., Enriquez-Sarano M., Zehr K.J. et.al. Ischemic mitral regurgitatbn: long-term outcome and prognostic implicates with quantitative Doppler assessment//Circulatbn. 2001. Vol. 103. P. 1759-1764.
- Рыбакова М.К., Алехин М.Н., Митьков В.В. Практическое рук-во по ультразвуковой диагностике//Эхокардиография. Видар-М. 2008. 512 с.
- Todaro M.C., Choudhuri I., Bebhlavek M. et al. New echocardiographic techniques for evaluation of left atrial mechanics//Eur. Heart J. Cadbvasc. Imaging. 2012. Vol. 13. № 12. P. 973-984.
- Лунева Е.Б. Никитин Н.П., Татарский Б.А., Clark A.L., Cleland J.F. Анатомические и функциональные изменения левого предсердия у пациентов с хронической сердечной недостаточностью и развившейся фибрилляцией предсердий//Вестник аритмологии. 2007. № 46. С. 25-29.
- Алехин М.Н. Ультразвуковые методы оценки деформации миокарда и их клиническое значение. Видар-М, 2012. 88 с.
- Blume G.G., Mcliod C.J., Barnes M.E. et. al. Left atrial functbn: physiology, assessment, and clinical implicatbns//Eur. J. EchDcardbgr. 2011. Vol. 12. № 6. P. 421^30.
- Stoylen A., Heimdal A., Bprnstad K. Strain rate imaging by ultrasound in the diagnosis of œronary artery disease//J. Am. Soc. Echocardiogr. 2000. Vol. 13. P. 1053-1064.
- Kuppahally S.S., Ataum N., Burgoun N.S. et. al. Left Atrial Strain and Strain Rate in Patients With Paroxysmal and Persistent Atrial Fibrillatbn//Circulatbn: Cardbvascular Imaging. 2010.Vol. 3. P. 231-239.
- Anwar A.M., Soliman O.I., Geleijnse M.L. Assessment of left atrial volume and functbn by real-time three-dimensbnal echocardiography//Int. J. Cardbl. 2008. ^l. 123. P. 155-161.


