Оценка методов отведения мочи после радикальной цистэктомии
Автор: Васильченко М.И., Забелин М.В., Семенякин И.В., Зеленин Д.А., Погосян Р.Р., Якушев Ю.А.
Журнал: Хирургическая практика @spractice
Рубрика: Хирургия и смежные специальности
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
Цель исследования - оценка результатов хирургического лечения больных с функциональной и органической патологией мочевого пузыря, опе- рированных с использованием разработанных способов кишечной деривации мочи. Материал и методы: анализированы результаты лечения 110 пациентов, перенесших цистэктомию с формированием артифициального тонкокишечного мочевого пузыря. У 57 (51,8%) пациентов выполнена ортотопическая кишечная пластика, 37 (33,6%) - гетеротопическая кишечная пластика, 5 (4,5%) - илеокондуит по Брикеру и 11 (10%) пациентам - уретерокутанеостомия. Результаты: в сроки от 4 до 6 месяцев после операции у 53 (93%) больных с ортотопическим мочевым пузырем прекратилось недержание мочи. Частота мочеиспускания составила 6,3±1,5 раза в дневное время и 2,5±1,2 раза в течение ночи. Объем мочеиспускания колебался от 340 до 650 мл, остаточный объем составил от 30 до 80 мл. Оценена как хорошая функция удерживающего механизма гетеротопического мочевого резервуара у99% больных. Выводы: выбор метода деривации мочи может быть окончательно решен только интраоперационно. Качество жизни у больных лучше вгруппе с ортотопическим мочевым пузырем по сравнению с группой больных с гетеротопическим мочевым резервуаром, однако в более поздние срокистатистически достоверной разницы показателей между группами нет.
Рак мочевого пузыря, цистэктомия, тонкокишечная пластика мочевого пузыря
Короткий адрес: https://sciup.org/142211610
IDR: 142211610 | УДК: 616.62-089.87-089.197.6:612.467.11
Текст научной статьи Оценка методов отведения мочи после радикальной цистэктомии
В последние десятилетия отмечается увеличение частоты онкологических заболеваний различной локализации [1, 2]. Большое количество описанных в литературе методов деривации мочи после цистэктомии указывает на отсутствие оптимального метода. Проблема состоит в поиске оптимально эффективных способов деривации мочи при реконструктивных операциях по восстановлению обширных дефектов мочевого пузыря или его полного замещения, необходимости лечения больных со злокачественными новообразованиями и приобретенными заболеваниями мочевого пузыря. В последние годы отмечена тенденция к увеличению частоты заболеваемости раком мочевого пузыря во всем мире, особенно в промышленно развитых странах [3, 4]. Частота встречаемости мышечно-инвазивных форм рака, при которых радикальная цистэктомия является «золотым стандартом» в комплексном хирургическом лечении, составляет до 25% всех форм заболевания [6, 8, 13].
Выбор метода отведения мочи после цистэктомии является ведущей задачей как для хирурга, так и для пациента. Наиболее перспективными методами деривации мочи является отведение мочи в изолированный сегмент кишки с формированием кожной стомы или создание кишечного артифициального мочевого пузыря. В настоящее время сегмент подвздошной кишки является наиболее часто используемым участком кишечника для создания мочевых резервуаров. Ортотопическая кишечная пластика мочевого пузыря обеспечивает наилучшее качество жизни пациента после операции, но существуют причины, по которым невозможно выполнение данного метода деривации мочи: анатомически короткая брыжейка подвздошной кишки, при котором невозможно низведение сформированного мочевого пузыря в малый таз, распространенное опухолевое поражение тазового дна или органов малого таза и др. В связи с этим решение о выборе метода отведении мочи зачастую приходится принимать интраоперационно и, следовательно, менять тактику проведения операции.
Высокий процент послеоперационных осложнений, таких как несостоятельность кишечно-мочеточниковых анастомозов, развитие уретерогидронефрозов из-за неадекватного объема сформированного мочевого пузыря, нарушение его шаровидности при больших механических нагрузках, возникновение электролитных нарушений, дефицит витамина В12 в связи с излишней резекцией тонкой кишки заставляют искать новые подходы к выбору способа деривации мочи [5, 8, 11]. Выработаны основные требования к мочевым пузырям, сформированным из кишечника: достаточный объем мочевого пузыря не менее
400 - 500 мл, обеспечивающий низкое внутрипузырное давление, не превышающее 20 мм водного столба; отсутствие ретроградных току мочи перистальтических сокращений; функциональную и морфологическую адаптацию, включающую последующее шаровидное изменение формы мочевого пузыря; защиту верхних мочевых путей с помощью сохранения адекватного антирефлюксного механизма [7, 10, 12].
Цель исследования — оценка результатов хирургического лечения больных с функциональной и органической патологией мочевого пузыря, оперированных с использованием разработанных способов кишечной деривации мочи.
Материалы и методы
В период 2009 - 2014 гг. в урологических отделениях ГКБ №50 (г. Москва) и ГБУЗ МО «Московский областной онкологический диспансер» (г. Балашиха Московской обл.) 105 больным выполнена цистэктомия с различными видами деривации мочи по поводу инвазивного рака мочевого пузыря. Цистэктомия выполнена по поводу микроцистиса различной этиологии, 5 пациентам. Мужчин было 103 (93,6%), женщин — 7 (6,4%). В связи с тяжелым состоянием 17 (15,5%) пациентам цистопла-стика выполнялась в два этапа. Первым этапом выполнялась цистэктомия с деривацией мочи методом уретерокутанеосто-мии, через 5 - 12 месяцев выполнялась деривация мочи в кишечный резервуар. В исследовании больные были разделены, в зависимости от вида деривации мочи, на следующие группы: ортотопическая кишечная пластика — 57 (51,8%) пациентов, гетеротопическая кишечная пластика — 37 (33,6%) пациентов, илеокондуит по Брикеру — 5 (4,5%) пациентов, уретерокута-неостомия — 11 (10,0%) пациентов.
Кишечный резервуар, или артифициальный мочевой пузырь, формировался из резецированного сегмента терминального отдела подвздошной кишки отступая на 25 см от илеоцекального угла с обязательным сохранением a. ileocolica . Определение необходимой длины резецируемой части тонкой кишки производилось на основании предварительных расчетов с учетом индивидуальных особенностей морфометрических параметров тонкой кишки пациента и получения заданного объема артифициального мочевого пузыря (патент на изобретение № 2444307 от 10.03.201 г.). Основным морфометрическим параметром при расчетах необходимой длины резецируемой части кишки для формирования мочевого пузыря при цисто-пластике является длина полуокружности кишки, которая измеряется при сплющивании кишки (рис. 1). Определение длины резецируемой части тонкой кишки, производилось по формуле: H = Р : 2L, где Н — длина резецируемой части тонкой кишки; Р — производная величина от планируемого объема создаваемого мочевого пузыря, вычисляемая по формуле: Р = 4π(3√(V:4/3 π))2, где V — объем создаваемого мочевого пузыря, L — длина полуокружности кишки конкретного пациента.
При ортотопической пластике артифициальный мочевой пузырь формировался по оригинальной методике (патент № 2337630 от 10 ноября 2008 г.). Средняя часть резецированного
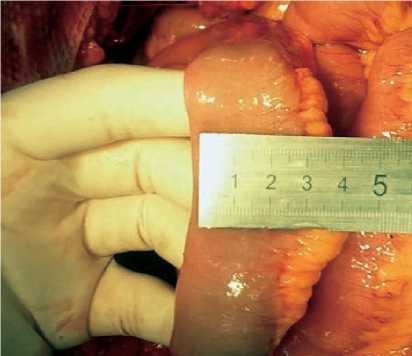
Рис. 1. Интраоперационное измерение полуокружности кишки участка кишки складывается в виде двустволки и рассекается по противобрыжеечному краю. Формирование мочевого пузыря начинается путем сшивания задних стенок рассеченной кишки однорядным узловым швом. Передняя стенка сшивается асимметрично — нижняя часть полученного U-образного сегмента складывается поперечно кверху, накладывая направляющий шов. Однорядным узловым швом ушивается проксимальный участок передней стенки мочевого пузыря. Дистальный участок передней стенки ушивается однорядным узловым швом, оставляя не ушитым отрезок протяженностью до 2 см. Края не ушитого участка заворачиваются кверху и подшиваются к серозно-мышечному слою кишки отдельными узловыми швами, рассеченные края сшиваются с созданием «замка», формируя «жом» на дистальном конце кишечного мочевого пузыря (рис. 2). Дистальный конец кишечного пузыря анастомозируется с уретрой (рис. 3). Мочеточники имплантируются по антирефлюксной методике: на проксимальных недетубуляри-зированных участках кишечного мочевого пузыря выкраиваются площадки, путем удаления серозно-мышечной оболочки 20-30 х 5-7 мм, мочеточники укладываются до середины площадки и фиксируются отдельными швами у ее проксимального края; вскрыв просвет кишки, формируются анастомозы; на
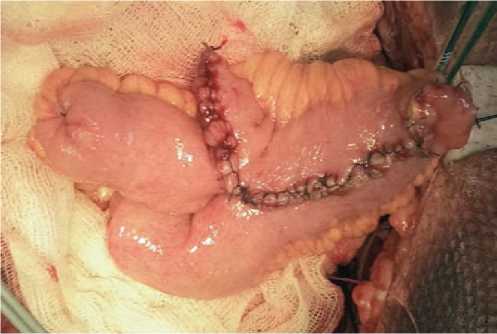
Рис. 2. Сформированный ортотопический мочевой пузырь
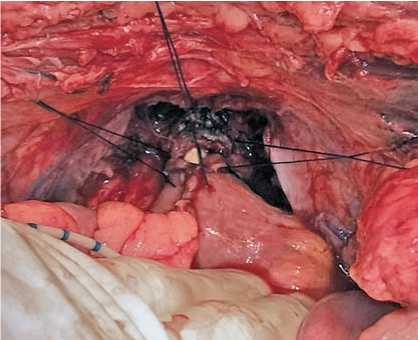
Рис. 3. Этап анастомозирования ортотопического мочевого пузыря с уретрой проксимальный и дистальный края площадки накладываются отдельные лигатуры, при подтягивании за нити производится инвагинация дистальных концов мочеточников в просвет кишки.
Формирование гетеротопического кишечного резервуара выполнялось по оригинальной методике (патент №2277866 от 29.01.04). Выкраивание сегмента подвздошной кишки производится аналогично, как и при формировании ортотопического мочевого пузыря, отличие заключается в том, что в проксимальном не рассеченном участке резервуара формируется ивагинационный клапан и на конце стомы — жом, которые не позволяют моче истекать наружу. В области проксимального конца кишечного трансплантата производится пристеночная мобилизация кишки. Край проксимального конца трансплантата после рассечения выворачивается и заворачивается кверху в состоянии умеренного натяжения (как по длине, так и по ширине), по краю подшивается к серозно-мышечной оболочке кишки отдельными узловыми швами. Причем рассеченные края сшиваются с созданием «замка». Отступив от проксимального конца кишки на 5 - 6 см, пристеночно легируются 3 брыжеечных сосуда. На середине мобилизованного участка кишки циркулярно рассекается серозно-мышечная оболочка. Выше и ниже этого разреза производят еще два эллипсовидных разреза. Это позволяет при формировании клапана не сузить просвет кишки в основании клапана, а рассеченная оболочка, срастаясь, предотвращает дезинвагинацию клапана. Накладываются узловые швы на верхний и нижний края рассеченной серозно-мышечной оболочки. Поочередным завязыванием нитей и дополнительным погружением стенки кишки диссектором формируется инвагинационный клапан (рис. 4). Проксимальный участок с жомом выводится в виде стомы на переднюю брюшную стенку.
Функция верхних мочевых путей оценивалась по данным внутривенной урографии, динамической ангионефросцинти-графии. Для оценки состояния артифицального мочевого пузыря, пузырно-мочеточниковых анастомозов использовалась цистография, компьютерная томография, урофлоуметрия, ци-
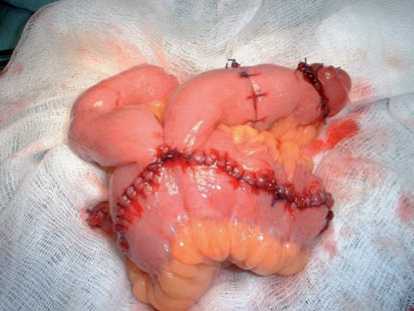
Рис. 4. Сформированный гетеротопический мочевой резервуар стоманометрия. Оценка качества жизни пациентов изучалась с помощью анкетирования опросниками SF-36, EORTC QLQ-C30 (version 3), опроснику стомированного больного.
Результаты и обсуждение
Средняя продолжительность операции составила 380 минут. Интраоперационная кровопотеря была вызвана сложностью цистэктомии и составила в среднем 790 мл, вид деривации мочи на объем кровопотери не влиял.
После выполнения этапа цистэктомии выполнялся этап резекции кишечника. Длинна резецируемого сегмента терминального отдела подвздошной кишки определялась в зависимости от планируемого объема неоцистиса или резервуара. Непрерывность кишечника восстанавливалась межкишечным анастомозом «бок в бок» или «конец в конец». Для формирования мочеточниково-резервуарного анастомоза в большинстве применяемых в настоящее время методов необходимо выделение дистального отдела мочеточника на протяжении [7, 9]. Такой поход является вероятной причиной развития осложнений, связанных с некрозом участка стенки мочеточника, и несостоятельности мочеточниково-пузырных анастомозов. Использование нами оригинальных методов формирования артифици-ального мочевого пузыря или кишечного резервуара позволило избежать развития подобных осложнений, так как концы резецированного сегмента кишечника подводятся к культе мочеточника и для формирования мочеточниково-резервуарного анастомоза достаточно выделение дистального отдела мочеточника на протяжении 15 - 25 мм, что позволяет полностью сохранить кровоснабжение в данной зоне мочеточника.
Способ формирования полости неоцистиса позволяет уже интраоперационно придать овальную форму тонкокишечному мочевому пузырю. При выполнении ортотопического мочевого пузыря следующим этапом выполнялось анастомозирование неопузыря с уретрой. При гетеротопическом мочевом резервуаре следующим этапом формировался удерживающий клапан на проксимальном конце резецированного участка кишки и выведение стомы на переднюю брюшную стенку.
Максимальный срок наблюдения за больными составил 6 лет. Анализ результатов проводился на основании данных, полученных при обследовании больных через 1, 3, 6, 9, 12 месяцев, в первый год после операции и каждые полгода в дальнейшем.
Функция почек, уродинамика оценивались по данным внутривенной урографии и динамической ангионефросцинтигра-фии. Признаков расширения чашечно-лоханочной системы, снижения функции почек выявлено не было, даже у больных с явлениями гидронефроза до операции. Эффективность антирефлюксной методики формирования мочеточниковопузырных анастомозов оценивалась по данным ретроградной цистографии, при этом же исследовании определялся объем мочевого пузыря или резервуара. При тугом наполнении мочевого пузыря отсутствовали рентгенологические признаки пузырно-мочеточникового рефлюкса. В течении 2 - 3 месяцев после операции у больных объем мочевого пузыря или резервуара достигал запланированного во время операции и формировалась шаровидная форма мочевого пузыря.
Функционирование удерживающего механизма гетеротопического мочевого резервуара оценивалось по опроснику стомированного больного. Также выполнялась исследование: после катетеризации резервуара эластичным катетером до «тугого» наполнения при натуживании и в положении больного на животе оценивалась функция удержания. У всех больных в различные сроки исследования герметичность стомы была хорошая.
В сроки от 4 до 6 месяцев после операции у 53 (93 %) больных с ортотопическим мочевым пузырем прекратилось недержание мочи. Проведение урофлоуметрии через год после операции выявило, что среднее время опорожнения мочевого пузыря составило 70 секунд, а средний поток мочи — 9 мл/сек. Частота мочеиспускания составила 6,3±1,5 раза (среднее ± стандартное отклонение) в дневное время и 2,5±1,2 раза в течение ночи. Объем мочеиспускания колебался от 340 до 650 мл, остаточный объем составил от 30 до 80 мл. При выполнении цистометрии, повышение внутрипузырного давления начиналось с объема 367±46,4 мл и составляло 15,3±4,4 см вод. ст. при емкости 320 мл и 39±10,5 см вод. ст. при максимальном наполнении (до 700 мл). Максимальное внутрипузырное давление при мочеиспускании составило 60,0±19,4 см вод. ст. Максимальное внутриуретральное давление наружного сфинктера уретры составило 25,0±11,3 см вод. ст., при пустом пузыре, которое увеличивалось в ответ на заполнение пузыря до 64,7±27,0 см вод. ст. Максимальное давление закрытия уретры и общая длина профиля при профилометрии составили 28,2±9,4 см вод. ст. и 21,7±6,0 мм при пустом пузыре и 23,2±14,5 см вод. ст. и 20,0±7,6 мм соответственно при наполненном. По нашему мнению, в течении первого года после операции происходил процесс адаптации больных к «новому процессу» мочеиспускания, а полученные уродинамические показатели свидетельствуют об адекватной функции артифициального мочевого пузыря.
Анкетирование пациентов по качеству жизни на сроках от 3 до 60 месяцев после операции выявило, что у больных, в основном были снижены показатели общего восприятия здоровья, эмоциональных проблем и социальной активности впервые 6-12 месяцев после операции. Качество жизни у больных лучше в группе с ортотопическим мочевым пузырем по сравнению с группой больных с гетеротопическим мочевым резервуаром, однако в более поздние сроки статистически достоверной разницы показателей между группами нет.
Выводы
Выбор метода деривации мочи может быть окончательно решен только интраоперационно и использование описанных методов позволяет решить возникающие проблемы без затруднений. Анализ полученных результатов у больных в ранние и поздние сроки после операции свидетельствуют об эффективности применяемых методик, обеспечивающих в дальнейшем высокое качество жизни пациентов.
Список литературы Оценка методов отведения мочи после радикальной цистэктомии
- Ачкасов Е.Е., Алекперов С.Ф., Мельников П.В., Колышев И.Ю., Калачев О.А., Орехов О.О., Каннер Д.Ю. Гистопатоморфологические изменения кишечника при обтурационной опухолевой толстокишечной непроходимости//Биомедицина. 2012. №4. С. 113-123.
- Ачкасов Е.Е., Мельников П.В., Алекперов С.Ф., Калачев О.А., Каннер Д.Ю., Волков В.С., Посудневский В.И. Миниинвазивная декомпрессия толстой кишки при опухолевой толстокишечной непроходимости//Хирургия. Журнал им. Н.И. Пирогова. 2012. №6. С. 83-87.
- Велиев Е.И., Лоран О.Б. Проблема отведения мочи после радикальной цистэктомии и современные подходы к ее решению//Практическая онкология. 2003. Т.4, №4. С. 231-234.
- Даренков С.П., Соколов А.Е., Оччархаджиев С.Б. Ближайшие иотдаленные результаты уретеросигмостомии с формированием резервуара по Майнц-пауч II и Хасану//Урология. 2004. №2. С. 7-12.
- Комяков Б.К., Фадеев В.А., Новиков А.И. Уродинамика артифициального мочевого пузыря//Урология. 2006. №4. С. 13-16.
- Матвеев Б.П., Волкова М.И., Фигурин К.М., Петерс М.В. Спасительная цистэктомия у больных переходно-клеточным раком мочевого пузыря//Онкоурология. 2009. №1. С. 27-31.
- Матвеев Б.П., Фигурин К.М., Карякин О.Б. Рак мочевого пузыря. М.: Вердана, 2001. 181 с.
- Переверзев А.С., Петров С.Б. Опухоли мочевого пузыря. Харьков, 2002. 303 с.
- Hautmann R.E., Abol-Enein H., Hafez K. Urinary diversion//Urology.2007. Jan. Vol. 69, №1. P. 17-49.
- Nagele U., Kuczyk M., Anastasiadis A.G., Sievert K.D., Seibold J.,Stenzl A. Radical Cystectomy and Orthotopic Bladder Replacement inFemales//Eur. Urol. 2006. Vol. 50. P. 249-257.
- Riddick A.C., Turner W.H., Mills R.D. Bowel function in urinarydiversion//World J. Urol. 2004. Vol. 22. P. 210-214.
- Studer U.E., Burkhard F.C., Schumacher M., Kessler T.M., Thoeny H., Fleischmann A., Thalmann G.N. Twenty Years Experience With an Ileal-Orthotopic Low Pressure Bladder Substitute -Lessons to be Learned//J.Urol. 2006. Vol. l76. P. 161-166.
- Stein J.P., Skinner D.G. Results with radical cystectomy for treatingbladder cancer: a «reference standart» for high-grade, invasive bladdercancer//BJU Int. 2003. Vol. 92, № l. P. 12-17.


