Оценка мутагенной активности биопрепарата на основе молочнокислых и пропионовокислых микроорганизмов в условиях in vitro
Автор: Мухаммадиев риН.С., Мухаммадиев риШ.С., Валиуллин Л.Р., Касанова Н.Р., Будынков Н.И., Глинушкин А.П.
Статья в выпуске: 3 т.247, 2021 года.
Бесплатный доступ
Мутагенная активность разрабатываемого нами препарата на основе штаммов молочнокислых и пропионовокислых микроорганизмов показала, что изучаемый препарат и его метаболиты не вызывали индукцию обратных мутации от ауксотрофности по гистидину к прототрофности у гистидин-зависимых штаммов Salmonella typhimurium TA98 и TA100. Число колоний-ревертантов в опыте и контроле достоверно различались менее чем в 2,0 раза. Биопрепарат имел низкий МИ равный 1,0-1,1 для штамма ТА98 и 0,96-1,07 для штамма ТА100. Полученные данные в условиях in vitro указывают на безопасность биопрепарата на основе молочнокислых и пропионовокислых микроорганизмов, а также возможность его дальнейшего применения в сельском хозяйстве и ветеринарной медицине.
Биопрепарат, молочнокислые, пропионовокислые бактерии, мутагенность
Короткий адрес: https://sciup.org/142229159
IDR: 142229159 | УДК: 615.331.036 | DOI: 10.31588/2413-4201-1883-247-3-177-181
Текст научной статьи Оценка мутагенной активности биопрепарата на основе молочнокислых и пропионовокислых микроорганизмов в условиях in vitro
В настоящее время из значительного количества изучаемых биологических объектов, особое внимание уделяется молочнокислым и пропионовокислым микроорганизмам. Интерес исследователей к ним связан с тем, что они являются продуцентами хозяйственно ценных биологически активных соединений, обладают выраженным антагонистическим эффектом в отношении патогенных и условно-патогенных микроорганизмов и способностью к активному росту и размножению [3, 9]. Использование пробиотических микроорганизмов уменьшает патологические расстройства желудочно-кишечного тракта при использовании антибактериальных средств. Пробиотики способны улучшать иммунную систему, функцию эпителиального барьера и производить антибактериальные факторы. Поэтому в настоящее время молочнокислые и пропионовокислые микроорганизмы в составе препаратов широко применяются в различных отраслях промышленности и сельского хозяйства [6, 7]. Тем не менее, согласно ЕАБП, ВОП и ВОЗ применение препаратов на основе таких микроорганизмов должно базироваться на их эффективности и безопасности [10].
В различных отраслях производства для оценки мутагенной активности широко применяется более 100 тест-систем [1]. Тем не менее, до настоящего времени не существует универсальных тест-систем, выявляющих главные типы генетических повреждений. В работе по выявлению и оценке мутагенных свойств изучаемых агентов используется целый комплекс, батареи тестов, которые взаимодополняют друг друга и отличаются по уровню биологической организации объекта исследования (прокариоты, эукариоты, системы in vitro, in vivo) или по конечному действию (повреждение ДНК, генные мутации, хромосомные аберрации, и др.). При этом последовательность испытаний препаратов проводят от простых к сложным тест-системам и от кратких опытов к более длительным [5]. Применяемые тест-системы должны быть легко воспроизводимыми и обладать существенной пропускной способностью.
Целью данной работы была оценка мутагенной активности нового биопрепарата на основе молочнокислых и пропионовокислых микроорганизмов в условиях in vitro.
Материал и методы исследований. Работа проводилась на базе лаборатории пробиотических препаратов и ферментов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности. Объектом исследования являлся новый биопрепарат на основе штаммов молочнокислых (Lactobacillus plantarum, Lactobacillus salivarius, Lactobacillus bucheri, Lactococcus lactis) и пропионовокислых микроорганизмов (Propionibacterium freudenreichii), который предполагается применять для профилактики и лечения желудочно-кишечных заболеваний сельскохозяйственных животных.
Определение мутагенной активности препарата на основе молочнокислых и пропионовокислых микроорганизмов методом оценки индукции генных мутации осуществлялось стандартным тестом Эймса с применением микроорганизмов [2, 5]. В качестве тестерных микроорганизмов применили штаммы Salmonella typhimurium ТА98 и TA100, предоставленные научнообразовательным центром фармацевтики Казанского (Приволжского) федерального университета.
В эксперименте, биопрепарат разводили основой препарата в агаризованной среде до концентрации (1,4-1,6)×109 КОЕ/мл. В пробирки, содержащие по 3 мл 0,6 % полужидкого «верхнего» агара с микродобавками биотина и гистидина и нагретые на водяной бане до температуры 45 ºС, добавляли 0,1 мл суспензии бактерии и 0,1 мл тестируемого образца. Содержимое пробирок быстро перемешивали и наслаивали на слой 1,5 % селективного «нижнего» агара в чашки Петри. После полного застывания слоя «верхнего» агара чашки переносили инкубироваться в термостат при 37 оС. Положительными контролями, индуцирующими мутации у тест-штаммов, служили прямые мутагены – 2-нитрофлуорен (2 мкг на пробу) для ТА 98, азид натрия (4 мкг на пробу) для ТА 100. Общий контроль (0,1 мл основа лечебного препарата) ставили на обоих штаммах в пяти повторностях, остальные пробы испытывали в трех повторностях. Мутагенный эффект препарата устанавливали через 48 ч совместной инкубации метаболитов с бактериальной культурой. Сравнивали количество колоний ревертантов в опытных и контрольных вариантах (колониеобразующие единицы КОЕ).
Мутагенность биопрепарата выражали через значения МИ (мутагенный индекс) – отношение количества колоний-ревертантов His+ в опыте (среднее число колоний на чашках с препаратом) к контролю (среднее число колоний на чашках с основой препарата). За присутствие мутагенного действия принимали превышение значения МИ, равный 2,0 и более для штамма бактерий ТА 98 и 1,8 и более для штамма ТА100. Превышение величины МИ от 2 (1,8) до 10 принимали как слабый, от 10 до 100 – как средний, от 100 и более – сильный мутагенный эффект тестируемого препарата [2].
Для определения цитотоксического эффекта препарата в отношении культур тестерных штаммов S. typhimurium ТА98, ТА100 в пробирки, содержащие 2,0 мл 0,6%-ого расплавленного полуобогащенного агара, добавляли по 0,1 мл суспензий штаммов бактерий в количестве 2×109 КОЕ/мл и по 0,1 мл препарата в исследуемой дозе. В контрольные пробы вместо исследуемого препарата вносили по 0,1 мл основы препарата. После полного застывания L-агара полученную смесь наслаивали на его поверхность и через 48 ч инкубирования в термостате при 37 оС осуществляли учет выросших колоний штаммов бактерий S. typhimurium.
Полученные в ходе исследования результаты обрабатывали методом вариационной статистики. Для каждой выборки устанавливали среднее арифметическое (Х), ошибку среднего арифметического (m). Проверку на нормальность распределения осуществляли с использованием критерия Шапиро–Уилка. Сравнение выборочных средних проводили по t-критерию Стьюдента в случае нормального распределения или по критерию Крускалла-Уоллиса для к-несвязанных выборок (к>2) в случае распределения, отличающегося от нормального. Различия считали достоверными при р< 0,05.
Результат исследований.
Микроорганизмы входят в состав различных тест-систем для определения мутагенной активности препаратов, химических соединений и их метаболитов. Доказано, что наиболее удобными и пригодными объектами для исследования мутаций являются бактерии, поскольку они способны делится быстро, вследствие чего их число можно многократно увеличить, регистрировать и получать результаты в течение нескольких часов.
В связи с вышеизложенным, оценку мутагенной активности разрабатываемого нами препарата на основе штаммов пробиотических микроорганизмов для профилактики и лечения желудочнокишечных заболеваний сельскохозяйственных животных проводили с применением мутационного теста на Salmonella typhimurium (тест Эймса). Метод был выбран нами в качестве недорогого, быстрого, простого и удобного анализа для оценки потенциала мутагенности препарата. Следует отметить, что данный тест имеет высокую корреляцию с канцерогенными свойствами веществ или препаратов [8]. Сущность этого метода заключается в том, что индикаторные штаммы бактерий Salmonella typhimurium, несущие генные мутации в гистидиновом опероне (у которых произошла мутация от ауксотрофности по гистидину к прототрофности) выращивают на специальной среде, на которой могут расти только мутанты данных штаммов.
С целью выявления разных типов мутаций в работе использовали мутантные штаммы S. typhimurium, имеющие следующие генетические характеристики [2]: ТА 100 – his G46, rfa, uvr-, pKm 101, bio; ТА 98 - his D3052, rfa, uvr-, pKm 101, bio-.
Штамм ТА98 регистрирует мутации типа сдвига рамки считывания, ТА100 – типа замены пар оснований в молекуле ДНК. Штаммы ТА100 и ТА98 несут дополнительно плазмиду устойчивости к ампициллину pKm 101, а также ген umu C, что повышает вклад ошибочной репарации в процесс мутагенеза, и, таким образом, чувствительность штаммов.
Поскольку для определения мутагенности препарата требуется изучение мутагенной активности в нетоксических концентрациях для микроорганизмов, проводилась оценка токсичности препарата по отношению к Salmonella typhimurium. Результаты исследований показали, что биопрепарат (титр 1,4-1,6 × 109 КОЕ/мл) не проявляет цитотоксического действия на штаммы Salmonella typhimurium TA98, TA100. Ранее методами МТТ-теста, окрашивания трипановым синим и световой микроскопией, нами было показано отсутствие цитотоксичности штаммов молочнокислых и пропионовокислых бактерий изучаемого препарата после его инкубации с линиями клеток млекопитающих [4].
Результаты оценки индукции обратных мутаций в клетках S.typhimurium к гистидиновой прототрофности через 48 часов инкубации в присутствии биопрепарата и его основы (негативный контроль) показали, что варианты опыта достоверно не отличались (р>0,05) от отрицательных контрольных вариантов (Рисунок 1).
Изучаемый препарат и его метаболиты не вызывали индукцию обратных мутации от ауксотрофности по гистидину к прототрофности у гистидин-зависимых штаммов Salmonella typhimurium TA98 и TA100. Положительными контролями, индуцирующими мутации у тест-штаммов, служили прямые мутагены 2-нитрофлуорен для ТА98 и азид натрия для ТА 100. Число колоний-ревертантов (колонии клеток – обратных мутантов, у которых частично или полностью восстанавливаются признаки исходного организма) в опыте и контроле достоверно различались менее чем в 2,0 раза, что указывает об отсутствии мутагенного эффекта препарата на основе молочнокислых и пропионовокислых микроорганизмов. Препарат на основе пробиотических микроорганизмов имел низкий МИ равный 1,0-1,1 для штамма ТА98 и 0,96-1,07 – для штамма ТА100, что расценивается как отсутствие прямой мутагенной активности (Таблица 2).
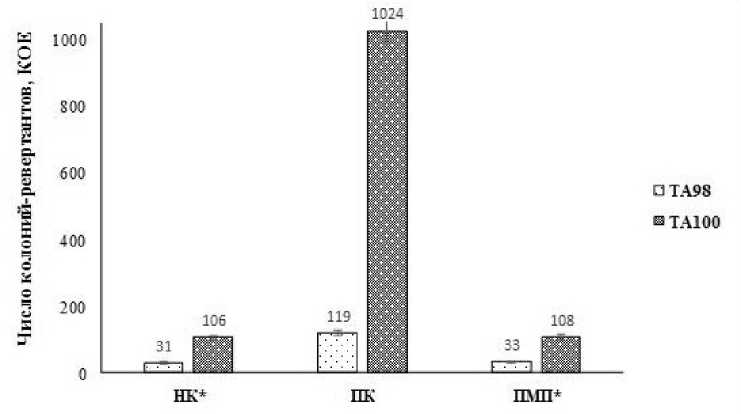
Рисунок 1 – Мутагенная активность биопрепарата на основе молочнокислых и
пропионовокислых микроорганизмов: НК – негативный контроль (основа препарата), ПК – позитивный контроль (2-нитрофлуорен или азид натрия), ПМП – препарат ((1,4-1,6) × 109)
Таблица 2 – Величина мутагенного индекса (МИ) биопрепарата на основе молочнокислых и пропионовокислых микроорганизмов
|
Показатель |
Мутагенный индекс |
|
|
ТА98 |
ТА100 |
|
|
Негативный контроль (основа препарата)* |
1 |
1 |
|
Позитивный контроль (2-нитрофлуорен или азид натрия) |
3,8 |
9,6 |
|
Препарат ((1,4-1,6) × 109)* |
1,0-1,1 |
0,96-1,07 |
Примечание: * - различия между вариантами статистически не значимы (р>0,05)
Следовательно, изучаемый препарат на основе молочнокислых и пропионовокислых микроорганизмов не вызывает мутации типа замены пар оснований и сдвига рамки считывания, поскольку не вызывает повышения частоты реверсий ни в штамме S. typhimurium ТА98, ни в ТА100.
Заключение. Таким образом, методами оценки индукции генных мутации, установлено, что пробиотический препарат и содержащиеся в нем метаболиты штаммов пробиотиков в качестве активного компонента не представляют мутагенной опасности.
Список литературы Оценка мутагенной активности биопрепарата на основе молочнокислых и пропионовокислых микроорганизмов в условиях in vitro
- Абилев, С.К. Ускоренные методы прогнозирования мутагенных и бластомогенных свойств химических соединений. Итоги науки и техники / С.К. Абилев, Г.Г. Порошенко // Сер. Токсикология. М.: ВИНИТИ, 1986. - Т. 14. - 171 с.
- Ильинская, О.Н. Краткосрочные тест-системы для определения генотоксичности / О.Н. Ильинская, А.Б. Маргулис // Методическое руководство. - Казань: КГУ. - 2005. - 32 c.
- Мухаммадиева, А.С. Выделение и изучение морфологических и биохимических свойств новых штаммов молочнокислых бактерий, перспективных для создания пробиотических препаратов / А.С. Мухаммадиева, Р.С. Мухаммадиев, Р.С. Мухаммадиев, Л.Р. Валиуллин // Ветеринарный врач. - 2020. - № 3. - С. 3946.
- Мухаммадиев, Р.С. Исследование цитотоксичности молочнокислых и пропионовокислых бактерий в тесте in vitro / Р.С. Мухаммадиев, Р.С. Мухаммадиев, Е.В. Скворцов, И.И. Идиятов, Л. Р. Валиуллин // Ветеринарный врач. - 2019. - № 4. - С. 17-20.
- Фисенко, В.П. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / В.П. Фисенко // М.: Ремедиум. - 2000. - 398 с.
- De Vuyst, L. Biodiversity, ecological determinants, and metabolic exploitation of sourdough microbiota / L.De Vuyst, G. Vrancken, F. Ravyts, T. Rimaux, S. Weckx // Food microbiology. - 2009. - Vol. 26. - № 7. - P. 666-675.
- Giraffa, G. Importance of lactobacilli in food and feed biotechnology / G. Giraffa, N. Chanishvili, Y. Widyastuti // Research in microbiology. - 2010. - Vol. 161. - P. 480-487.
- Mc Cann, J. Detection of carcinogens as mutagens in the Salmonella/microsome test: assay of 300 chemicals / J. Mc Cann, E. Choi, E. Yamasaki, B.N. Ames // Proc. Natl Acad. Sci. USA. -1975. - Vol. 72. - P. 5135-5139.
- Takeda, K. Effects of a fermented milk drink containing Lactobacillus casei strain Shirota on the human NK-cell activity / K. Takeda, K. Okumura // J. Nutr. - 2007. -Vol. 137. - P. 791-793.
- Von Wright, A. Regulating the safety of probiotics the European approach / A. Von Wright // Curr. Pharm. Des. - 2005. -Vol. 11. - P. 17-23.


