Оценка нарушений протеомного профиля плазмы крови у детей при ингаляционной экспозиции мелкодисперсной пыли, содержащей ванадий
Автор: Зайцева Н.В., Землянова М.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 1 (13), 2016 года.
Бесплатный доступ
Представлены результаты исследований и оценки белкового профиля плазмы крови у детей, подвергающихся длительной экспозиции мелкодисперсной пыли, содержащей ванадий, в зоне влияния источников металлургического производства. Установлено, что в условиях неудовлетворительного качества атмосферного воздуха селитебной застройки по содержанию пыли ванадия пятиокиси на уровне до 1,2 ПДКсс (34 RfCchr), взвешенных веществ - до 0,6 ПДКсс (1,2 RfCchr) у экспонированных детей в возрасте 4-7 лет формируется концентрация ванадия в крови, до 6 раз превышающая референтный уровень. Технологией протеомного анализа показано, что у детей с повышенным содержанием ванадия в крови наблюдается изменение протеомного профиля плазмы крови в виде увеличения относительного объема кислого гликопротеина альфа-1; снижения кластерина, аполипопротеина A-IV, альфа-2-HS-гликопротеина, доказанно связанное с концентрацией ванадия в крови. При отсутствии своевременных мер первичной и вторичной профилактики и сохранении устойчивой экспозиции ванадия выявленные клеточно-молекулярные нарушения позволяют прогнозировать в дальнейшем развитие функциональных изменений на тканевом и органном уровне в виде раннего развития остеопороза и костно-суставной патологии, атеросклеротических изменений сосудов, аутоиммунных аллергических процессов на фоне нарушения иммунной регуляции, онкологических заболеваний.
Протеомный профиль, плазма крови, ванадий, молекулярные маркеры, ингаляционная экспозиция
Короткий адрес: https://sciup.org/14237936
IDR: 14237936 | УДК: 614.878.086
Текст научной статьи Оценка нарушений протеомного профиля плазмы крови у детей при ингаляционной экспозиции мелкодисперсной пыли, содержащей ванадий
Ванадий, содержащийся в составе мелкодисперсной пыли, входит в перечень химических веществ, формирующих неудовлетворительное качество атмосферного воздуха селитебных территорий в зоне влияния металлургических производств по переработке ванадийсодержащих руд.
Ванадий и мелкодисперсная пыль входят в список загрязняющих веществ атмосферного воздуха, рассматриваемых в «Рекомендациях ВОЗ по качеству воздуха в Европе», подготовленных в сотрудничестве с международной программой по химической безопасности и Европейской комиссией (ЕС) в 2000 г.
При аэрогенном поступлении в организм в составе аэрозоля конденсации или дезинтегра- ции (мелкодисперсной пыли) ванадий характеризуется большей степенью токсичности по сравнению с элементарным ванадием и его сплавами с другими металлами – феррованадием, карбидом ванадия. Отличается высокой реакционной способностью, проникает через гематоэнцефалический барьер, кумулируется во внутриклеточных и тканевых структурах. Характеризуется наряду с общерезорбтивным действием специфическими эффектами раздражающего и системного действия на органы и системы-мишени, в первую очередь органы дыхания (токсикологические профайлы Агентства по регистрации токсичных веществ и заболеваний США (ATSDR, 2009)) [9]. Известны определенные генотоксические и мутагенные эффек-
ты [16]. Негативные эффекты воздействия ванадия реализуются на клеточно-субклеточном уровне в виде индукции свободнорадикальных процессов в результате взаимодействия с белковыми комплексами I, III и IV дыхательной цепи, что приводит к развитию окислительного стресса, необратимым модификациям нуклеиновых кислот и белков и, как следствие, к нарушению их структуры и функциональной активности на молекулярном уровне [18].
Исследование протеомного профиля плазмы крови человека с применением технологий протеомного анализа, установление белков-мишеней, изменение спектра которых ассоциировано с воздействием мелкодисперсной пыли, содержащей ванадий, является актуальной задачей. Результаты оценки протеомного профиля расширяют доказательную базу причинения вреда здоровью, повышают эффективность ранней диагностики и лечебно-профилактических мероприятий [4].
Данные исследования продолжают цикл работ по организации и проведению изучения у детей нарушений белкового профиля плазмы крови в условиях воздействия тяжелых металлов, проводимых Федеральным научным центром медико-профилактических технологий управления рисками здоровью населения.
Материалы и методы. Гигиеническая оценка содержания мелкодисперсной пыли и пя-тиокиси ванадия выполнена на примере территории с размещением источников металлургического производства по переработке ванадийсодержащей руды. Осуществлено аналитическое обобщение результатов мониторинговых наблюдений за период 2010–2015 гг. (данные ГУ Пермского ЦГМС и Роспотребнадзора по Пермскому краю) и натурных исследований (данные ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения»), расчетов рассеивания загрязняющих веществ в атмосферном воздухе от стационарных источников методом пространственно-временного анализа в среде ГИС ARC/View (версия 3.2). Оценку полученных концентраций загрязняющих веществ в атмосферном воздухе населенных мест проводили на основании сравнительного анализа с предельно допустимыми и референтными концентрациями для хронического ингаляционного воздействия (ПДК сс и RfC chr ) [1, 5]. Зоной влияния источника считали территорию, на которой достигаются приземные концентрации выше 0,05 ПДК сс [6].
Проведено комплексное углубленное обследование 44 детей в возрасте 4–7 лет, постоянно проживающих в жилой застройке, расположенной в зоне влияния выбросов металлургического производства по переработке ванадийсодержащих руд (в воздух от предприятия поступала мелкодисперсная пыль, содержащая ванадий). Группу сравнения составили дети аналогичного возраста, проживающие на селитебной территории, максимально удаленной от зоны влияния компонентов выбросов металлургического производства (38 человек). Группы были сопоставимы по социально-бытовым условиям жизни, отсутствию отягощенного наследственного анамнеза, профессиональных вредностей у родителей, качеству питьевой воды. Обследование выполнено при обязательном получении письменного информированного согласия родителей детей, включенных в выборку, в соответствии с соблюдением этических норм, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации 1964 г. (с изменениями и дополнениями 2008 г.). Качество исследований обеспечено систематическим участием в федеральной и международной системе оценки качества.
Химико-аналитическое исследование содержания ванадия в крови детей выполнено методом масс-спектрометрии с индуктивно сязанной плазмой в соответствии с МУК 4.1.3230-14 [3]. Установленные концентрации ванадия в крови оценивали на основании сравнительного анализа с референтным уровнем в крови ( RfL ) [7]. Дети, имеющие концентрацию ванадия в крови выше референтного значения ( С Va > RfL Va ), составили группу наблюдения; имеющие концентрацию ванадия в крови на уровне или ниже референтного значения ( С Va ≤ RfL Va ) – группу сравнения.
Для исследования изменений белкового состава (протеома) использовали термостабильную фракцию плазмы крови, подготовленную в соответствии с принятыми методами [4, 10, 14, 15]. Технология протеомного анализа включала фракционирование белков плазмы крови методом двухмерного электрофореза в полиакриламидном геле, выполненное с использованием комплекса оборудования для проведения двухмерного электрофореза (BioRad, США) и в соответствии с рекомендованными методиками [12, 13]. Фотографирование геля осуществляли с помощью системы визуализации GelDoc XR (Bio-Rad, США) с разрешением 254 dpi. В результате фракционирова- ния термостабильной фракции плазмы крови методом двухмерного электрофореза получены протеомные карты, содержащие информацию о конкретных белках и их характеристиках (молекулярной массе и изоэлектрической точке), необходимых для последующей идентификации белков. Анализ протеомных карт (распределение гелей по группам, нормализация гелей, распознавание пятен, вычисление относительного объема пятен, выявление межгрупповых различий) осуществляли с помощью программного комплекса PDQuest 8.0 (Bio-Rad, США). Для каждого белкового пятна рассчитывали относительный объем, выраженный в процентах объема от общего объема значимых пятен на геле (V %). Средний относительный объем пятен рассчитывали для каждой группы. В результате проведения двухмерного электрофореза плазмы крови детей исследуемых выборок получены протеомные карты, в которых интенсивность и площадь белковых пятен пропорциональны количеству белка в плазме крови. Оценку частоты встречаемости и относительного объема белковых пятен в протеомных картах у детей с повышенным содержанием ванадия в крови проводили на основании сравнительного анализа с результатами детей, имеющих содержание ванадия в крови на уровне референтного значения.
Подготовка белковых пятен к идентификации методом ВЭЖХ-МС/МС включала вырезание белковых пятен и отмывку геля от серебра раствором тиосульфата натрия и гексацианоферрата (III) калия с последующим трипсинолизом белков в геле под действием диметилиро-ванного трипсина (производство Sigma) в соответствии с рекомендованными методиками [11, 17] и лиофилизацией полученного гидролизата белков на центробежном вакуумном концентраторе CentriVap (Labconco, США).
Хроматографирование белкового гидролизата после его предварительного растворения в 5%-ном ацетонитриле с добавлением 0,1%-ной муравьиной кислоты (FA) выполнено в оптимально подобранных условиях: подвижная фаза: А) вода, 0,1 % FA; В) ацетонитрил, 0,1 FA; градиент: уравновешивание (5 % В) – 15 мин; 5–80 % В – 140 мин; 80 % В – 20 мин; скорость потока: 200 нл/мин; объем пробы: 20 мкл; Т °С колонки: 25,0 °С; Т °С образца: 5,0 °С.
Масс-спектрометрия полученных образцов выполнена в ходе информационно-зависимого эксперимента на тандемном масс-спектрометре 4000 QTRAP (AB Sciex, Канада) с источником ионов NanoSpray. По полученным спектрам строили последовательность аминокислот в пептиде, а затем осуществляли поиск данной последовательности пептидов в составе белков по доступным базам данных. Идентификация белков выполнена по спектрам дочерних ионов в базе данных SwissProt при помощи поисковой машины Mascot (Matrixscience, Великобритания). Критерием достоверности идентификации белка являлась идентификация пептидов со статистической значимостью р ≤ 0,05.
Выявление и оценка связи относительного объема выделенных белковых пятен в проте-омной карте c концентрацией ванадия в крови выполнена на основании расчета показателя отношения шансов ( OR ) и его доверительного интервала ( DI ) [8]. Критерием наличия связи «концентрация ванадия в крови – показатель эффекта» являлось OR ≥ 1.
Результаты и их обсуждение. Оценка качества атмосферного воздуха селитебной застройки в зоне влияния источников выбросов металлургического производства свидетельствует о неудовлетворительной ситуации в течение последних 5 лет по содержанию пыли ванадия пятиокиси на уровне до 1,2 ПДК сс , взвешенных веществ – до 0,6 ПДК сс , мелкодисперсной пыли фракций РМ 2,5 и РМ 10 – 0,58–0,73 ПДК мр . Превышение референтных уровней для хронического ингаляционного воздействия по ванадию составило 34 RfC chr , взвешенным веществам – 1,2 RfC chr ,. Зона загрязнения атмосферного воздуха пылью ванадия пятиокиси (на уровне от 1,0 до 2,2 ПДК сс ), в которой проживает около 20 тысяч населения, в том числе 4 тысячи детей в возрасте от 0 до 14 лет, распространяется от места расположения металлургического производства на селитебную территорию в южном, восточном, северном и северо-восточном направлениях.
Углубленные исследования показали, что в крови детей, подвергающихся длительной ингаляционной экспозиции мелкодисперсной пыли, содержащей ванадий, регистрируются повышенные концентрации ванадия. Установлено, что средняя концентрация ванадия в крови составила 0,00081 ± 0,00018 мг/дм3 и в 6,1–6,2 раза превысила аналогичные показатели в крови детей группы сравнения (0,000132 ± 0,00001 мг/дм3, р = 0,0001) и референтный уровень. Средняя концентрация ванадия в крови детей является маркером хронической экспозиции, что подтверждено наличием достоверной прямой зависимости (r = 0,75; p = 0,0005) концентрации ванадия в крови от его среднегодовой концентрации в атмосферном воздухе исследуемой территории, описываемой линейным уравнением вида:
y = 0,00078 + 21,95х, где у – концентрация ванадия в крови, мг/дм3; х – среднегодовая концентрация ванадия в атмосферном воздухе, мг/м3.
Сравнительный анализ относительного объема белковых пятен в протеомных картах плазмы крови детей обеих групп позволил выявить наличие достоверных различий в относительном объеме ряда белковых пятен. Данные по средним относительным объемам белковых пятен с распределением по группам представлены в табл. 1 и на рис. 1.
Сравнительный анализ протеомных карт плазмы крови в исследуемых выборках показал, что у детей с повышенным содержанием в крови ванадия увеличен относительный объем белкового пятна 0805 (в среднем в 1,84 раза); уменьшен относительный объем пятен 2304 (в 1,35 раза), 2504 (в 1,85 раза), 1706 (в 1,61 раза) относительно аналогичных показателей у детей группы сравнения. В результате масс-спектрометрического детектирования отличающихся белков получены спектры дочерних ионов пептидов, пример которых представлен на рис. 2.
Идентификация белков с измененным относительным объемом показала, что белковый профиль плазмы крови у детей с повышенным содержанием ванадия в крови характеризуется значимым ( р ≤ 0,05) увеличением относительного объема кислого гликопротеина альфа-1, снижением относительного объема кластерина, аполипопротеина A-IV, альфа-2-HS-гликопро-теина. Оценка причинно-следственных связей «концентрация ванадия в крови – показатель эффекта» позволила установить, что у детей группы наблюдения вероятность изменения идентифицированных белков плазмы крови в 2,52–3,71 раза ( DI = 1,87–4,78; р = 0,0001–0,002) выше, чем в группе сравнения (табл. 2).
Таблица 1
Результаты денситометрического измерения относительного объема белковых пятен плазмы крови у обследуемых детей ( р ≤ 0,05)


Рис. 1. 2DE-гели плазмы крови детей: а – пример из группы сравнения; б – из группы наблюдения
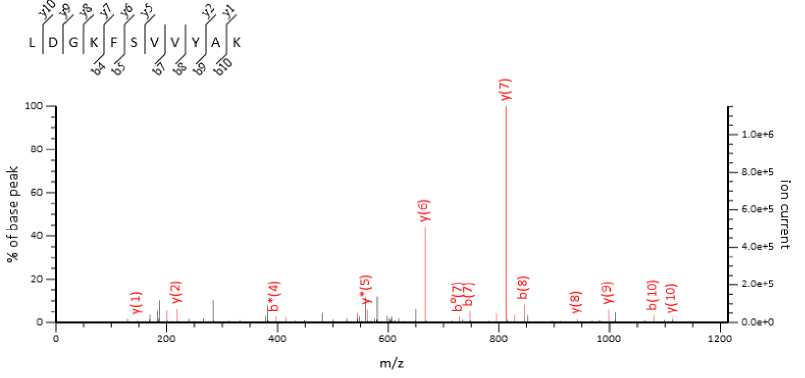
Рис. 2. Спектр пептида LDGKFSVVYAK, фрагмента FETUA_HUMAN (альфа-2-HS-гликопротеин) (база данных SwissProt) плазмы крови ребенка с повышенным содержанием ванадия в крови
Таблица 2
Показатели связи изменения протеомного профиля плазмы крови у детей от концентрации ванадия в крови
|
Показатель эффекта |
Группа |
Ответ на воздействие |
OR |
95 % DI |
|
|
есть |
нет |
||||
|
Снижение кластерина |
Наблюдения |
10 |
9 |
3,11 |
2,24–4,37 |
|
Сравнения |
5 |
14 |
|||
|
Увеличение кислого гликопротеина альфа-1 |
Наблюдения |
9 |
10 |
2,52 |
1,87–3,44 |
|
Сравнения |
5 |
14 |
|||
|
Снижение аполипопротеина A-IV |
Наблюдения |
12 |
7 |
2,94 |
2,10–3,95 |
|
Сравнения |
7 |
12 |
|||
|
Снижение альфа-2-HS-гликопротеина |
Наблюдения |
12 |
7 |
3,71 |
3,06–4,78 |
|
Сравнения |
6 |
13 |
|||
Выводы. Выполненное исследование показало, что у детей с повышенным содержанием ванадия в крови (до 6 раз превышающем референтный уровень) обнаружены достоверно значимые изменения протеомного профиля плазмы крови, выражающиеся в повышении относительного объема кислого гликопротеина альфа-1; снижения относительного объема кла-стерина, аполипопротеина A-IV, альфа-2-HS-гликопротеина. Выявленные изменения показателей протеома доказанно связаны с концентрацией ванадия в крови. Установленные изменения протеомного профиля у детей с повышенным содержанием ванадия в крови позволяют предположить развитие на молекулярном уровне негативных эффектов, характеризующихся нарушением регуляции клеточной пролиферации и апоптоза, снижением активности противовоспалительной и усилением активности воспалительной реакции, снижением активности минерализации костной ткани, дислипидемией.
Таким образом, результаты выполненных исследований позволили установить, что в условиях неудовлетворительного качества атмосферного воздуха селитебной застройки по наличию мелкодисперсной пыли, содержащей ванадий (по пыли ванадия пятиокиси до 1,2 ПДКсс, взвешенным веществам – до 0,6 ПДКсс), у экспонированных детей уже в возрасте 4–7 лет формируется концентрация ванадия в крови, в 6,1–6,2 раза превышающая аналогичный показатель в крови неэкспонированных детей и референтный уровень. Изменения протеомного профиля плазмы крови, доказанно связанные с концентрацией ванадия в крови, характеризуются изменениями на молекулярном уровне в виде повышения относительного объема кислого гликопротеина альфа-1, снижения относительного объема кла-стерина, аполипопротеина A-IV, альфа-2-HS-гликопротеина. При отсутствии своевременных мер первичной и вторичной профилактики и сохранении устойчивой экспозиции можно прогнозировать в дальнейшем развитие функцио- нальных нарушений на тканевом и органном уровнях в виде раннего развития остеопороза и костно-суставной патологии, атеросклеротических изменений сосудов, аутоиммунных аллергических процессов на фоне нарушения иммунной регуляции, онкологических заболеваний.
Использование идентифицированных белков в качестве маркеров негативных эффектов у детей в зонах влияния источников выбросов металлургических производств по переработке ванадийсодержащих руд является целесообразным для расширения доказательной базы причинения вреда здоровью при проведении гигиенической экспертизы, раннем выявлении и профилактике рискассоциирован-ных заболеваний.
Список литературы Оценка нарушений протеомного профиля плазмы крови у детей при ингаляционной экспозиции мелкодисперсной пыли, содержащей ванадий
- ГН 2.1.6.1338-03. Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. -М.: Федеральный центр Госсанэпиднадзора Минздрава России. -2004. -143 с.
- Зайцева Н.В., Май И.В., Клейн С.В. К вопросу установления и доказательства вреда здоровью населения при выявлении неприемлемого риска, обусловленного факторами среды обитания//Анализ риска здоровью. -2013. -№ 2. -С. 14-27.
- МУК 4.1.3230-14. Измерение массовой концентрации химических элементов в биосубстратах (кровь, моча) методом масс-спектрометрии с индуктивно связанной плазмой: методические указания. -М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2014.
- Протеомное исследование термостабильной фракции сыворотки пациентов с различными опухолями с применением двумерного электрофореза/Е.И. Гоуфман, С.А. Мошковский, О.В. Тихонова, И.Г. Лохов, В.Г. Згода, М.В. Серебрякова, И.Ю. Торопыгин, М.А. Власова, М.Р. Сафарова, О.В. Макаров, А.И. Арчаков//Биохимия. -2006. -Т. 71, вып. 4. -С. 445-453.
- Р 2.1.10.1920-04. Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду. -М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004. -143 с.
- РД 52.04.186-89. Руководство по контролю загрязнения атмосферы . -URL http://ohranatruda.ru/ot_biblio/normativ/data_normativ/44/44486/(дата обращения: 10.11.2015).
- Тиц Н.М. Клиническое руководство по лабораторным тестам. -М.: ЮНИМЕД-пресс, 2003. -943 с.
- Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины. -М.: Медиа Сфера, 1998. -352 с.
- Draft Toxicological Profile for Vanadium: U.S. Department of Health and Human Services. Agency for Toxic Substances and Disease Registry. -Atlanta, 2009. -206 р.
- Dodeca Silver Stain Kit. Instruction Manual . -URL: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/4110150B.pdf (дата обращения: 16.06.2015).
- Mass spectrometric identification of proteins from silver-stained polyacrylamide gel: A method for the removal of silver ions to enhance sensitivity/Farzin Gharahdaghi, Catherine R. Weinberg, Denise A. Meagher, Brian S. Imai, Sheenah M. Mische//Electrophoresis. -1999. -№ 20. -Р. 601-605.
- PROTEAN i12 IEF System. Instruction Manual . -URL: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/10022069A.pdf (дата обращения: 16.07.2015).
- PROTEAN II xi 2D cell. Instruction Manual . -URL: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1651801.pdf (дата обращения: 16.07.2015).
- QuantiPro BCA assay kit. Technical bulletin . -URL: http://www.sigmaaldrich. com/content/dam/sigma-aldrich/docs/Sigma/Bulletin/qpbcabul.pdf (дата обращения: 16.06.2015).
- ReadyPrep 2-D starter kit. Instruction Manual . -URL: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/4110009A.pdf (дата обращения: 16.06.2015).
- Stemmler A.J., Burrows C.J. Guanine versus deoxyribose damage in DNA oxidation mediated by vanadium (IV) and vanadium (V) complexes//J. Biol. Inorg. Chem. -2001. -№ 6. -Р. 100-106.
- Trypsin from porcine pancreas. Proteomics grade, Bioreagent, Dimethylated. Technical bulletin . -URL: http://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Bulletin/t6567bul.pdf (дата обращения: 16.06.2015).
- Vanadium induces oxidative stress in isolated rat liver mitochondria/M.-J. Hosseini, J. Pourahmad, F. Shaki, M. Ghazi-Khansari//Toxicology Letters. -2012. -№ 211. -167 р.


