Оценка окислительной модификации белков спермоплазмы жеребцов (Equusferus caballus L.) разного возраст
Автор: Атрощенко М.М., Енгалычева М.Г., Шитикова А.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Стресс и продуктивность
Статья в выпуске: 4 т.58, 2023 года.
Бесплатный доступ
Криоконсервация семени жеребцов - современный широко распространенный в коневодстве способ сохранения генетического материала животных. Однако замораживание и последующее оттаивание снижает репродуктивные характеристики сперматозоидов. Одним из факторов, обусловливающих повреждение половых клеток, становится окислительный стресс, в результате которого повреждаются макромолекулы, в том числе протеины. С возрастом степень окислительного стресса нарастает, количество поврежденных белков увеличивается. В настоящей работе впервые установлено статистически значимое повышение содержания продуктов карбонилирования белков у возрастных животных по сравнению с более молодыми (в основном за счет альдегидных производных нейтрального характера). Впервые изучен резервно-адаптацтационный потенциал (РАП) спермоплазмы жеребцов. Обнаружено, что способность противостоять окислительному стрессу у молодых жеребцов достоверно выше, чем у возрастных. Нашей целью стала оценка спонтанной и индуцированной окислительной модификации белков, а также изучение резервно-адаптацтационного потенциала спермоплазмы у жеребцов разного возраста. Исследование проводили в 2020 году на 40 жеребцах ( Equus ferus caballus L.) чистокровной арабской и советской тяжеловозной пород (АО «Терский племенной конный завод № 169», Ставропольский край; Перевозский и Починковский конные заводы, Нижегородская обл.). От каждого жеребца получили по 3 эякулята с интервалом 48 ч. В I группу включили 20 жеребцов в возрасте от 14 лет до 21 года (средний возраст 15,8±1,9 года), во II группу - 20 жеребцов в возрасте от 3 до 5 лет (4,3±0,6 года). В каждом эякуляте определяли объем и концентрацию сперматозоидов в 1 мл спермы. Затем эякулят делили на две части, одну разбавляли лактозо-хелато-цитратно-желточной (ЛХЦЖ) средой в соотношении 1:3 и определяли прогрессивную подвижность (ПП) и выживаемость сперматозоидов при 4 °С. Для оценки выживаемости сперматозоидов при гипотермическом хранении спермы определяли их ПП с интервалом 24 ч вплоть до снижения ПП до 5 %. Сперму замораживали в парах жидкого азота в алюминиевых тубах объемом 18 мл по стандартной технологии ВНИИ коневодства и хранили в жидком азоте при -196 °С. Криоконсервированную сперму оттаивали на водяной бане при 40 °С в течении 90 с, после чего определяли ПП и выживаемость сперматозоидов при 4 °С. Другую часть эякулята центрифугировали при 3500 об/мин в течение 20 мин. После микроскопии супернатанта аликвоты семенной плазмы, свободные от сперматозоидов, замораживали в пробирках типа Эппендорф (2,0 мл) при -18 °С. Для количественной оценки окислительной модификации белков (ОМБ) использовали спектрофотометрический анализ 2,4-динитрофенилгидразонов, образовавшихся при взаимодействии карбонильных производных белков (альдегидов и кетонов) с 2,4-динитрофенилгидразином. Суммарное количество карбонильных производных регистрировали в нативной пробе биологического материала (спонтанная ОМБ) и после in vitro индукции окисления белков биологического материала реакционной смесью, содержащей растворы сульфата железа(II) и перекиси водорода (металл-катализируемая индуцированная ОМБ). Сравнение металл-катализируемой и спонтанной ОМБ позволяло оценить РАП - способность противостоять окислительному стрессу. Спектрофотометрические измерения проводили на 14 длинах волн: для регистрации альдегид-динитрофенилгидразонов нейтрального характера - в диапазоне 260-280 нм, основного характера - 258-264 и 428-520 нм, кетон-динитрофенилгидразонов нейтрального характера - 363-370 нм, основного характера - 430-434 и 524-535 нм. Статистически значимые различия по показателям качества спермы между животными двух возрастных групп установили только по выживаемости сперматозоидов при гипотермическом хранении разбавленной (р оп соответственно 531,7 и 384,3 Еоп/г белка, р оп/г белка, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Жеребцы, сперма, спермоплазма, криоконсервация, окислительный стресс, окислительная модификация белков
Короткий адрес: https://sciup.org/142239843
IDR: 142239843 | УДК: 636.1.082.4:577.1 | DOI: 10.15389/agrobiology.2023.4.660rus
Текст научной статьи Оценка окислительной модификации белков спермоплазмы жеребцов (Equusferus caballus L.) разного возраст
Окислительный стресс (ОС) приводит к повреждению сперматозоидов (1, 2) и снижению качества нативной и криоконсервированной спермы (3-5). Причиной развития ОС становится чрезмерная продукция активных форм кислорода (АФК), истощение антиоксидантных возможностей организма или совокупность этих факторов. В результате преобладания проок-сидантных процессов над антиоксидантными возможностями клеток АФК взаимодействуют с основными макромолекулами, при этом возникают необратимые повреждения нуклеиновых кислот, происходит перекисное окисление липидов (ПОЛ), окисление белков, в том числе важнейших ферментов и структурных протеинов (6).
В качестве одного из маркеров выраженности ОС используют количественную оценку окислительной модификации белков (ОМБ), поскольку этот показатель отражает степень повреждения аминокислотных остатков протеинов свободными радикалами кислорода и азота, а также продуктами ПОЛ (7). Продукты ОМБ появляются в клетках раньше, чем другие дериваты окислительного повреждения макромолекул, они устойчивы и доступны для лабораторной диагностики (8).
Белки сперматозоидов и спермоплазмы, как и другие белки в организме жеребцов, становятся главными мишенями для АФК и азота из-за высокой чувствительности к свободным радикалам (9, 10). Многочисленные и разнообразные по структуре свободные радикалы образуются в организме в результате ферментативных и неферментативных окислительновосстановительных реакций, фотохимических и ионизирующих воздействий. В процессе окислительной модификации аминокислотных остатков белков образуются карбонильные производные — альдегиды и кетоны, при этом альдегиды принято считать ранними маркерами окислительной деструкции протеинов, а кетонные производные — более поздними (6, 8, 9). Важно помнить, что ОМБ происходит не только вследствие нарастания концентрации свободных радикалов, но и в результате смещения баланса между антиоксидантными и прооксидантными системамии в пользу вторых.
С возрастом в организме повышается продукция АФК и накапливается значительное количество продуктов ОС. Это связано с митохондриальной дисфункцией, высокой продукцией АФК на фоне истощения антиоксидантных возможностей организма, нарушением работы протеасомной системы, деградации поврежденных белков (11).
В настоящей работе впервые определено содержание продуктов окислительной модификации белков в спермоплазме жеребцов разного возраста. Установлено статистически значимое повышение содержания продуктов карбонилирования белков у возрастных животных по сравнению с более молодыми, в основном за счет альдегидных производных нейтрального характера. Впервые изучен резервно-адаптацтационный потенциал (РАП) спер-моплазмы жеребцов. Обнаружено, что способность противостоять окислительному стрессу у молодых жеребцов достоверно выше, чем у возрастных.
Целью настоящего исследования стала оценка спонтанной и индуцированной окислительной модификации белков, а также изучение ре-зервно-адаптацтационного потенциала спермоплазмы у жеребцов разного возраста.
Методика. Исследование проводили в 2020 году на 40 жеребцах
( Equus ferus caballus L.) чистокровной арабской и советской тяжеловозной пород (АО «Терский племенной конный завод ¹ 169», Ставропольский край; Перевозский и Починковский конные заводы, Нижегородская обл.). Сперму получали во время случного сезона (март-апрель) на кобылу в охоте с помощью искусственной вагины. От каждого жеребца было получено по 3 эякулята с интервалом 48 ч. Во время проведения экспериментальных исследований условия кормления и содержания жеребцов соответствовали установленным нормам.
Для оценки зависимости ОМБ и РАП спермоплазмы от возраста жеребцов были сформированы две опытные группы: в I группу включили 20 животных в возрасте от 14 лет до 21 года (средний возраст 15,8±1,9 года), во II группу — 20 животных в возрасте от 3 до 5 лет (4,3±0,6 года).
После получения спермы эякулят фильтровали через стерильную марлевоую салфетку. По завершении фильтрования и удаления секрета пузырьковидных желез в каждом эякуляте определяли объем и концентрацию сперматозоидов в 1 мл спермы. Затем эякулят делили на две части, одну разбавляли лактозо-хелато-цитратно-желточной (ЛХЦЖ) средой в соотношении 1:3 и определяли прогрессивную подвижность (ПП) и выживаемость сперматозоидов при 4 ° С. Объем эякулята (в мл) после фильтрации оценивали с помощью мерного цилиндра. Концентрацию сперматозоидов измеряли фотометром SDM1 («Minitube GmbH», Германия). Прогрессивную подвижность оценивали с использованием системы Argus CASA («ArgusSoft Ltd.», Россия) и микроскопа Motic BA 410 («Motic», Китай) в камере Маклера при 37 ° С.
Для оценки выживаемости сперматозоидов при гипотермическом хранении спермы определяли их прогрессивную подвижность с интервалом 24 ч вплоть до снижения ПП до 5 %. Сперму замораживали в парах жидкого азота в алюминиевых тубах объемом 18 мл по стандартной технологии ВНИИ коневодства и хранили в жидком азоте при - 196 ° С (12). Оттаивание криоконсервированной спермы проводили на водяной бане при 40 ° С в течении 90 с, после чего определяли прогрессивную подвижность и выживаемость сперматозоидов при 4 ° С.
Другую часть эякулята сразу же после получения спермы центрифугировали при 3500 об/мин в течение 20 мин (центрифуга ELMI CM-6M, «ELMI», Латвия). После микроскопии супернатанта аликвоты семенной плазмы, свободной от сперматозоидов, замораживали в пробирках типа Эп-пендорф (2,0 мл) при - 18 ° С до проведения исследований.
Для количественной оценки ОМБ использовали спектрофотометрический анализ 2,4-динитрофенилгидразонов, образовавшихся при взаимодействии карбонильных производных белков (альдегидов и кетонов) с 2,4-динитрофенилгидразином в соответствии с запатентованной методикой (13). Суммарное количество карбонильных производных регистрировали в нативной пробе биологического материала (спонтанная ОМБ) для определения фактического содержания in vivo образовавшихся карбонильных производных и после in vitro индукции окисления белков биологического материала реакционной смесью, содержащей растворы сульфата железа(II) и перекиси водорода (металл-катализируемая, индуцированная ОМБ). Добавление окислительной смеси способствовало дополнительному образованию карбонильных производных. Если в нативной пробе существовал резерв антиоксидантных систем и присутствовало мало аминокислотных остатков, способных быстро окислиться, то индуцированная ОМБ имела минимальное отличие от спонтанной. То есть сравнение металл-катализируемой и спонтанной ОМБ позволяло оценить резервно-адаптационный потенциал
(РАП) — способность противостоять ОС.
Спектрофотометрические измерения проводили на 14 длинах волн: для регистрации альдегид-динитрофенилгидразонов нейтрального характера (АДНФГн) — в диапазоне 260-280 нм, основного характера (АДНФГо) — 258-264 и 428-520 нм, кетон-динитрофенилгидразонов нейтрального характера (КДНФГн) — 363-370 нм, основного характера (КДНФГо) — 430-434 и 524-535 нм (спектрофотометр СФ-2000, «ОКБ Спектр», Россия). Анализу подвергалась площадь под кривой спектра поглощения ДНФГ-дериватов карбонильных производных белков (S). Полученные значения экстинкций соотносились с содержанием белка спермоплазмы, определенным по методу Лоури (единицы оптической плотности Е оп /г белка).
Статистический анализ проводили с использованием программ Statistica 13.3 («StatSoft, Inc.», США) и Microsoft Office Excel 2016. Нормальность распределения определяли по критерию Шапиро-Уилка. Для оценки статистической значимости различий независимых выборок использовали U -критерий Манна-Уитни. Статистически значимым считали результат при р < 0,05. Данные представлены в виде медианы ( Me ) и квартилей (Q1; Q3).
Результаты. При сравнительном анализе показателей спермограмм (табл. 1) выявили, что выживаемость сперматозоидов при гипотермическом хранении спермы от жеребцов старшего возраста была значительно ниже, чем при хранении спермы от молодых животных. Схожие результаты получили как в разбавленной и охлажденной (66,0 ч у взрослых жеребцов, 107,0 ч в группе молодых жеребцов, р < 0,05), так и в оттаянной после криоконсервации сперме (соответственно 17,3 ч и 49,0 ч, р < 0,01). Аналогичная зависимость выживаемости сперматозоидов от возраста обнаружена не только у жеребцов (14, 15), но и у мужчин (16, 17), а также у быков (18). Вероятной причиной этого становится накопление с возрастом необратимых повреждений нуклеиновых кислот, что отрицательно сказывается на репродуктивных свойствах (14, 19).
1. Сравнительная характеристика качества спермы у жеребцов ( Equus ferus caballus L.) чистокровной арабской и советской тяжеловозной пород разного возраста (Me [Q1; Q3]; АО «Терский племенной конный завод ¹ 169»,
Ставропольский край; Перевозский и Починковский конные заводы, Нижегородская обл., 2020 год)
|
Показатель |
I группа |
II группа |
|
Число жеребцов, n 20 20 Возраст, лет 15,8 [14,0; 21,0] 4,3 [3,0; 5,0] Нативная и разбавленная сперма ( n = 60) Объем эякулята, мл 47,4 [15,0; 80,0] 61,9 [39,0; 105,0] Концентрация сперматозоидов, млн/мл 153,9 [83,0; 245,0] 159,1 [105,0; 214,0] Прогрессивная подвижность, % 48,0 [35,0; 60,0] 50,3 [40,0; 65,0] Выживаемость сперматозоидов, ч 66,0 [36,0; 120,0] 107,0* [84,0; 120,0] Заморожено-оттаянная сперма ( n = 60) Прогрессивная подвижность % 17,1 [10,0; 30,0] 21,8 [13,0; 33,0] Выживаемость сперматозоидов, ч 17,3 [6,0; 72,0] 49,0** [12,0; 84,0] * и ** Различия между выживаемостью сперматозоидов при гипотермическом хранении разбавленной спермы у жеребцов I и II групп статистически значимы соответственно при р < 0,05 и р < 0,01. |
||
Выживаемость сперматозоидов при гипотермическом хранении спермы (4 ° С) была одним из основных показателей, характеризующих ее качество. Под выживаемостью сперматозоидов понимают их способность сохранять прогрессивную подвижность при гипотермическом хранении разбавленной охлажденной или криоконсервированной спермы. Выживаемость сперматозоидов статистически значимо коррелирует с их прогрессивной подвижностью и частотой жеребости у кобыл (20).
Суммарная спонтанная ОМБ спермоплазмы жеребцов I группы оказалась статистически достоверно выше, чем у жеребцов II группы (соответственно 531,7 и 384,3 Еоп/г белка, р < 0,05) (см. табл. 1). Этот результат свидетельствует о более выраженном окислительном стресск в пробах I группы и более существенном повреждении аминокислотных остатков белков спермоплазмы у жеребцов старшего возраста по сравнению с молодыми животными. Кроме того, в I группе отмечалось смещение спектра поглощения в сторону альдегидных производных нейтрального характера, содержание которых во II группе было ниже (367,6 и 255,8 Еоп/г белка, p < 0,05).
Небольшое количество АФК в сперматозоидах необходимо для передачи внутриклеточных сигналов, гиперактивации и акросомальной реакции, что обеспечивает оплодотворяющую способность. Однако избыточная продукция АФК неминуемо приводит к развитию ОС и повреждению макромолекул (21).
ОМБ спермоплазмы вызывает изменения их вторичной и третичной структуры, что негативно сказывается на функциональном состоянии протеинов, а значит, ухудшаются морфологические и репродуктивные характеристики спермы (22). Поврежденные белки могут подвергаться процессам агрегации и фрагментации за счет белок-белковых взаимодействий.
Накопление продуктов ОМБ, белковых агрегатов и дериватов, устойчивых к протеолизу, нарушает метаболизм клетки, приводя к апоптозу или некрозу (22, 23). Следует отметить, что в организме функционируют антиоксидантные и протеолитические системы, препятствующие развитию окислительного стресса и ОМБ, поэтому некоторые повреждения белковых молекул обратимы. К ферментативным антиоксидантным системам относят супероксиддисмутазу, глутатионредуктазу, каталазу, пероксидазу. Неферментативные антиоксиданты — это витамины Е и С, глутатион, каротиноиды, убихинон и другие метаболиты (21, 22). Однако с возрастом проокси-дантные системы все более преобладают над защитными, а степень ОМБ растет. Кроме того, сами антиоксидантные ферменты, как и другие протеины, подвергаются окислению, что приводит к нарушению их функционирования (24).
2. Спектр поглощения (Е оп /г белка) продуктов спонтанной и металл-катализи-руемой окислительной модификации белков (ОМБ) спермоплазмы жеребцов ( Equus ferus caballus L.) чистокровной арабской и советской тяжеловозной пород разного возраста (Me [Q1; Q3]; АО «Терский племенной конный завод № 169», Ставропольский край; Перевозский и Починковский конные заводы, Нижегородская обл.; 2020 год)
|
Вид карбонильных производных |
I группа (от 14 лет до 21 года; n = 20) |
II группа (от 3 до 5 лет; n = 20) |
|
индуцированная спонтанная ОМБ ОМБ |
индуцированная спонтанная ОМБ ОМБ |
|
|
S АДНФГн 367,6 [162,8; 500,5] 374,7 [236,5; 785,9] 255,8 [122,8; 328,1] 315,3 [193,8; 349,5] S КДНФГH 83,9 [47,4; 131,5] 105,3 [74,9; 386,4] 69,9 [30,4; 84,3] 76,4 [66,0; 122,5] S АДНФГо 64,6 [40,7; 141,1] 84,0 [66,1; 323,4] 49,6 [29,5; 71,1] 71,4* [62,4; 98,6] S кднФГо 11,3 [6,9; 25,2] 13,8 [10,8; 43,0] 9,6 [5,1; 12,3] 11,8 [11,4; 19,4] S общ. _________________ 531,7 [264,6; 787,6] 562,8 [364,2; 1519,7] 384,3 [172,6; 490,4] 484,7* [334,9; 598,4] Примечание. S АДНФГн , S кднФГн , S АДНФГо , S кднФГо — соответственно площади под кривыми графиков поглощения альдегид-динитрофенилгидразонов нейтрального характера, кетон-динитрофенилгидразо-нов нейтрального характера, альдегид-динитрофенилгидразонов основного характера, кетон-динитрофе-нилгидразонов основного характера, S общ. — суммарная площадь фигуры, образовавшейся при построении кривой графика поглощения ДНФГ-дериватов карбонильных производных белков на разных длинах волн * Различия между металл-катализируемой и спонтанной ОМБ спермоплазмы жеребцов статистически значимы при p < 0,05. |
||
Преобладание у жеребцов старшего возраста альдегидных производных нейтрального характера (табл. 2) указывало на окислительное повреждение аминокислотных остатков цистеина, глутамина, аспарагина, триптофана, тирозина, метионина, лейцина, пролина. В результате окисле- ния тиольной группы цистеина формируются дисульфидные сшивки (21, 25). При этом меняется структурно-функциональное состояние белков, содержащих остатки цистеина. В сперме жеребцов присутствует ряд белков
CRISPS (cysteine-rich secretory proteins) — протеинов, богатых цистеином (26). CRISP, обнаруженные в семенниках и придатках семенников млекопитающих, вовлечены в процесс оплодотворения. При сперматогенезе белок CRISP2 включается в акросому, где, как предполагается, участвует в адгезии половых клеток с клетками Сертоли. Также CRISP2 служит частью хвоста сперматозоидов и участвует в регуляции биения жгутиков. Белок CRISP3 обнаружен в семенной жидкости, выделяется из простаты, его функция неизвестна (26-28). Окислительные модификации остатков цистеина могут негативно сказаться на функционировании этих белков.
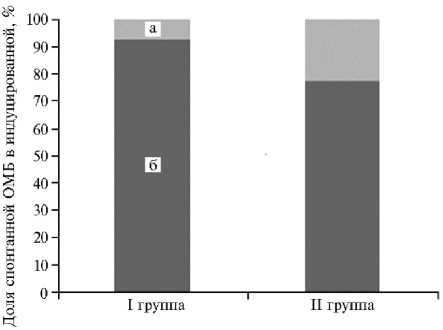
Резервно-адаптационный потенциал спермоплазмы жеребцов ( Equus ferus caballus L.) чистокровной арабской и советской тяжеловозной пород разного возраста : а — индуцированная окислительная модификация белков, б — спонтанная окислительная модификация белков; I группа — взрослые жеребцы (от 14 лет до 21 года), II группа — молодые жеребцы (от 3 до 5 лет) (АО «Терский племенной конный завод ¹ 169», Ставропольский край; Перевозский и Починковский конные заводы, Нижегородская обл.; 2020 год).
Оценка индуцированной ОМБ также выявила более высокое суммарное количество карбонильных производных в I группе, но степень нарастания количества карбонильных производных при воздействии окислительной смеси оказалась намного выше по отношению к изначальному уровню спонтанной ОМБ в группе молодых жеребцов (табл. 2, рис.). Полученные данные указывают на то, что в спермо-плазме молодых жеребцов есть аминокислотные группы белков, которые потенциально могут подвергнуться окислительному стрессу, однако in vivo этого не происходило, вероятно, благодаря активной работе антиоксидантных систем, препятствующих повреждению белковых молекул (29). Это подтверждает и тот факт, что при индуцированном окислении в пробах значительно возросла доля альдегидных производных нейтрального и основного характера — ранних маркеров окислительной деструкции. Полученные результаты указывают на высокий РАП у молодых жеребцов.
В I группе добавление реакционной окислительной смеси повысило содержание карбонильных производных (см. рис.), но не столь существенно относительно изначальных показателей, что указывает на значительное накопление in vivo поврежденных аминокислотных радикалов белков спер-моплазмы и истощении РАП у возрастных жеребцов.
Таким образом, суммарная окислительная модификация белков спермоплазмы жеребцов чистокровной арабской и советской тяжеловозной пород старшего возраста выше, чем у более молодых животных (p < 0,05). Резервно-адаптационный потенциал спермоплазмы молодых жеребцов существенно превышает таковой у возрастных животных (p < 0,05), что может положительно сказываться на репродуктивных характеристиках нативной и криоконсервированной спермы. Более высокое содержание продуктов карбонилирования белков спермоплазмы у жеребцов старшего возраста указывает на наличие окислительного стресса, что может быть одной из причин снижения выживаемости сперматозоидов.
Список литературы Оценка окислительной модификации белков спермоплазмы жеребцов (Equusferus caballus L.) разного возраст
- Bisht S., Faiq M., Tolahunase M., Dada R. Oxidative stress and male infertility. Nature Reviews Urology, 2017, 14(8): 470-485 (doi: 10.1038/nrurol.2017.69).
- Wyck S., Herrera C., Requena C.E., Bittner L., Hajkova P., Bollwein H., Santoro R. Oxidative stress in sperm affects the epigenetic reprogramming in early embryonic development. Epigenetics & Chromatin, 2018, 11(1): 60 (doi: 10.1186/s13072-018-0224-y).
- Lone F.A., Naikoo M., Khatun A., Shah R.A., Pampori Z.A., Khan H.M., Ahanger A.A. Idebe-none improves quality of ram sperm by mitigating oxidative stress during cryopreservation. Cryo-biology, 2019, 90: 15-20 (doi: 10.1016/j.cryobiol.2019.09.004).
- Rodrigues R.B., Uczay M., Brito V.B., Godoy A.C., Moura D.J., Vogel C., Vasconcelos A.C.N., Streit D.P. Jr. Oxidative stress and DNA damage of Zebrafish sperm at different stages of the cryopreservation process. Zebrafish, 2021, 18(2): 97-109 (doi: 10.1089/zeb.2020.1942).
- Moubasher A.E., Taha E.A., Younis A., Fakhry M.E., Morsy H. Testicular tissue oxidative stress in azoospermic patients: Effect of cryopreservation. Andrologia, 2020, 52(11): e13817 (doi: 10.1111/and.13817).
- Barati E., Nikzad H., Karimian M. Oxidative stress and male infertility: current knowledge of pathophysiology and role of antioxidant therapy in disease management. Cellular and Molecular Life Sciences, 2020, 77(1): 93-113 (doi: 10.1007/s00018-019-03253-8).
- Теплов С.А., Абаленихина Ю.В., Фомина М.А., Матвеева И.В. Изменение спектра погло-щения продуктов окислительной модификации белков печени крыс в условиях дефицита синтеза оксида азота различной выраженности. Наука молодых — Eruditio Juvenium, 2016, 1: 50-54.
- Hawkins C.L., Davies M.J. Detection, identification, and quantification of oxidative protein modifications. The Journal of Biological Chemistry, 2019, 294(51): 19683-19708 (doi: 10.1074/jbc.REV119.006217).
- Čolak E. New markers of oxidative damage to macromolecules. Journal of Medicak Biochemiastry, 2008, 27(1): 1-16 (doi: 10.2478/v10011-007-0049-x).
- Звягина В.И., Шумаев К.Б., Бельских Э.С., Урясьев О.М., Ахмедова С.Р., Марся-нова Ю.А., Шитикова А.М., Сучкова О.Н. Протективные эффекты L-аргинина на мито-хондрии эпидидимиса крыс при гипергомоцистеинемии, вызванной длительной метиони-новой нагрузкой. Российский медико-биологический вестник имени академика И.П. Павлова, 2022, 30(4): 457-470 (doi: 10.17816/PAVLOVJ109410).
- Zhang H., Davies K.J.A., Forman H.J. Oxidative stress response and Nrf2 signaling in aging. Free Radical Biology Medicine, 2015, 88(Pt B): 314-336 (doi: 10.1016/j.freeradbiomed.2015.05.036).
- Науменков А.И., Романькова Н.К. Лактозо-хелато-цитратно-желточный разбавитель спермы жеребца. В сб.: Теория и практика совершенствования пород лошадей. Научные труды ВНИИК. Дивово, 1971, XXV: 128-132.
- Фомина М.А., Абаленихина Ю.В., Фомина Н.В., Терентьев А.А. Способ комплексной оценки содержания продуктов окислительной модификации белков в тканях и биологических жидкостях. Патент 2524667 РФ. МПК G01N 33/52. Заявл. 21.01.13. Опубл. 27.07.14.
- Castro R., Morales P., Parraguez V.H. Post-thawing sperm quality in Chilean purebred stallions: effect of age and seasonality. Journal of Equine Veterinary Science, 2020, 92: 03170 (doi: 10.1016/j.jevs.2020.103170).
- Greiser T., Sieme H., Martinsson G., Distl O. Breed and stallion effects on frozen-thawed semen in warmblood, light and quarter horses. Theriogenology, 2020, 142: 8-14 (doi: 10.1016/j.theri-ogenology.2019.09.033).
- Moskovtsev S., Willis J., White J., Mullen B. Sperm survival: relationship to age-related sperm DNA integrity in infertile men. Archives of Andrology, 2009, 53(1): 9-32 (doi: 10.1080/01485010600908330).
- Kang W., Harada Y., Yamatoya K., Kawano N., Kanai S., Miyamoto Y., Nakamura A., Miyado M., Hayashi Y., Kuroki Y., Saito H., Iwao Y., Umezawa A., Miyado K. Extra-mito-chondrial citrate synthase initiates calcium oscillation and suppresses age-dependent sperm dys-function. Laboratory Investigation, 2020, 100(4): 583-595 (doi: 10.1038/s41374-019-0353-3).
- Анбаза Ю.В. Факторы, влияющие на качественные и количественные показатели натив-ной спермопродукции быков ОАО «Красноярскагроплем». Вестник КрасГЛУ, 2018, 2: 286-292.
- Luo Q.X., Liao Y.B., Huang C.P., Guo J.H., Liang X.D. Correlation of sperm DNA fragmentation index with age and semen parameters and its influence on the outcomes of IVF-ET. Zhonghua Nan Ke Xue (National Journal of Andrology), 2020, 26(8): 708-712.
- Atroshchenko M.M., Arkhangelskaya E., Isaev D.A., Stavitsky S.B., Zaitsev A.M., Kalaschni-kov V.V., Leonov S., Osipov A.N. Reproductive characteristics of thawed stallion sperm. Animals, 2019, 9(12): 1099 (doi: 10.3390/ani9121099).
- Piomboni P., Stendardi A., Gambera L., Tatone C., Coppola L., De Leo V., Focarelli R. Protein modification as oxidative stress marker in normal and pathological human seminal plasma. Redox Report, 2012, 17(5): 227-232 (doi: 10.1179/1351000212Y.0000000014).
- Agarwal A., Durairajanayagam D., Halabi J., Peng J, Vazquez-Levin M. Proteomics, oxidative stress and male infertility. Reproduction Biomed Online, 2014, 29(1): 32-58 (doi: 10.1016/j.rbmo.2014.02.013).
- Caruso Bavisotto C., Alberti G., Vitale A.M., Paladino L., Campanella C., Rappa F., Gorska M., Conway de Macario E., Cappello F., Macario A.J.L., Marino Gammazza A. Hsp60 post-trans-lational modifications: functional and pathological consequences. Frontiers in Molecular Biosci-ence, 2020, 7: 95 (doi: 10.3389/fmolb.2020.00095).
- Angrimani D., Nagai K.K., Rui B.R., Bicudo L.C., Losano J., Brito M.M., Francischini M., Nichi M. Spermatic and oxidative profile of domestic cat (Felis catus) epididymal sperm subjected to different cooling times (24, 48 and 72 hours). Reproduction in Domestic Animals, 2018, 53(1): 163-170 (doi: 10.1111/rda.13086).
- Cai Z., Yan L.J. Protein oxidative modifications: beneficial roles in disease and health. Journal of Biochemical and Pharmacological Research, 2013, 1(1): 15-26.
- Gaikwad A.S., Hu J., Chapple D.G., O'Bryan M.K. The functions of CAP superfamily proteins in mammalian fertility and disease. Human Reproduction Update, 2020, 26(5): 689-723 (doi: 10.1093/humupd/dmaa016).
- Hu J., Merriner D.J., O'Connor A.E., Houston B.J., Furic L., Hedger M.P., O'Bryan M.K. Epi-didymal cysteine-rich secretory proteins are required for epididymal sperm maturation and optimal sperm function. Molecular Human Reproduction, 2018, 24(3): 111-122 (doi: 10.1093/molehr/gay001).
- Cohen D.J., Busso D., Da Ros V., Ellerman D.A., Maldera J.A., Goldweic N., Cuasnicu P.S. Participation of cysteine-rich secretory proteins (CRISP) in mammalian sperm-egg interaction. Int. J. Dev. Biol., 2008, 52(5-6): 737-742 (doi: 10.1387/ijdb.072538dc).
- Залесская Т.И., Авер И.И., Мандрик К.А. Перекисное окисление белков плазмы крови у больных глаукомой. Журнал ГрГМУ, 2007, 3: 66-68.


