Оценка операционно-анестезиологического риска у больных язвенными гастродуоденальными кровотечениями
Автор: Потахин С.Н., Шапкин Ю.Г.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
Цель: уточнить факторы операционно-анестезиологического риска при экстренных и превентивных операциях у больных с язвенными гастродуоденальными кровотечениями (ГДК), разработать алгоритм прогноза неблагоприятного исхода операции и обозначить возможности управления рисками при данной патологии. Материал и методы. Для уточнения факторов операционно-анестезиологического риска при экстренных и превентивных операциях проведен сравнительный анализ двух групп больных язвенными ГДК, находившихся на лечении в хирургическом отделении МУЗ «Городская клиническая больница № 6» г. Саратова. В первую группу вошли 39 пациентов, погибших после операции, а во вторую группу — 274 пациента с благоприятным исходом операций. Статистический анализ проведен с использованием программы Statistica 6.0. Результаты. С помощью параметрических и непараметрических методов статистического анализа уточнены факторы опера-ционно-анестезиологического риска. При использовании методов многомерного анализа разработан алгоритм оценки операционно-анестезиологического риска в виде деревьев классификации, с помощью которого можно прогнозировать исход экстренных и превентивных операций и выделить группу риска с ожидаемой летальностью около 40%. Заключение. Разделение пациентов по степени риска рецидива кровотечения в совокупности с комплексной оценкой тяжести состояния больных и операционно-анестезиологического риска позволяет обоснованно выбирать лечебно-диагностические мероприятия и тем самым увеличивает шансы благоприятного исхода лечения.
Оценка операционно-анестизиологического риска, хирургическая тактика, язвенные гастродуоденальные кровотечения
Короткий адрес: https://sciup.org/14918028
IDR: 14918028
Текст научной статьи Оценка операционно-анестезиологического риска у больных язвенными гастродуоденальными кровотечениями
1 Введение. Оценка рисков при язвенных гастродуоденальных кровотечениях и прогнозирование течения заболевания имеют большое значение в современной лечебной тактике. Это подчеркивается как в рекомендациях международного консенсуса по лечению пациентов с неварикозными кровотечениями из верхних отделов ЖКТ 2010 г., так и в рекомендациях, разработанных на пленуме правления Российского общества хирургов в июне 2014 г. [1].
Разделение больных в зависимости от вероятности рецидива кровотечения и неблагоприятного исхода, а также тяжести состояния позволяет обосновать выбор лечебно-диагностических мероприятий [2, 3]. По мнению большинства авторов, использование результатов прогноза при принятии тактических решений способствует улучшению результатов лечения. Таким образом, открываются возможности управления рисками, что необходимо учитывать при разработке клинических протоколов ведения больных с данной патологией. Однако в проекте национальных клинических рекомендаций речь идет только об оценке тяжести кровопотери и прогнозировании рецидива кровотечения, что не достаточно, на наш взгляд, для полноценного обоснования тактики [1].
Цель : уточнить факторы операционно-анестезиологического риска при экстренных и превентивных операциях у больных с язвенными ГДК, разработать алгоритм прогноза неблагоприятного исхода операции и обозначить возможности управления рисками при данной патологии.
Материал и методы. Для уточнения факторов операционно-анестезиологического риска при экстренных и превентивных операциях проведен сравнительный анализ двух групп больных язвенными ГДК. В первую группу вошли 39 пациентов, погибших после операции, а во вторую группу — 274 пациента с благоприятным исходом экстренных и превентивных операций. Все пациенты находились на лечении в хирургическом отделении МУЗ «Городская клиническая больница № 6» г. Саратова с 1996 по 2000 г. В этот период широко ставились показания к операциям при продолжающемся кровотечении и высоком риске его возобновления, что позволило наиболее полно выполнить анализ факторов риска [3]. Сведения о пациентах получены из используемой в клинике электронной базы данных на основе программы FoxPro 2.0.
Статистический анализ проводился с помощью программы Statistica 6.0. Использовались методы описательной статистики, корреляционный анализ, непараметрические методы и методы многомерного анализа. С помощью методов описательной статистики для количественных данных вычислялись среднее значение, дисперсия и среднее квадратическое отклонение, а для дихотомических переменных — вероятность. Достоверность различий между группами по каждому признаку оценивалась по t-критерию Стьюдента. При p<0,05 отличие считалось достоверным.
Для выявления связи между отдельными признаками использовались частные коэффициенты корреляции, а для выявления связи между отдельным признаком и принадлежностью больного к группе вычислялась мера связи Гудмена и Краскала. При p<0,05 коэффициент корреляции или мера связи до-
стоверно отличались от 0. Из методов многомерного анализа использовался метод построения деревьев классификации.
Результаты. Среди включенных в исследование больных продолжающееся кровотечение на момент поступления имелось у 128 (41%) человек, у 60 (19%) пациентов показанием к операции явился рецидив геморрагии, в 125 (40%) случаях операция выполнена по поводу угрозы рецидива кровотечения. В целом летальность после этих операций составила 12,5% (39 от 313). Среди пациентов, оперированных на высоте первичного кровотечения, погибли 16 (12,5%) человек, а в группе больных с повторным кровотечением — 14 (23,3%). Из 125 человек, оперированных превентивно, то есть по поводу угрозы рецидива кровотечения, умерло 9 (7,2%).
Средний возраст выживших пациентов составил 47±12,8, а умерших пациентов — 59±9,5 лет (p<0,05). Сравнивая доверительные интервалы, в пределах которых распределяется основная масса наблюдений, можно заметить следующее: пациенты младше 50 лет умирают после экстренных операций крайне редко, в то время как для пациентов старше 60 лет вероятность летального исхода довольно высока.
Мужчин в первой группе было 85% (33 из 39), во второй 79% (217 из 274), а женщин соответственно 15% (6 из 39) и 21 % (57 из 274). Отличие по этому признаку между группами статистически не достоверно (p>0,05), а следовательно, как и ожидалось, пол не влияет на исход операции.
Из 39 пациентов первой группы 20 (51,3%) являлись жителями Саратова, а 19 (48,7%) проживали в сельских регионах Саратовской области. Во второй группе сельских жителей было 58,8% (161 от 274 человек), а городских 113 (41,2%). Для оказания специализированной помощи сельским пациентам с ГДК в клинике круглосуточно дежурила бригада в составе хирурга и эндоскописта. Часть пациентов специалисты Центра желудочно-кишечных кровотечений транспортировали в Саратов, а часть (с продолжающимся кровотечением или угрозой его возобновления) оперировали на месте. Из первой группы в ЦРБ было оперировано 10 (25,6%) человек, а из второй группы 107 (39,1%). Статистически значимого отличия по этому фактору выявлено не было (p>0,05). Следовательно, место операции не определяет ее исход.
Сопутствующая патология обнаружена у 29 (74,4%) больных первой группы, в то время как во второй группе сопутствующие заболевания отмечены лишь у 78 (28,5%) человек (p<0,05). Заболевания сердечно-сосудистой системы имелись среди умерших в 54% (21 от 39) случаях, а дыхательной системы в 10% (4 от 39), заболевания других систем отмечены в 41 % (16 от 39) наблюдений. Во второй группе патология сердечно-сосудистой системы обнаружена у 15% (40 от 274) человек, дыхательной системы у 3% (7 от 274), а заболевания других органов отмечены у 16% (45 от 274) человек. Отличия по всем этим признакам статистически значимы (p<0,05).
Сочетание заболеваний нескольких систем в первой группе отмечено у 33,3% (13 от 39 человек), а во второй группе только у 4,7% (13 от 274). Отличие по этому признаку также достоверно (p<0,05). Наличие тех или иных осложнений сопутствующей патологии (инфаркт, инсульт в анамнезе, сердечная, дыхательная недостаточность, мерцательная аритмия и т.д.) также заметно чаще отмечалось в первой группе пациентов. В этой группе осложнения отмечены в 20,5% (8 от 39) случаев, в то время как во второй группе в 4,7% (13 от 274).
Таким образом, наличие сопутствующей патологии, особенно сердечно-сосудистой или дыхательной системы или нескольких систем, а также тяжесть этой патологии существенно влияют на исход операции. Значит, эти признаки можно использовать при оценке операционно-анестезиологического риска и включить в алгоритм прогноза неблагоприятного исхода экстренных операций.
В удовлетворительном состоянии поступил 1 (2,6%) пациент из первой группы и 32 (11,7%) из второй, средняя степень тяжести отмечена при поступлении соответственно у 9 (23%) и 105 (38,3%) человек, а в тяжелом состоянии доставлены 29 (74,4%) больных из первой группы и 137 (50%) из второй. И хотя тяжесть исходного состояния была достоверно выше среди умерших, данный факт нецелесообразно использовать в алгоритме прогнозирования исхода операции как самостоятельный признак. Дело в том, что тяжесть состояния определяется несколькими показателями (самочувствием пациентов, объемом кровопотери, показателями гемодинамики и т.д.) и оценивается нередко субъективно. Поэтому более корректно учитывать эти показатели по отдельности.
Нестабильная гемодинамика (т.е. учащение пульса выше 100 ударов в 1 минуту и снижение артериального давления на 5 мм рт. ст. ниже нормы) отмечена у 72% (28 от 274) больных первой группы и 51,5% (141 от 274) пациентов второй группы (p<0,05). Следует отметить, что из показателей гемодинамики значимые отличия выявлены только по частоте пульса. Среднее значение частоты пульса при поступлении в первой группе равнялось 106±13,7 в минуту, а во второй группе 99±13,9 в минуту. Поскольку на величину артериального давления могло оказывать влияние наличие сопутствующей патологии (артериальной гипертензии), изменение давления не всегда происходило пропорционально пульсу (коэффициент корреляции –0,3). Из-за большого разброса данных средние значения систолического давления в обеих группах практически не отличались и составили соответственно 108,7±22,53 и 111,5±03 мм рт. ст.
Важным показателем, отражающим тяжесть кровотечения и степень нарушения гемодинамики, является указание на наличие в анамнезе у больного коллапса. Среди умерших пациентов коллапс отмечался в 20 (51,3%) наблюдениях, а среди выживших в 109 (39,8%). Однако достоверное отличие имелось только по частоте повторных коллапсов. В первой группе два и более раза коллапс отмечен у 5 (12,8%) человек, а во второй группе — у 13 (4,7%).
Сравнительный анализ подтвердил, что тяжесть кровопотери на момент поступления также влияет на исход операции. Об объеме кровопотери судили главным образом по дефициту циркулирующей крови (ДЦК). В первой группе ни у одного пациента не было легкой степени кровопотери (ДЦК меньше 500 мл), средняя степень кровопотери (ДЦК от 500 до 1000 мл) отмечена у 17 (34%) человек, а тяжелая степень (дЦк более 1000 мл) у 22 (56%). Во второй группе легкую степень кровопотери имели 43 (16%) человека, среднюю степень 136 (50%), а тяжелую степень 95 (34%). Отличия между группами статистически достоверны (p<0,05).
Среднее значение ДЦК в первой группе составило 988±381,2 мл, а во второй группе 850±310 мл. В среднем количество эритроцитов крови у умерших пациентов равнялось 2,4±0,86×1012 в литре, а у выживших 2,8±0,81×1012 в литре. Среднее значение количества гемоглобина в этих группах составило соответственно 77±27,8 г/л и 88±25,2 г/л. Отличия между группами по всем этим показателям статистически значимы (p<0,05), а следовательно, все они могут быть использованы для прогнозирования исхода операции.
Следующая группа признаков: эндоскопическая характеристика язвы, ее локализация и размеры. Эти признаки не связаны с тяжестью состояния больных, но также могут повлиять на исход операции. Дело в том, что диаметр, глубина и локализация язвы определяют вид и объем хирургического вмешательства. При локализации язвы, например, на задней стенке двенадцатиперстной кишки, пенетрирующих язвах возможны определенные технические трудности, что может сказаться на исходе лечения.
В первой группе желудочные язвы обнаружены у 13 (33,3%) человек, в двенадцатиперстной кишке язва локализовалась у 22 (56,4%) пациентов, в 4 (10,3%) случаях имелись язвы анастомоза. Среди умерших больных язва располагалась чаще всего на задней стенке двенадцатиперстной кишки — в 17 (43,6%) случаях и на заднебоковой стенке — 5 (12,8%) наблюдений. Ни у одного больного язва не располагалась на передней стенке двенадцатиперстной кишки. Во второй группе желудочная локализация язвы отмечена в 135 (49,3%) наблюдениях, дуоденальная язва обнаружена у 116 (42,3%) человек, сочетанные язвы имелись в 10 (3,6%) случаях. На передней стенке двенадцатиперстной кишки язва располагалась у 25 (9,1 %) пациентов, а на заднебоковой и задней — соответственно у 38 (13,9%) и 63 (23%) человек. Более частая локализация язвы на задней стенке двенадцатиперстной кишки у пациентов в первой группе подтвердила наше предположение о взаимосвязи этой локализации язвы с исходом операции.
По другим признакам (размер, глубина язвы, частота пенетрирующих язв) статистически значимых отличий между группами выявлено не было. В первой группе среднее значение размера язвы составило 1,6±1,11 см, а во второй группе 1,5±0,92 см. Глубокие язвы (т.е. глубже 0,4 см) обнаружены у 19 (48,7%) человек первой группы и 147 (53,7%) пациентов второй группы. При этом пенетрация язвы во время операции отмечена соответственно у 17 (43,6%) и 97 (35,4%) человек.
Поскольку больные анализируемых групп были оперированы в экстренном порядке по поводу продолжающегося кровотечения или угрозы его возобновления, степень активности кровотечения в большинстве случаев была высокой. Активность кровотечения является интегральным показателем и складывается из характеристики язвенного дна и состояния гемодинамики [4, 5]. У пациентов с возобновившейся геморрагией в анализе учитывалась степень активности кровотечения на момент рецидива. В первой группе не было ни одного человека со второй степенью активности кровотечения. Во второй группе всего 5 (1,8%) человек имели IIA степень активности (дно язвы выполнено фибрином, гемодинамика стабильная) и 2 (0,7%) пациента 11Б степень активности (язва под фибрином, гемодинамика нестабильная). У 4 (10,3%) больных первой группы и у 58 (21,2%) пациентов второй группы отмечена IIIA степень активности кровотечения, т.е. в дне язвы имелись тромбированные сосуды или сгусток крови при стабильной гемодинамике. Такая же эндоскопическая картина при нестабильной гемодинамике (IIIБ степень активности кровотечения) обнаружена у 5 (12,8%) человек в первой группе и 51 (18,6%) пациента второй группы. В первой группе пациентов IVА степень активности кровотечения (продолжающееся кровотечение, гемодинамика стабильная) наблюдалась у 3 (7,7%) человек, а во второй группе у 51 (18,6%). Активное кровотечение, сопровождающееся нестабильной гемодинамикой (IVБ степень активности), имелось у 27 (69,2%) пациентов первой группы и у 107 (39,1 %) больных второй группы. Статистически значимым (p<0,05) отличие было только по числу больных с IVБ степенью активности кровотечения. Следовательно, именно при этой степени активности вероятность летального исхода наиболее высока, что можно учитывать при оценке операционно-анестезиологического риска.
Как уже отмечалось, летальность при продолжающемся кровотечении (особенно рецидивном) была заметно выше, чем при остановившемся. Значит, в прогностическом алгоритме должно быть обязательно указано, по поводу активного или остановившегося кровотечения предстоит выполнять операцию. В первой группе продолжающееся кровотечение имелось в 30 (77%) случаях, в том числе повторная геморрагия отмечена у 14 (36%) пациентов. Во второй группе активное кровотечение было у 158 (58%) человек, из них рецидивное у 46 (17%). Отличия между группами статистически достоверны (p<0,05).
Поскольку среди пациентов с повторной геморрагией отмечалась наибольшая летальность — 23,3% (14 от 39), решено было учесть еще и клинические проявления рецидива кровотечения. Так, в первой группе рецидивное кровотечение, обнаруженное только при контрольном эндоскопическом исследовании, было у 7 из 14 человек (50%), а во второй группе у 27 из 46 (59%). В остальных наблюдениях рецидив кровотечения сопровождался клиническими проявлениями (нарушение гемодинамики, коллапс, рвота, мелена). Таких пациентов было достоверно больше в первой группе, то есть тяжесть клинических проявлений рецидива кровотечения целесообразно использовать при прогнозе исхода операции.
По данным многих авторов, на исход операции влияет срок от начала заболевания, на котором больной поступает в стационар. В первой группе в среднем пациенты поступали через 4 суток от начала кровотечения, а во второй группе через 3 суток. Разброс значений этого показателя в обеих группах довольно большой (от 1 до 30 суток), но по среднему значению выявлено достоверное отличие между группами.
Значимость перечисленных признаков подтверждена методами непараметрического анализа (в частности, мерой связи Гудмена и Краскала). Однако простое перечисление этих факторов не позволяет адекватно учесть их при прогнозировании исхода операции. Более объективно это можно сделать, опираясь на современные методы многомерной классификации.
Богатый опыт использования разных методов многомерной классификации позволил нам сразу остановиться на более пригодном для анализа медицинских данных методе построения деревьев классификации (или деревьев решений). Деревья классификации относятся к методам разведочного анализа, они позволяют выявить значимые признаки для разделения больных на группы и определить их приоритетность. В то же время само дерево решений может являться прогностическим алгоритмом, построенным по логико-алгебраическому принципу. Используя разные настройки программы Statistica 6.0 и постепенно исключая из анализа менее значимые симптомы, построили три дерева решений, позволяющие наиболее точно разделить пациентов в зависимости от исхода операции.
Первое дерево решений позволило правильно распознать летальный исход после операции в 90% (35 из 39) случаев (табл. 1). Благоприятный исход операции правильно распознан у 77% (211 из 274) больных. Однако в группе риска оказывается довольно много «лишних» больных (63 из 98). Ожидаемая летальность в этой группе по этому дереву решений составляет 36% (35 от 98).
Таблица 1
Распределение больных анализируемых групп по первому дереву решений, %
|
Группа больных |
Результат прогнозирования исхода операции |
Всего больных |
|
|
Умерли |
Выжили |
||
|
Первая группа |
90 |
10 |
100 |
|
Вторая группа |
23 |
77 |
100 |
Во втором дереве решений пациенты разделяются по возрасту на тех, кому 47 лет и младше, и тех,
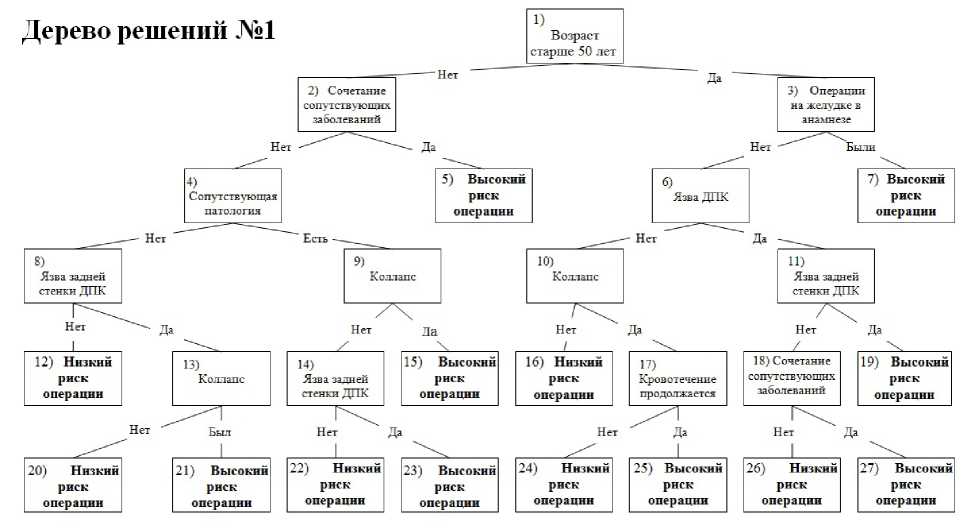
Рис. 1. Оценка операционно-анестезиологического риска по первому дереву решений
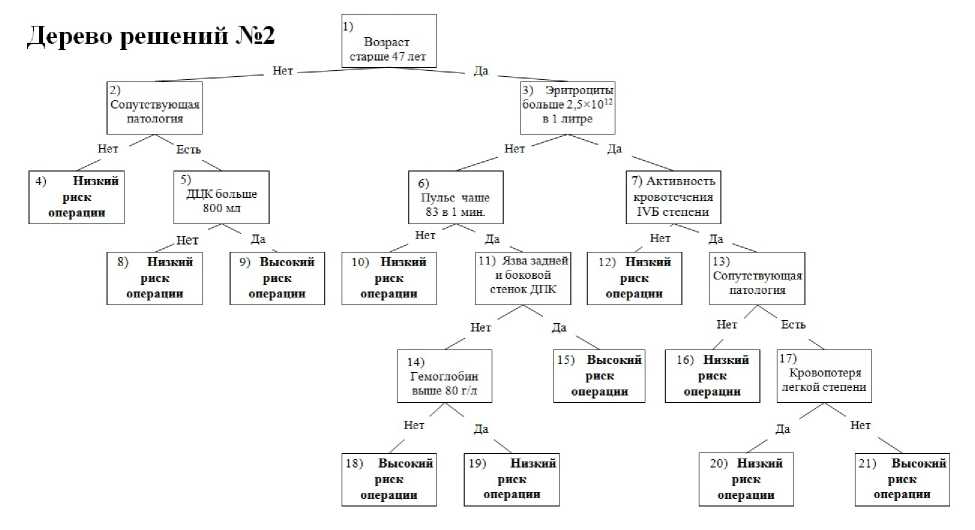
Рис. 2. Оценка операционно-анестезиологического риска по второму дереву решений
кому больше 47 лет (рис. 2). На втором уровне учитываются наличие сопутствующей патологии и количество эритроцитов крови. В узлах третьего порядка принимается в расчет ДЦК, частота пульса и степень активности кровотечения. Далее учитываются локализация язвы на задней стенке ДПК и наличие сопутствующей патологии. Завершается разделение по уровню гемоглобина и степени кровопотери. Второе дерево имеет 11 терминальных узлов, путь к которым включает также от 2 до 5 вопросов.
Второе дерево решений достаточно точно разделяет пациентов анализируемых групп (табл. 2). Пациенты первой группы правильно распознаны в
92% (36 от 39) случаев, а второй группы в 82% (226 от 274). Но даже при такой точности прогноза из-за несоответствия размеров групп число выживших пациентов в группе риска преобладает (48 из 84). Ожидаемая летальность в этой группе составляет 43% (36 от 84).
В третьем дереве решении возрастная граница, по которой разделяются пациенты, составляет 41 год (рис. 3). Из 101 пациента этого возраста и младше выжили все (узел 2). Таким образом, можно считать, что в этой возрастной группе риск операции минимален практически при любой клинической ситуации. При классификации пациентов старшего возраста учиты-
Таблица 2
Распределение больных анализируемых групп по второму дереву решений, %
|
Группа больных |
Результат прогнозирования исхода операции |
Всего больных |
|
|
Умерли |
Выжили |
||
|
Первая группа |
92 |
8 |
100 |
|
Вторая группа |
18 |
82 |
100 |
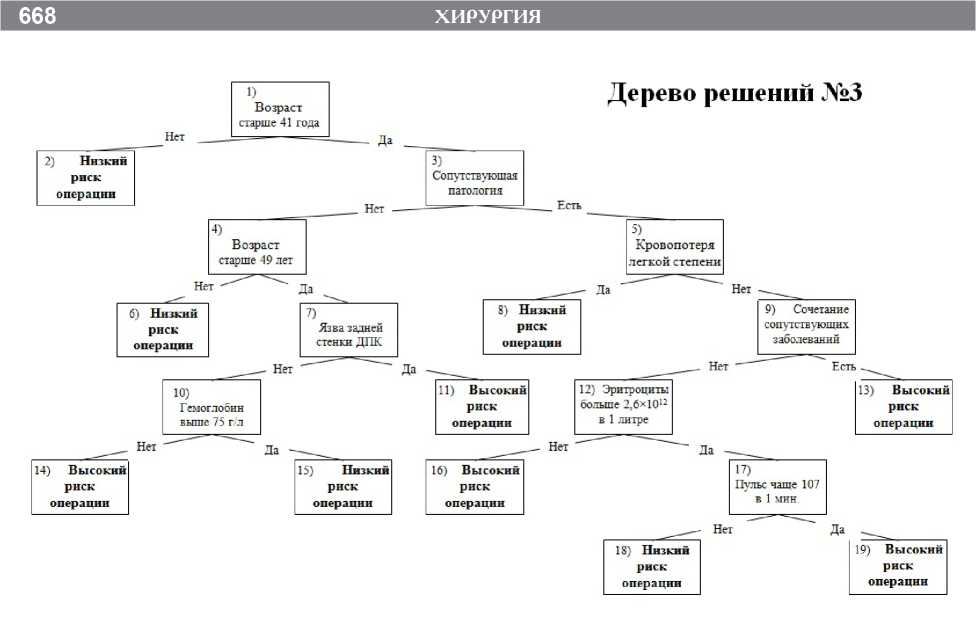
Рис. 3. Оценка операционно-анестезиологического риска по третьему дереву решений
Таблица 3
Распределение больных анализируемых групп по третьему дереву решений, %
В третьем дереве решений правильно распознаются все пациенты первой группы (табл. 3). Во второй группе правильно распознаны 79% человек (217 из 274). Ожидаемая летальность в группе риска 41 % (39 от 96).
С помощью деревьев классификации на основании доступных клинико-лабораторных признаков мы можем оценить операционно-анестезиологический риск и прогнозировать летальный исход у пациентов с кровоточащей язвой, которым предстоит экстренная операция. В результате прогноза выделяется группа риска с ожидаемой летальностью около 40%. Использование всех трех деревьев решений может повысить точность прогноза.
Оценка тяжести состояния пациента в совокупности с возможностью неблагоприятного исхода позволяет более четко ответить на следующие вопросы:
-
1. Оперировать или нет больных с высоким риском рецидива кровотечения?
-
2. Что делать после эндоскопической остановки кровотечения?
-
3. Кого помещать в палату интенсивной терапии?
-
4. Как часто и кому выполнять динамическую эндоскопию?
-
5. Сколько попыток эндоскопического гемостаза предпринять для остановки рецидивного кровотечения?
Часть вопросов освещена в клинических протоколах, принятых в некоторых регионах России [6, 7]. Но в большинстве регионов, судя по дискуссии на пленуме правления Российского общества хирургов в июне 2014 г., о единстве мнений говорить не приходится.
В нашей клинике при принятии решений мы стараемся учитывать следующие обстоятельства: тяжесть состояния больного, продолжается или нет кровотечение, вероятность развития рецидива кровотечения, степень операционно-анестезиологического риска, а также этиологию язвы (хроническая или острая язва) и наличие показаний к хирургическому лечению язвенной болезни.
Тяжесть состояния пациента в процессе госпитализации позволяет определиться с местом выполнения ФГДС — палата интенсивной терапии или другие отделения клиники. При оценке тяжести состояния учитываются объем кровопотери, состояние гемодинамики и степень компенсации сопутствующей патологии или основной патологии при симптоматических язвах. Комплексная оценка тяжести состояния позволяет поставить показания к гемотрансфузии или интенсивной терапии, а также обосновать приоритетность терапевтического лечения при симптоматических язвах.
В случае продолжающегося кровотечения выполняется эндогемостаз. Отсутствие такой возможности или его безуспешность определяет показания к хирургическому лечению. Основная задача экстренной операции при высоком операционно-анестезиологическом риске — это остановка кровотечения. Идеальный объем операции — иссечение язвы, но допустимо и прошивание источника кровотечения. Такой объем достаточен при острых язвах. Выполнение радикальной операции обосновано только для хронических язв при благоприятном прогнозе исхода операции.
Тем не менее при больших, пенетрирующих язвах или рецидивных пептических язвах ограниченный объем операции невозможен. В этом случае успех полностью зависит от мастерства хирурга и анестезиолога.
При предрецидивном синдроме показания к хирургическому лечению сегодня должны формулироваться с учетом соматического статуса и степени операционно-анестезиологического риска. В частности, при прогнозировании неблагоприятного исхода целесообразно воздержаться от экстренной операции. Этим пациентам показаны полноценная предоперационная подготовка на фоне противорецидивного лечения и динамическое наблюдение. Операцию целесообразно выполнять только при компенсации состояния и сохраняющейся угрозе рецидива кровотечения.
При круглосуточной доступности эндоскопической службы выполнение динамической эндоскопии оправдано у пациентов с высоким риском рецидива кровотечения. До половины рецидивов кровотечения в нашей клинике диагностированы эндоскопически до клинических проявлений геморрагии. Выполнение эндогемостаза в этой группе больных абсолютно показано. При успешной остановке кровотечения показания к хирургическому лечению должны ставиться так же, как и при предрецидивном синдроме. Что касается больных в крайне тяжелом состоянии, например при тяжелой черепно-мозговой травме, у неврологических или терапевтических больных, то эндогемостаз может быть единственным способом их успешного лечения. Число попыток эндоскопической остановки кровотечения у таких больных не может ограничиваться одной или двумя, что не раз подтверждено в нашей клинике.
Безуспешность или невозможность выполнения эндоскопической остановки кровотечения требует экстренного хирургического вмешательства, объем которого должен определяться с учетом степени операционно-анестезиологического риска и местных изменений.
Заключение. Таким образом, сегодня при стати-фикации пациентов по степени риска не достаточно говорить только о вероятности рецидива геморрагии. При выборе тактики необходима комплексная оценка тяжести состояния больных и степени операционноанестезиологического риска. Обоснование выбора лечебно-диагностических мероприятий с учетом совокупности этих показателей позволяет оптимизировать тактику и тем самым повысить шансы благоприятного исхода лечения.
Список литературы Оценка операционно-анестезиологического риска у больных язвенными гастродуоденальными кровотечениями
- Язвенные гастродуоденальные кровотечения: Проект национальных клинических рекомендаций на основе материалов ПЛЕНУМА Правления Российского общества хирургов. Воронеж, 2014; 9 с.
- (Потахин С.H., Шапкин Ю.Г., Чалык Ю.В., Зевякина В.А. Оценка тяжести состояния и прогнозирование течения заболевания при язвенных гастродуоденальных кровотечениях (обзор). Саратовский научно-медицинский журнал 2014; 10 (2): 301 -307)
- Шапкин Ю.Г., Потахин С. H. Динамика основных показателей лечения язвенных гастродуоденальных кровотечений: анализ многолетних наблюдений. Саратовский научно-медицинский журнал 2014; 10 (3): 456-460
- Гидирим Г.П., Чикала E.T., Гуцу B.M., Концу Г. И. Тактика при желудочно-кишечных кровотечениях в условиях санитарной авиации. Хирургия 1992; (9-10): 24-28
- Шапкин Ю.Г. Хирургическая тактика при гастродуоденальных кровотечениях. Саратов: Саратовский медицинский университет, 1998; 245 с.
- Протоколы организации лечебно-диагностической помощи при неварикозных желудочно-кишечных кровотечениях (из хронических язв желудка, двенадцатиперстной кишки и пептических язв гастроэзофагеального анастомоза (проект). Вестник хирургии им. И. И. Грекова 2012; 171 (5): 94-101
- Корымасов E.A., Мачехин П.В., Чернышев В.Н. и др. Клинический протокол диагностики и лечения язвенного гастродуоденального кровотечения в Самарской области. Самара: СамГМУ, 2013; 20 с.


