Оценка особенностей бионакопления и токсического действия наночастиц оксида меди (II) на органы дыхания при ингаляционном поступлении в организм в сравнении с микроразмерным химическим аналогом для задач профилактики
Автор: Степанков М.С.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 4 (44), 2023 года.
Бесплатный доступ
В настоящее время актуальным является уточнение параметров и особенностей негативных эффектов действия наночастиц оксида меди (НЧ CuO) на органы дыхания при ингаляционном пути поступления в организм для разработки эффективных профилактических мер. Осуществлена оценка особенностей бионакопления и характера токсического действия НЧ CuO на органы дыхания в сравнении с микроразмерным химическим аналогом при экспериментальном моделировании ингаляционной экспозиции для задач профилактики. Определены значения физических параметров тестируемых материалов. Экспериментальное исследование проведено на крысах линии Wistar. Животных подвергали однократной ингаляционной экспозиции в течение 4 ч в концентрации ~4 мг/м3; субхронической ингаляционной экспозиции в концентрации 1,2-1,4 мг/м3; однократной интратрахеальной экспозиции в дозе 0,005 г на крысу. Изучены особенности бионакопления НЧ, их влияния на состав клеточной популяции жидкости бронхоальвеолярного лаважа (БАЛЖ), развития патоморфологических нарушений в тканях и массу легких в сравнении с микрочастицами (МЧ). НЧ CuO в сравнении с МЧ обладают меньшим размером, гидродинамическим диаметром, большей удельной площадью поверхности и суммарным объемом пор, что обусловливает большую проникающую способность НЧ. Бионакопление в легких при однократной ингаляционной экспозиции сопоставимо между НЧ и МЧ. При многократной экспозиции НЧ проявляют большую степень бионакопления. Однократное интратрахеальное воздействие вызывает более выраженные изменения состава клеточной популяции в жидкости БАЛЖ. При экспозиции НЧ в легких наблюдается эмфизема, отек и экссудация эритроцитов, не выявленные при экспозиции МЧ. Таким образом, НЧ CuO при однократной интратрахеальной (0,005 г на крысу) и субхронической ингаляционной экспозиции (1,2 мг/м3) обладают большей степенью бионакопления и токсического действия на органы дыхания (легкие) в сравнении с микроразмерным химическим аналогом. Полученные результаты необходимо учитывать при разработке мер, направленных на профилактику развития негативных эффектов со стороны органов дыхания при ингаляционной экспозиции изучаемым наноматериалом.
Оксид меди (ii), наночастицы, микрочастицы, ингаляционная экспозиция, бионакопление, негативные эффекты, клеточно-фагоцитарная активность, крысы линии wistar
Короткий адрес: https://sciup.org/142239926
IDR: 142239926 | УДК: 613.632.2, | DOI: 10.21668/health.risk/2023.4.12
Текст научной статьи Оценка особенностей бионакопления и токсического действия наночастиц оксида меди (II) на органы дыхания при ингаляционном поступлении в организм в сравнении с микроразмерным химическим аналогом для задач профилактики
В настоящее время в различных сферах хозяйственной деятельности человека актуален вопрос повышения качества продукции с одновременным снижением затрат на ее производство. Одним из путей решения данной задачи является внедрение металлических наночастиц (НЧ) в состав продукции и технологические процессы ее производства [1].
НЧ представляют собой объекты различных форм, размер которых хотя бы в одном измерении соответствует диапазону 1–100 нм. Малый диаметр НЧ обусловливает возникновение квантово-размерных эффектов, благодаря чему наноматериалы обладают адсорбционной активностью, реакционной способностью, электрическими, оптическими, магнитны-
Степанков Марк Сергеевич – младший научный сотрудник лаборатории биохимической и наносенсорной диагностики (e-mail: ; тел: 8 (342) 237-18-15; ORCID: .
ми, механическими и термодинамическими свойствами, не характерными для микроразмерных химических аналогов [2–5].
Одним из таких наноматериалов являются НЧ оксида меди (II) (CuO). Согласно результатам анализа Research and Markets, мировой рынок НЧ CuO в 2021 г. оценивается в 122,77 млн долларов США. При совокупном среднегодовом темпе роста 25,8 % к 2027 г. прогнозируют увеличение мирового рынка примерно в 4 раза (до 486,62 млн долларов США) [6]. Основным фактором увеличения является активное внедрение НЧ CuO в электроприборостроение из-за их уникальных проводящих свойств, обеспечивающих высокую производительность полупроводниковых устройств, аккумуляторов, компьютерной техники [6]. Кроме этого, НЧ CuO используют в медицине в составе биоцидных и противораковых препаратов [7]; косметологии – в продуктах личной гигиены [8]; сельском хозяйстве – в качестве компонента удобрений и пестицидов [9, 10]; аэрокосмической отрасли – в роли катализатора горения топлива [11] и в составе структурных элементов летательных аппаратов [12].
Согласно результатам исследований, представленных в научной литературе, НЧ CuO характеризуются токсическими свойствами, обусловливающими потенциальную опасность для здоровья человека. В экспериментах на биологических моделях доказана их способность инициировать процессы свободнорадикального окисления [13], изменяющие экспрессию белков, что приводит к нарушениям метаболических процессов в клетке [14], функций и морфологии тканей органов [15]. При этом оказываемые НЧ негативные эффекты, как правило, более выражены в сравнении с микроразмерными химическими аналогами.
Активное использование потенциально опасных НЧ CuO в различных сферах хозяйственной деятельности человека обусловливает вероятность их поступления в объекты окружающей среды, в первую очередь в атмосферный воздух, что формирует риск негативного воздействия на здоровье человека при аэрогенной экспозиции. Согласно информации, представленной в Р 2.1.10.1920-04, при остром и хроническом ингаляционном воздействии микроразмерного CuO критическими являются органы дыхания1. Это позволяет предположить, что при ингаляционной экспозиции НЧ органы дыхания также будут являться органами-мишенями. Принимая во внимание вышесказанное, актуальным является уточнение параметров и особенностей негативных эффектов действия
НЧ CuO на органы дыхания при ингаляционном пути поступления в организм в сравнении с микроразмер-ным химическим аналогом для разработки эффективных профилактических мер.
Цель исследования – оценка особенностей бионакопления и характера токсического действия НЧ CuO на органы дыхания в сравнении с микро-размерным химическим аналогом при экспериментальном моделировании ингаляционной экспозиции для задач профилактики.
Материалы и методы. В исследовании тестировали коммерческие образцы порошков НЧ и микрочастиц CuO (МЧ) производства компании Sigma Aldrich (США). У частиц тестируемых материалов изучали физические свойства: размер в составе порошка, гидродинамический диаметр в водной суспензии, удельную площадь поверхности и суммарный объем пор. Размер определяли методом растровой электронной микроскопии (РЭМ) с помощью электронного микроскопа JSM-63090LV (JEOL, Япония); гидродинамический диаметр – методом динамического лазерного светорассеяния на анализаторах Horiba LB-550 (Horiba, Япония) и Microtrac S3500 (Microtrac, США); удельную площадь поверхности и суммарный объем пор – на анализаторе ASAP 2020 (Micromeritics, США) методами Брунау-эра, Эммета и Теллера и Баррета, Джойнера и Ха-ленды соответственно2.
Оценку бионакопления и негативных эффектов тестируемых материалов на органы дыхания проводили в серии экспериментов. Экспериментальные исследования проводили на крысах линии Wistar массой 185 ± 20,4 г. Крыс содержали в помещении вивария в полиэтиленовых клетках при температуре около 23 °C, относительной влажности воздуха ~ 47 %, сменяемой световой и темновой фазе раз в 12 ч. Для крыс организовали свободный доступ к комбинированному корму и чистой воде, кроме часов проведения экспозиций. Проведение эксперимента одобрено этическим комитетом Федерального научного центра медико-профилактических технологий управления рисками здоровью населения. Выполнено моделирование острого и субхронического ингаляционного поступления НЧ и МЧ CuO в организм. Целенаправленное действие данных веществ на легкие исследовали при однократном интратрахеаль-ном введении. Для каждого эксперимента формировали три группы: опытная группа подвергалась экспозиции НЧ CuO, группа сравнения – МЧ CuO, контрольная группа содержалась в аналогичных условиях без воздействия тестируемых веществ.
Моделирование ингаляционной экспозиции НЧ и МЧ проводили в камере для воздействия на все тело (TSE Systems GmbH, Германия). Аэрозоль генерировали подачей водных суспензий НЧ и МЧ CuO в концентрации 125 мг/см3 в форсунку ингаляционной системы. На протяжении всех экспериментов циркуляцию воздуха в экспозиционной камере обеспечивали входящим и исходящими потоками со скоростью 10 дм3/мин, что позволило обеспечить полное обновление воздуха за 10 мин. Фактическую концентрацию тестируемых материалов определяли с помощью анализатора аэрозоля DustTrack 8533 (TSI Inc, США), отбирая образцы воздуха из камеры со скоростью 2 дм3/мин в течение 5 мин перед началом экспозиций, через 2 и 4 ч.
Моделирование острой ингаляционной токсичности выполняли в соответствии с ГОСТ 32646-20143. Выборка каждой экспериментальной группы включала 6 особей. Полученные суспензии подавали в ингаляционную систему со скоростью 0,4 см3/мин, что позволило достичь максимально возможной концентрации тестируемых материалов в камере, составившей ~ 4 мг/м3. Экспозицию проводили однократно в течение 4 ч.
Субхроническую ингаляционную экспозицию осуществляли в соответствии с МУ 1.2.2635-104. Каждую экспериментальную группу формировали из 10 крыс. Суспензии подавали в камеру со скоростью 0,1 см3/мин для достижения концентрации НЧ и МЧ CuO на уровне ~ 1/4 от максимально возможной (1,2–1,4 мг/м3). Длительность экспозиции составила 28 суток по 6 ч в сутки.
За крысами, экспонированными однократно, для установления гибели и отложенных токсических эффектов наблюдали в течение 14 суток. По окончанию периода наблюдения животных эвтанировали цервикальной дислокацией с последующей немедленной декапитацией и изъятием легких. Аналогичная процедура осуществлена с крысами, подвергнутыми многократному воздействию, через 24 ч после окончания последней экспозиции. Массу изъятых легких определяли с помощью лабораторных весов EW-1500i (AND, Япония). Сравнительный анализ бионакопления НЧ и МЧ проводили, измеряя концентрацию меди методом атомно-абсорбционной спектрометрии на спектрофотометре AAnalyst 400 (PerkinElmer, США).
Патоморфологические изменения тканей легких при многократной ингаляционной экспозиции выявляли с помощью светооптического микроскопа AxioLab A1 (CarlZeiss, Германия) на препаратах из срезов легких толщиной 3–4 мкм, окрашенных гематоксилином и эозином.
Эксперимент по изучению клеточно-фагоцитарной активности при целенаправленном воздействии НЧ и МЧ CuO на органы дыхания выполнен при однократном интратрахеальном введении в соответствии с МР № 01-19/24-175. Каждую экспериментальную группу формировали из 10 особей. Суспензии на основе 0,9 % стерильного изотонического раствора натрия хлорида (0,9 % NaCl), содержащие тестируемые материалы в концентрации 0,013 г/см3, вводили крысам однократно интратрахеально в объеме 0,4 см3 на крысу. Количество введенного вещества одной особи составило 0,005 г. Через 24 ч после экспозиции крыс эвтанировали и проводили отбор жидкости бронхоальвеолярного лаважа (БАЛЖ). Мазки для исследования состава клеточной популяции отобранной жидкости готовили по общепринятой методике. Подсчет клеток осуществляли при микроскопировании иммерсионной системой с увеличением 900х.
Статистическую обработку результатов исследования для выявления различий между экспериментальными группами осуществляли по U- критерию Манна – Уитни, рассчитанному в программе Statistica 10. Различия полученных результатов считали статистически значимыми при р ≤ 0,05.
Результаты и их обсуждение. По результатам исследования физических свойств размер НЧ CuO составил 45,86 нм, что меньше микродисперсного химического аналога в 304,99 раза (13 987 нм) (рис. 1). Средний гидродинамический диаметр НЧ CuO в водной среде соответствовал 307,40 нм, что в 106,60 раза меньше изучаемого показателя у МЧ CuO (32 770 нм) (рис. 2). Удельная площадь поверхности НЧ больше, чем у МЧ CuO, в 9,61 раза и составила 17,70 против 1,84 м2/г. Суммарный объем пор НЧ CuO равен 0,056 см3/г, что в 9,33 раза больше, чем у МЧ CuO (0,006 см3/г).
На протяжении однократной экспозиции и в период наблюдения не наблюдается видимого ухудшения общего состояния и гибели крыс, вызванных токсическим действием тестируемых материалов. Бионакопление НЧ и МЧ CuO в ткани легких сопоставимо (увеличение концентрации меди ~ в 1,4 раза относительно контрольных данных) без статистически значимых различий между группами опыта и сравнения (табл. 1).
Клеточно-фагоцитарная активность дыхательных путей крыс через 24 ч после экспозиции НЧ CuO, в отличие от контрольных данных, характеризуется

Рис. 1. Изображение частиц CuO методом РЭМ: а – наночастицы, б – микрочастицы
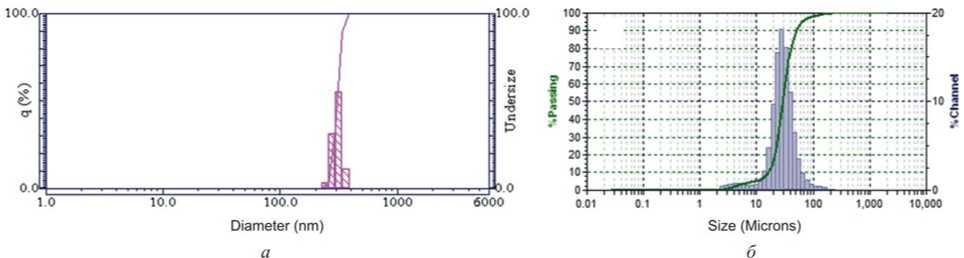
Рис. 2. Результаты измерения гидродинамического диаметра частиц CuO в водной среде: а – наночастицы, б – микрочастицы
Таблица 1
Концентрация меди в органах крыс при однократной ингаляционной экспозиции НЧ и МЧ CuO, р ≤ 0,05
|
Эксперимент |
Концентрация меди в легких, M ± m , мкг/г |
||
|
Экспозиция НЧ |
Экспозиция МЧ |
Контрольная группа |
|
|
Однократная ингаляционная экспозиция |
15,93 ± 3,69* |
16,55 ± 4,31* |
11,50 ± 2,53 |
|
Многократная ингаляционная экспозиция |
17,10 ± 1,99*^ |
11,64 ± 0,30* |
9,70 ± 0,56 |
П р и м е ч а н и е: * – статистически значимое отличие от контрольной группы, ^ – от группы сравнения.
увеличением содержания сегментоядерных нейтрофилов в 2,51 раза ( р < 0,001), альвеолярных макрофагов – в 4,11 раза ( р < 0,001); снижением моноцитов – в 6,00 раза ( р < 0,001), лимфоцитов – в 10,68 раза ( р < 0,001), соотношения сегментоядерных нейтрофилов к альвеолярным макрофагам – в 1,79 раза ( р < 0,01). Состав клеточной популяции при экспозиции МЧ CuO отличался от контрольных данных повышенным относительным числом сегментоядерных нейтрофилов в 2,51 раза ( р < 0,001), альвеолярных макрофагов – в 1,59 раза ( р < 0,01); сниженным числом моноцитов – в 2,59 раза ( р < 0,001), лимфоцитов – в 4,65 раза ( р < 0,001). Сравнительный анализ показал, что клеточно-фагоцитарная активность при экспозиции НЧ отличается от эффекта, вызванного МЧ, большим относительным числом альвеолярных макрофагов в 2,58 раза ( р < 0,001), меньшим числом моноцитов – в 2,31 раза ( р < 0,001), лимфоцитов – в 2,30 раза ( р < 0,001) и соотношением сегментоядерных нейтрофилов к альвеолярным макрофагам – в 2,52
раза ( р < 0,001). Результаты исследования клеточнофагоцитарной активности представлены в табл. 2.
При субхронической экспозиции не установлено ухудшения состояния животных или их гибели. При воздействии НЧ CuO выявлено увеличение концентрации меди в легких в 1,76 раза ( p < 0,05), МЧ – в 1,20 раза ( p < 0,05) относительно контрольных данных. Содержание меди при воздействии НЧ выше в 1,45 раза ( p < 0,05) относительно данного показателя при экспозиции МЧ (табл. 1). Согласно результатам гистологического исследования в легких крыс при воздействии НЧ CuO зафиксирована гиперплазия лимфоидной ткани в стенках бронхов, острая воспалительная реакция бронхов, очаги воспаления интерстиция, распространенные васкулиты, коричневая пигментация макрофагов, очаги эмфиземы и экссудация эритроцитов в просвет альвеол и отек. При аналогичном воздействии МЧ CuO отсутствует эмфизема, отек и скопления эритроцитов в альвеолах (рис. 3).
Таблица 2
Состав клеточной популяции в 100 клетках мазка бронхоальвеолярных смывов крыс через 24 ч после интратрахеальной инстилляции водных суспензий НЧ и МЧ CuO, р ≤ 0,05
|
Параметр |
Состав клеточной популяции, M ± m |
||
|
Экспозиция НЧ |
Экспозиция МЧ |
Контроль |
|
|
Сегментоядерные нейтрофилы, % |
75,6 ± 0,45* |
75,5 ± 0,37* |
30,1 ± 2,82 |
|
Моноциты, % |
3,2 ± 0,25*^ |
7,4 ± 0,58* |
19,2 ± 1,67 |
|
Альвеолярные макрофаги, % |
15,2 ± 0,93*^ |
5,9 ± 0,32* |
3,7 ± 0,40 |
|
Лимфоциты, % |
4,4 ± 0,54*^ |
10,1 ± 0,35* |
47,0 ± 0,86 |
|
Отношение сегментоядерные нейтрофилы / альвеолярные макрофаги, усл. ед. |
5,21 ± 0,44*^ |
13,13 ± 0,69 |
9,34 ± 1,49 |
П р и м е ч а н и е: * – статистически значимое отличие от контрольной группы, ^ – от группы сравнения.
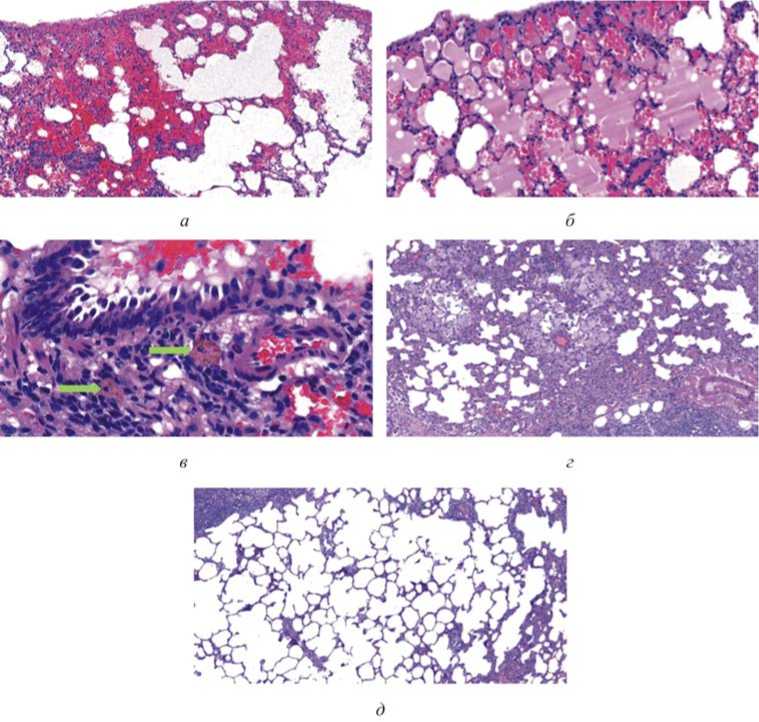
Рис. 3. Микрофотографии гистологических препаратов легких крыс, подвергнутых многократной ингаляционной экспозиции НЧ и МЧ CuO, окраска гематоксилином и эозином: а – опытная группа, участки эмфиземы и кровоизлияний, увеличение 100х; б – опытная группа, альвеолярный отек, увеличение 200х; в – опытная группа, на зеленой стрелке макрофаги с коричневым пигментом в стенке бронха, увеличение 400х; г – группа сравнения, увеличение 100х;
д – контрольная группа, увеличение 100х
Патоморфологические изменения тканей легких при многократной ингаляционной экспозиции тестируемыми материалами сопровождаются снижением массы органа. При воздействии НЧ масса легких снижена в 1,6 раза ( р < 0,05) (2,1 ± 0,1 г), МЧ – в 1,9 раза ( р < 0,05) (1,8 ± 0,1 г) относительно контрольных данных без статистически значимых различий между группами опыта и сравнения.
Анализ и обобщение полученных результатов проведенных исследований показал, что тестируемый образец CuO по показателям размера, удельной площади поверхности и суммарного объема пор является наноматериалом с выраженным отличием физических свойств от микроразмерного химического аналога. Известно, что стабильность нанораз-мерной фазы НЧ CuO напрямую зависит от электро- статического отталкивания, возникающего между частицами и уменьшающегося по мере приближения рН среды к 6 [16]. Предположительно, электростатическое отталкивание в водной среде с рН = 7 ослаблено, что способствует притягиванию и агломерации НЧ друг с другом. Это подтверждается результатами измерения гидродинамического диаметра методом динамического рассеяния света (ДЛС), согласно которым размер НЧ CuO в водной среде выше в 6,70 раза относительно значения данного показателя в составе нативного порошка, полученного методом РЭМ. Совокупность физических особенностей НЧ CuO позволяет предположить их большую проникающую способность, а следовательно, более выраженную степень бионакопления и токсические свойства в сравнении с МЧ.
Степень бионакопления НЧ и МЧ CuO при однократной ингаляционной экспозиции по увеличению концентрации меди в легких крыс сопоставима, что, вероятно, обусловлено недостаточным временем экспозиции. Подтверждением этого являются результаты исследования бионакопления при многократной экспозиции. Продемонстрировано повышенное содержание меди в легких при экспозиции НЧ в сравнении с микроразмерным химическим аналогом. Схожие изменения наблюдаются в исследовании, проведенном другими авторами, на мышах. В эксперименте зафиксировано увеличение концентрации изучаемого химического элемента в легких на протяжении воздействия НЧ CuO [17]. Поступившие в легкие НЧ способны путем трансци-тоза преодолевать эпителий дыхательных путей, проникая в интерстиций и получая доступ к кровообращению напрямую или через лимфатические сосуды, что позволяет им распространяться к различным органам и тканям организма [18]. В связи с этим можно предположить, что НЧ CuO обладают большей степенью токсичности относительно МЧ. Это подтверждается целенаправленным воздействием на легкие при интратрахеальном введении веществ, по результатам которого НЧ CuO оказывают большее влияние на состав клеточной популяции в сравнении с МЧ, что проявляется в большем относительном числе альвеолярных макрофагов и меньшем числе моноцитов и лимфоцитов. В целом увеличение содержания альвеолярных макрофагов и сегментоядерных нейтрофилов, наблюдаемое при экспозиции НЧ, характерно для развития нейтрофильного варианта острой воспалительной реакции6 [19, 20]. Это может спровоцировать развитие воспаления тканей легких и бронхов при многократной ингаляционной экспозиции в виде пневмонии, бронхита и васкулитов. Предположительно, механизм развития воспалительной реакции связан с окислительным стрессом, инициированным воздействием внутриклеточных свободных радикалов, генерации которых способствуют НЧ CuO [13, 21, 22]. Результатом данного процесса является увеличение активности провоспалительных цитокинов, запускающих воспалительную реакцию [23]. Воспалительный процесс в легких сопровождается гиперплазией лимфоидной ткани [24, 25]. В составе клеточной популяции жидкости бронхоальвеолярного лаважа при воздействии НЧ CuO наблюдается более выраженное уменьшение соотношения сегментоядерных нейтрофилов к альвеолярным макрофагам по сравнению с воздействием микроразмерного химического аналога. Данное отличие обусловлено возрастающим относительным числом альвеолярных макрофагов при одинаковой доле нейтрофилов. Известно, что число альвеолярных макрофагов зависит от количества попавших в легкие частиц, и при равной дозе оно тем выше, чем меньше диаметр частиц7. В связи с этим при поступлении в легкие меньших по размеру НЧ организму необходимо повысить эффективность механизма клиренса, что происходит за счет усиленной мобилизации альвеолярных макрофагов и нейтрофилов. Кроме этого, увеличение числа данных клеток позволяет распределить цитотоксическую нагрузку за счет снижения числа поглощенных частиц одной клеткой7.
Большая степень токсичности НЧ CuO в сравнении с МЧ подтверждается при многократной ингаляционной экспозиции. В легких крыс, экспонированных наноматериалом, отмечено развитие эмфиземы, скопления эритроцитов в просвете альвеол и отек, не обнаруженные при воздействии микроматериала. Выявление эмфиземы согласуется с результатами исследования, проведенного ранее на крысах другим коллективом авторов, в ходе которого животных подвергали ингаляционному воздействию исследуемого наноматериала только через нос [26]. Развитие данной патологии характерно при повышенной активности альвеолярных макрофагов и нейтрофилов в ткани легких [27, 28]. Из азурофиль-ных гранул нейтрофила во внеклеточное пространство высвобождаются сериновые протеазы, в том числе нейтрофильная эластаза и протеиназа 3, которые вызывают повреждение тканей [28]. Альвеолярный отек, сопровождающийся экссудацией крови в просвет альвеол, может являться результатом нарушения нормальной циркуляции крови [29], вызванного ухудшением проходимости сосудов, обусловленным изменением метаболических процессов [30]. Выявленные патоморфологические изменения сопровождаются снижением массы легких. В источниках научной литературы не обнаружено информации о влиянии НЧ CuO на массу органов при ин- галяционном пути поступления, однако данный аспект изучен при многократной пероральной экспозиции крыс. По результатам исследования [31] масса легких, подверженных воспалительным изменениям, снижается относительно контрольных значений параметра.
Выводы. Согласно результатам выполненных исследований, НЧ CuO при острой и субхронической ингаляционной экспозиции в концентрациях ~ 4 и 1,2–1,4 мг/м3 соответственно накапливаются в легких. При однократном поступлении в организм НЧ и МЧ обладают сопоставимой степенью бионакопления, что, вероятно, обусловлено недостаточным временем воздействия. Это подтверждено субхронической ингаляционной экспозицией, при которой НЧ проявляют большую степень бионакопления в легких в сравнении с МЧ, что отмечено по большему содержанию меди в 1,45 раза. НЧ CuO обладают большей степенью токсичности для органов дыхания относительно МЧ. Доказательством этого является более выраженное развитие воспалительной реакции, установленное по изменению состава клеточной популяции в жидкости БАЛЖ. Более выраженное токсическое действие НЧ CuO на ткань легких подтверждается появлением эмфиземы, отека, скоплением эритроцитов в альвеолах при субхронической ингаляционной экспозиции, что нехарактерно при воздействии МЧ. Полученные результаты необходимо учитывать при разработке мер, направленных на профилактику развития негативных эффектов со стороны органов дыхания (легкие) при ингаляционной экспозиции изучаемым наноматериалом.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Оценка особенностей бионакопления и токсического действия наночастиц оксида меди (II) на органы дыхания при ингаляционном поступлении в организм в сравнении с микроразмерным химическим аналогом для задач профилактики
- Mobasser S., Firoozi A.A. Review of nanotechnology applications in science and engineering // J. Civil Eng. Urban. -2017. - Vol. 6, № 4. - P. 84-93.
- Khan I., Saeed K., Khan I. Nanoparticles: Properties, applications and toxicities // Arabian Journal of Chemistry. -2019. - Vol. 12, № 7. - P. 908-931. DOI: 10.1016/j.arabjc.2017.05.011
- Зайцева Н.В., Землянова М.А. Гигиеническая индикация последствий для здоровья при внешнесредовой экспозиции химических факторов: монография / под ред. Г.Г. Онищенко. - Пермь: Книжный формат, 2011. - 532 с.
- Золина Л.И., Грачёва К.О. Физико-химические и биохимические свойства металлических наночастиц и их применение // Industrial Processes and Technologies. - 2022. - Т. 2, № 1. - С. 29-38. DOI: 10.37816/2713-0789-2022-2-1-29-38
- Ковалёва Н.Ю., Раевская Е.Г., Рощин А.В. Проблемы безопасности наноматериалов: нанобезопасность, нанотокси-кология, наноинформатика // Химическая безопасность. - 2017. - Т. 1, № 2. - С. 44-87. DOI: 10.25514/CHS.2017.2.10982
- Global nano copper oxide market report 2022 to 2027: industry trends, share, size, growth, opportunities and forecasts [Электронный ресурс] // Research and Markets. - URL: https://www.globenewswire.com/news-release/2022/12/23/2579082/0/ en/Global-Nano-Copper-Oxide-Market-Report-2022-to-2027-Industry-Trends-Share-Size-Growth-Opportunities-and-Forecasts.html (дата обращения: 30.08.2023).
- Synthesis, biomedical applications, and toxicity of CuO nanoparticles / S. Naz, A. Gul, M. Zia, R. Javed // Applied Microbiology and Biotechnology. - 2023. - Vol. 107. - P. 1039-1061. DOI: 10.1007/s00253-023-12364-z
- Vats M., Bhardwaj S., Chhabra A. Green synthesis of copper oxide nanoparticles using Cucumis sativus (Cucumber) extracts and their bio-physical and biochemical characterization for cosmetic and dermatologic applications // Endocrine, Metabolic & Immune Disorders Drug Targets. - 2021. - Vol. 21, № 4. - P. 726-733. DOI: 10.2174/1871530320666200705212107
- Copper oxide nanoparticle effects on root growth and hydraulic conductivity of two vegetable crops / A.J. Margenot, D.A. Rippner, M.R. Dumlao, S. Nezami, P.G. Green, S.J. Parikh, A.J. McElrone // Plant Soil. - 2018. - Vol. 431. - P. 333-345. DOI: 10.1007/s11104-018-3741-3
- Larvicidal and antifeedant effects of copper nano-pesticides against Spodoptera frugiperda (J.E. Smith) and its immunological response / A. Rahman, S. Pittarate, V. Perumal, J. Rajula, M. Thungrabeab, S. Mekchay, P. Krutmuang // Insects. -2022. - Vol. 13, № 11. - P. 1030. DOI: 10.3390/insects13111030
- Nano-sized copper oxide enhancing the combustion of aluminum/kerosene-based nanofluid fuel droplets / W. Chen, B. Zhu, Y. Sun, P. Guo, J. Liu // Combustion and Flame. - 2022. - Vol. 240. - P. 112028. DOI: 10.1016/j.combustflame.2022.112028
- Rita A., Sivakumar A., Martin Britto Dhas S.A. Influence of shock waves on structural and morphological properties of copper oxide NPs for aerospace applications // J. Nanostruct. Chem. - 2019. - Vol. 9. - P. 225-230. DOI: 10.1007/s40097-019-00313-0
- Nano-copper induces oxidative stress and apoptosis in kidney via both extrinsic and intrinsic pathways / A. Sarkar, J. Das, P. Manna, P.C. Sil // Toxicology. - 2011. - Vol. 290, № 2-3. - P. 208-217. DOI: 10.1016/j.tox.2011.09.086
- SILAC-based quantitative proteomic analysis of human lung cell response to copper oxide nanoparticles / M.J. Edelmann, L.A. Shack, C.D. Naske, K.B. Walters, B. Nanduii // PLoS One. - 2014. - Vol. 9, № 12. - P. e114390. DOI: 10.1371/journal.pone.0114390
- Copper oxide nanoparticles: In vitro and in vivo toxicity, mechanisms of action and factors influencing their toxicology / H. Sajjad, A. Sajjad, R.T. Haya, M.M. Khan, M. Zia // Comp. Biochem. Physiol. C Toxicol. Pharmacol. - 2023. -Vol. 271. - P. 109682. DOI: 10.1016/j.cbpc.2023.109682
- Transformation of CuO nanoparticles in the aquatic environment: influence of pH, electrolytes and natural organic matter / C. Peng, C. Shen, S. Zheng, W. Yang, H. Hu, J. Liu, J. Shi // Nanomaterials (Basel). - 2017. - Vol. 7, № 10. - P. 326. DOI: 10.3390/nano7100326
- Time course of pulmonary inflammation and trace element biodistribution during and after sub-acute inhalation exposure to copper oxide nanoparticles in a murine model / S. Areecheewakul, A. Adamcakova-Dodd, E. Haque, X. Jing, D.K. Meyerholz, P.T. O'Shaughnessy, P.S. Thorne, A.K. Salem // Part. Fibre Toxicol. - 2022. - Vol. 19, № 1. - P. 40. DOI: 10.1186/s12989-022-00480-z
- Oberdoster G., Oberdoster E., Oberdoster J. Nanotoxicology: an emerging discipline evolving from studies of ultrafine particles // Environ. Health Perspect. - 2005. - Vol. 113, № 7. - P. 823-839. DOI: 10.1289/ehp.7339
- Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. - М.: Медицина, 2006. - 544 с.
- Stanzel F. Bronchoalveolar Lavage // In book: Principles and Practice of Interventional Pulmonology / ed. by A. Ernst, F.J.F. Herth. - New York: Springer, 2013. - P. 165-176. DOI: 10.1007/978-1-4614-4292-9_16
- Anreddy R.N.R. Copper oxide nanoparticles induces oxidative stress and liver toxicity in rats following oral exposure // Toxicol. Rep. - 2018. - Vol. 5. - P. 903-904. DOI: 10.1016/j.toxrep.2018.08.022
- Hormesis Effects of Nano- and Micro-sized Copper Oxide / M. Keshavarzi, F. Khodaei, A. Siavashpour, A. Saeedi, A. Mohammadi-Bardbori // Iran. J. Pharm. Res. - 2019. - Vol. 18, № 4. - P. 2042-2054. DOI: 10.22037/ijpr.2019.13971.12030
- Mitochondrial reactive oxygen species promote production of proinflammatory cytokines and are elevated in TNFR1-associated periodic syndrome (TRAPS) / A.C. Bulua, A. Simon, R. Maddipati, M. Pelletier, H. Park, K.-Y. Kim, M.N. Sack, D.L. Kastner, R.M. Siegel // J. Exp. Med. - 2011. - Vol. 208, № 3. - P. 519-533. DOI: 10.1084/jem.20102049
- Khatami M. Developmental phases of inflammation-induced massive lymphoid hyperplasia and extensive changes in epithelium is an experimental model of allergy: implications for a direct link between inflammation and carcinogenesis // Am. J. Ther. - 2005. - Vol. 12. № 2. - P. 117-126. DOI: 10.1097/01.mjt.0000143699.91156.21
- Самсонова М.В., Черняев А.Л. Первичные лимфоидные поражения лёгких // Практическая пульмонология. -2016. - № 3. - С. 71-75.
- Organ burden and pulmonary toxicity of nano-sized copper (II) oxide particles after short-term inhalation exposure / I. Gosens, F.R. Cassee, M. Zanella, L. Manodori, A. Brunelli, A.L. Costa, B.G.H. Bokkers, W.H. de Jong [et al.] // Nanotoxico-logy. - 2016. - Vol. 10, № 8. - P. 1084-1095. DOI: 10.3109/17435390.2016.1172678
- Goldklang M., Stockley R. Pathophysiology of Emphysema and Implications // Chronic Obstr. Pulm. Dis. - 2016. -Vol. 3, № 1. - P. 454-458. DOI: 10.15326/jcopdf.3.1.2015.0175
- Understanding the role of neutrophils in chronic inflammatory airway disease / A.E. Jasper, W.J. Mclver, E. Sapey, G.M. Walton // F1000 Res. - 2019. - Vol. 8. - P. 557. DOI: 10.12688/f1000research.18411.1
- Pulmonary infarction in acute pulmonary embolism / F.H.J. Kaptein, L.J.M. Kroft, G. Hammerschlag, M.K. Ninamber, M.P. Bauer, M.V. Huisman, F.A. Klok // Thromb. Res. - 2021. - Vol. 202. - P. 162-169. DOI: 10.1016/j.thromres.2021.03.022
- Pulmonary vascular dysfunction in metabolic syndrome / C. Willson, M. Watanabe, A. Tsuji-Hosokawa, A. Makino // J. Physiol. - 2019. - Vol. 597, № 4. - P. 1121-1141. DOI: 10.1113/JP275856
- Features of Bioaccumulation and Toxic Effects of Copper (II) Oxide Nanoparticles Under Repeated Oral Exposure in Rats / M.S. Stepankov, M.A. Zemlyanova, N.V. Zaitseva, A.M. Ignatova, A.E. Nikolaeva // Pharm. Nanotechnol. - 2021. -Vol. 9, № 4. - P. 288-297. DOI: 10.2174/2211738509666210728163901


