Оценка отклонений коагулограммы как фактора риска рецидива сквозного макулярного разрыва при использовании аутологичной кондиционированной плазмы
Автор: Гусаков М.В., Кочергин С.А., Овсянко А.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Офтальмология
Статья в выпуске: 2 т.21, 2025 года.
Бесплатный доступ
Цель: произвести оценку отклонения активности факторов свертывания крови как потенциального фактора риска неполного закрытия и развития рецидивов сквозных макулярных разрывов после проведения оперативного вмешательства с использованием аутологичной кондиционированной плазмы — ACP-массы. Материал и методы. Проведено когортное исследование с участием 62 пациентов (62 глаза) с первичным сквозным макулярным разрывом. Пациентам проведено лечение: микроинвазивная субтотальная витрэктомия с удалением эпиретинальной и внутренней пограничной мембран, аппликация ACP-массы, тампонада воздухом. Пациенты разделены на 2 группы: основную (31 пациент с отклонениями в коагулограмме) и контрольную (31 пациент с нормальными показателями коагулограммы). Результаты. Сравнение результатов оперативного лечения показало, что среди пациентов с отклонениями в коагулограмме рецидив макулярного разрыва наблюдался в 85,7 % случаев, в контрольной группе данный показатель составил 14,3 % (p=0,005). При оценке отклонений показателей коагулограммы среди пациентов с рецидивом макулярного разрыва выявлено, что в 83,3 % случаев наблюдалось повышение протромбинового времени (p=0,042), в 75,0 % случаев снижение концентрации фибриногена (p=0,049). Заключение. Отклонения в коагулограмме могут быть фактором риска неуспешного закрытия макулярного разрыва при использовании ACP-массы. Рецидив в 6 раза чаще выявлялся при увеличении протромбинового времени, а также при снижении показателя фибриногена ниже 2,0 г / л в крови пациентов.
Сквозной макулярный разрыв, незакрывшийся макулярный разрыв, витреоретинальная хирургия, аутологичная кондиционированная плазма
Короткий адрес: https://sciup.org/149148494
IDR: 149148494 | УДК: 617.735 | DOI: 10.15275/ssmj2102143
Текст научной статьи Оценка отклонений коагулограммы как фактора риска рецидива сквозного макулярного разрыва при использовании аутологичной кондиционированной плазмы
EDN: EKDXJL
1Введение. Сквозной макулярный разрыв (СМР и МР) является патологией, при которой происходит развитие дефекта макулярной зоны во всю толщину нейроэпителия. Ежегодно данная нозология поражает 7,4 человека на 100 тыс. населения и приводит к развитию центральной скотомы, снижению остроты зрения вплоть до развития слепоты [1]. В настоящее время данная патология успешно поддается лечению путем витреоре-тинального вмешательства, приводя к восстановлению анатомического профиля макулярной зоны и повышению остроты зрения. Однако, по данным последних статистических исследований, в 6-11 % случаев наблюдается неполное смыкание МР после оперативного вмешательства [2–3]. В качестве причин неполного закрытия СМР после операций рассматривают следующие факторы риска: ригидность краев длительно существующего МР, большой диаметр МР (> 400 мкм), идиопатический МР 4-й стадии (по J. D. Gass), несоблюдение рекомендуемого положения лицом вниз пациентом в ранний послеоперационный период, наличие миопии высокой степени, негроидная раса пациента [4, 5]. Повторные операции, проводимые для закрытия неполного смыкания СМР, создают дополнительные финансовые затраты для медучреждения и увеличивают риск ятрогенных осложнений, таких как разрывы и отслойка сетчатки [3, 6–8].
Для полного закрытия МР были разработаны различные хирургические техники: использование лоскута внутренней пограничной мембраны (ВПМ), применение аутоплазмы, послабляющих разрезов сетчатки, пилинг ВПМ с механическим воздействием на края разрыва, гидродиссекция макулы.
Использование аутоплазмы, обогащенной тромбоцитами, получило широкое распространение в хирургии СМР. Выделяют 2 основные технологии получения аутоплазмы для закрытия дефектов макулярной зоны: PRP-технология (с использованием плазмы, обогащенной тромбоцитами, — Platelet Rich Plasma) и ACP-технология (с применением аутологичной кондиционированной плазмы — Autologous Conditioned Plasma). Обе технологии показали эффективность в закрытии идиопатических СМР различных размеров в клинических исследованиях [9–12]. При оперативном лечении МР в условиях Московского городского офтальмологического центра ГБУЗ г. Москвы «Московский многопрофильный научно-клинический центр им. С. П. Боткина» Департамента здравоохранения (ГБУЗ «ММНКЦ им. С. П. Боткина» ДЗМ) наиболее часто применяют ACP-технологию.
Потенциальным преимуществом ACP-технологий над PRP является состав получаемой при центрифугировании аутоплазмы. ACP-масса в сравнении с PRP-массой обладает повышенным содержание тромбоцитов ( p <0,001), факторов свертывания крови
и факторов роста: инсулиноподобного фактора роста 1 ( p <0,001), трансформирующего фактора роста β1 ( p <0,001), а также более низким числом лейкоцитов ( p <0,001) [13]. Наличие повышенного уровня тромбоцитов, факторов свертывания и факторов роста потенциально ассоциировано с формированием более плотного сгустка и высоким заживлением сетчатки в участке МР.
При анализе современных научных публикаций наблюдаются тенденции по активному изучению роли тромбоцитов и факторов свертывания крови вне системы гемостаза. Имеются результаты исследований, подтверждающих роль отдельных факторов свертывания на процессы репарации и реваскуляризации в различных тканях, что говорит о потенциальном влиянии компонентов аутоплазмы не только на механическое сближение краев разрыва, но и на восстановление нейроэпителия сетчатки в участке дефекта [14–18].
Опубликованы также сообщения о влиянии состава аутоплазмы на закрытие МР и репарацию сетчатки [19]. Однако отсутствуют исследования, изучавшие влияние исходных прокоагулянтных свойств крови пациента на формирование сгустка в области МР и восстановление макулярного профиля при применении ACP-массы.
По данным Московского городского офтальмологического центра ГБУЗ «ММНКЦ им. С. П. Боткина» ДЗМ, с 01.01.2023 по 01.01.2025 было прооперировано 148 глаз с впервые выявленным СМР. Полное смыкание разрыва после операции наблюдалось в 133 (89,9%) глазах. Неполное смыкание МР наблюдалось в 15 (10,1 %) глазах. Таким образом, предупреждение рецидивов МР и увеличение количества успешных операций является перспективным направлением исследований.
Цель — произвести оценку отклонения активности факторов свертывания крови как потенциального фактора риска неполного закрытия и развития рецидивов СМР после проведения оперативного вмешательства с использованием ACP-массы.
Материал и методы. Произведено одноцентровое ретроспективное когортное исследование, включающее 62 пациентов (62 глаза) с первичным СМР. Критериями включения в когорту являлись наличие идиопатического СМР, подтвержденного исследованием оптической когерентной томографии (ОКТ), переднезадняя ось глаза менее 26 мм, наличие исследования ОКТ макулярной зоны через 7 дней и 1 мес после оперативного вмешательства. Всем пациентам произведено оперативное вмешательство: микроинвазивная закрытая субтотальная витрэктомия + удаление эпиретинальной мембраны и ВПМ + аппликация ACP-массы на область МР + тампонада воздухом. Пациенты были разделены на 2 группы. В 1-ю (основную) группу включены больные, у которых наблюдалось повышение или понижение значений показателей коагулограммы перед оперативным вмешательством ( n =31). Во 2-ю (контрольную) группу вошли пациенты с показателями коагулограммы, не выходящими
Оценка результатов хирургического лечения пациентов двух групп
Таблица 1
|
Группа пациентов |
Результат оперативного лечения, абс. (%) |
p |
|
|
полное смыкание МР |
рецидив МР |
||
|
Основная (с отклонениями в коагулограмме) Контрольная (показатели коагулограммы в норме) |
19 (39,6) 29 (60,4) |
12 (85,7) 2 (14,3) |
0,005 |
Таблица 2
Оценка результатов оперативного лечения в зависимости от отклонений показателей коагулограммы
В основную группу вошли 7 (22,60%) мужчин и 24 (77,40%) женщин в возрасте 67,39±5,96 года (от 56 до 80 лет). Средний диаметр МР составил 794,23±315,69 мкм (от 457 до 1829 мкм). В контрольную группу включены 8 (25,80%) мужчин и 23 (74,20 %) женщин в возрасте 66,97±5,06 года (от 52 до 75 лет). Средний диаметр МР составил 793,65±221,51 мкм (от 440 до 1579 мкм). Стоит отметить, что средний размер МР в обеих группах был сопоставим, потому влияние данного фактора на исход хирургического лечения было исключено.
Статистическая обработка полученных данных проведена при помощи пакетов программ StatTech 4.0.7 (ООО «Статтех», Россия) и Microsoft Excel 2019 (Microsoft, США). Оценку связи между результатами оперативного лечения и наличием отклонений отдельных показателей коагулограммы проводили с помощью коэффициента ранговой корреляции Спирмена. Для оценки значимости различий категориальных переменных применяли метод χ² Пирсона. Различия между показателями считали статистически значимыми при р< 0,05.
Результаты. При сравнении результатов оперативного лечения с использованием аутоплазмы выявлено, что среди пациентов с отклонениями в коагулограмме чаще наблюдалось развитие рецидива МР в сравнении с пациентами из контрольной группы ( p =0,005) (табл. 1).
В основной группе пациентов произведена оценка взаимосвязи между результатами оперативного лечения и наличия отклонений отдельных показателей коагулограммы (табл. 2).
Показано, что рецидива МР в 6,1 раза чаще выявляется среди пациентов с увеличенным показателем
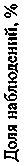
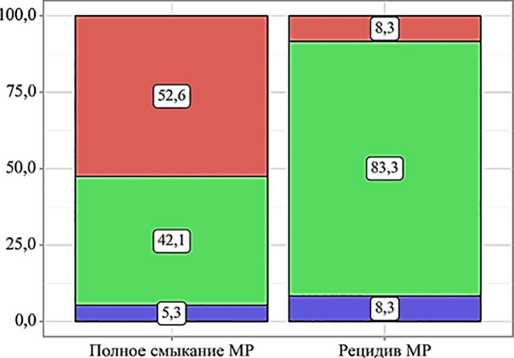
Значение ПВ
Результат хирургического лечения
Рис. 1. Частота встречаемости полного смыкания макулярного разрыва и его рецидива при изменениях показателя протромбинового времени в сыворотке крови

ПВ в норме
ПВ увеличено
ПВ снижено
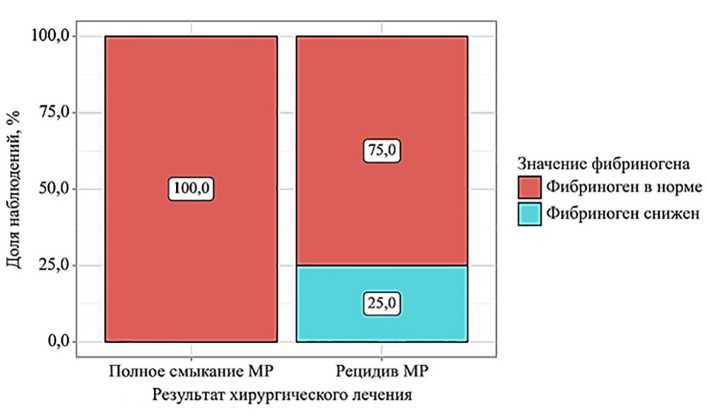
Рис. 2. Частота встречаемости полного смыкания макулярного разрыва и его рецидива при изменениях показателя фибриногена в сыворотке крови
ПВ ( p =0,042), а также количеством фибриногена в сыворотке крови ниже 2,0 г/л ( p =0,049) (рис. 1 и 2).
Обсуждение. Основной эффект ACP-массы при закрытии МР заключается в исходном контакте тромбоцитарного компонента с участками дефекта сетчатки, его агрегацией и активацией, а также формированием рыхлого тромбоцитраного сгустка, который первично закрывает МР. Параллельно этому процессу происходит активация факторов свертывания плазмы крови (коагуляционного компонента свертывающей системы), благодаря чему наблюдается формирование нерастворимого фибрина и плотного фибриноклеточного тромба. Отдельно стоит отметить, что активированные факторы свертывания (в частности XIIIa-фактор) также стимулируют процесс ретракции тромбоцитов в составе сгустка, что способствует сближению краев МР [14, 15].
В последние годы происходит активное изучение роли факторов свертывающей системы вне системы гемостаза. Сейчас имеются многочисленные исследования, в которых подтверждается активная роль отдельных факторов свертывания в таких процессах, как регенерация, ремоделирование и реваскуляризация поврежденных тканей [14–18].
Отдельного внимания заслуживают работы, подтверждающие роль факторов свертывания в процессах регенерации повреждений нервной ткани центральной нервной системы, эмбриологически сходной с клетками нейроэпителия сетчатки. В экспериментах обнаружена роль факторов X, VII, TF в восстановлении клеток центральной нервной системы после инсульта. Так, комплекс активированных факторов свертывания крови TF-VII–X способен приводить к запуску экспрессии PAR 2 (рецептора, активируемого протеазой 2) и активации каскада молекулярных реакций, приводящих к реваскуляризации и восстановлению астроглии и нейронов, снижению образования участков глиального фиброза в сравнении с контрольной группой, в которой производили нокаут гена, активирующего пути, ассоциированные с PAR 2 [18, 20]. Были также найдены работы, отражающие роль активности тромбина (IIa) на экспрессию рецептора, активируемого протеазой 1 (PAR 1), благодаря чему регулируется процесс ремоделирования клеток нервных тканей, а также ганглиозных клеток сетчатки при нейродегенеративнх заболеваниях [16,17].
Таким образом, низкое количество и/или активность факторов свертывающей системы крови ассоциировано с формированием менее плотного фибринно-клеточного тромба в участке СМР, более низким потенциалом сближения краев разрыва, а также со снижением регенерации нейроэпителия в участке разрыва. Потому отклонения в коагулограмме, отражающие пониженную активность свертывающей системы крови, могут являться маркером развития рецидива СМР при проведении витреоре-тинального вмешательства с использованием аутоплазмы.
Согласно данным настоящего исследования, наличие отклонений в коагулограмме перед операцией у пациентов с СМР может рассматриваться в качестве потенциального фактора риска неполного смыкания дефекта нейроэпителия, так как была выявлена ассоциация с более высокими рисками развития рецидива разрыва после операции с использованием ACP-массы среди данной группы пациентов ( p <0,005). При анализе взаимосвязи между отклонениями отдельных показателей коагулограммы и неполным смыканием СМР были обнаружены некоторые статистически значимые закономерности ( p <0,05). Среди пациентов с повышенным показателем ПВ чаще развивался рецидив МР, выявленный в течение 1-го месяца после оперативного вмешательства ( p =0,042). Анализ уровня ПВ в сыворотке крови — скрининговое исследование, отражающее активность внешнего пути коагуляционного гемостаза (активность факторов свертывания крови VII, X, V, протромбина, фибриногена). Повышение показателя ПВ говорит о сниженной концентрации и/или активности описанных ранее факторов свертывания, ассоциировано с гипокоагуляционным состоянием плазмы крови и низким потенциалом в формировании стабильного сгустка. Стоит отметить, что более низкая активность и/или концентрация факторов VII, X может неблагоприятно сказываться на репарации сетчатки ввиду сниженной активации каскадов, ассоциированных с PAR 2 [18, 20].
Снижение показателя фибриногена в сыворотке крови пациентов перед операцией также статистически значимо коррелировало с более высокими рисками по развитию рецидива СМР ( p =0,049). Фибриноген в своей активной форме (фибрина) способствует стабилизации тромбоцитарного сгустка, а также является матрицей для выработки коллагена и других молекул соединительной ткани при ремоделировании дефектов тканей [15]. Вследствие этого его низкая концентрация в исходной плазме крови пациента сопряжена с более низкими перспективами по формированию тромба в участке СМР и регенерации нейроэпителия.
Таким образом, можно отметить следующую закономерность: использование ACP-массы может быть менее эффективным в закрытии МР при наличии отклонений показателей коагулограммы в сторону гипокоагуляции (повышение ПВ), а также при снижении показателя фибриногена.
Заключение. Использование ACP-массы — эффективный метод закрытия идиопатических СМР различных размеров. Однако, как и при других хирургических методах лечения дефектов макулярной зоны, после проведения данного вида оперативного вмешательства возможно развитие рецидива МР. Причины этого явления все еще остаются не до конца изученными.
Согласно данным настоящего исследования, в качестве потенциального фактора риска неуспешного закрытия МР при использовании ACP-массы было рассмотрено наличие отклонений в коагулограмме. Среди пациентов, имевших повышение ПВ и снижение количества фибриногена, чаще выявлялся рецидив МР ( p =0,042 и 0,049). Именно поэтому наличие отклонений коагулограммы в сторону гипокоагуляции, а также наличие сниженного показателя фибриногена перед операцией могут рассматриваться хирургом в качестве потенциального фактора риска при использовании аутоплазмы для закрытия МР, что может сподвигнуть его на использование альтернативных хирургических техник или их комбинаций (например, использование обратного лоскута ВПМ совместно с аутоплазмой) для снижения рисков рецидива СМР и, следовательно, проведения повторного оперативного вмешательства для его закрытия.
Безусловно, немаловажную роль в закрытии дефекта макулярной зоны играет тромбоцитарный компонент аутоплазмы. Однако роль факторов свертывания также важна, поскольку они способствуют формированию фибрина и стабилизации тромба в участке МР, играют роль в ретракции сгустка, сближая края нейроэпителия, стимулируют запуск процессов регенерации в участке разрыва. Вопрос влияния отдельных факторов на процессы репарации МР является открытым и требует дальнейшего изучения в исследованиях. Стоит также отметить, что данные коагулограммы не являются высокоспецифичными и не могут точно отражать состояние количества или активности отдельных компонентов коагуляционного гемостаза, однако данное лабораторное исследование высокодоступно и входит в обязательный минимум клинических анализов перед оперативным вмешательством согласно действующим клиническим рекомендациям.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.


