Оценка пребиотической активности экстрактов растений для разработки препаратов, стимулирующих кишечную микрофлору
Автор: Самойлова З.Ю., Безматерных К.В., Смирнова Г.В., Октябрьский О.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Проведена оценка пребиотической активности высоких и низких доз водных экстрактов лекарственных растений, зеленого и черного чая путем слежения за изменением интенсивности образования биопленок и колониеобразующей способности зрелых сессильных культур бактерий Escherichia coli BW25113 при культивировании на свежей среде в присутствии экстрактов. Показано, что высокие и низкие дозы экстрактов Arctostaphylos uva-ursi, Vaccinium vitis-idaea, зеленого и черного чая стимулируют биопленкообразование, однако оказывают неоднозначные эффекты на колониеобразующую способность. Высокая пребиотическая активность выявлена у низких доз экстрактов A. uva-ursi и V. vitis-idaea, а также у высоких доз экстрактов зеленого чая. Экстракты Betula pendula и Laminaria japonica не влияли на изменение биопленкообразования, однако высокие дозы проявляли умеренную бактерицидную активность.
Бактериальные биопленки, экстракты растений, пребиотики
Короткий адрес: https://sciup.org/147204796
IDR: 147204796 | УДК: 579.61:579.22
Текст научной статьи Оценка пребиотической активности экстрактов растений для разработки препаратов, стимулирующих кишечную микрофлору
В настоящее время совокупную микрофлору кишечника человека рассматривают как отдельный орган, который вносит значительный вклад в поддержание здоровья макроорганизма. Кишечные бактерии образуют биопленки на стенках эпителия кишечника, не только препятствуя адгезии болезнетворных мик-рооргантмов, но и участвуя в процессах обмена веществ (синтез витаминов. переваривание отдельных компонентов пищи и т.д) [Von Rosenvinge et al., 2013]. В связи с этим, одним из актуальных направлений современной науки является поиск веществ и разработка на их основе препаратов-пребиотиков, стимулирующих микрофлору7 кишечника человека и повышающих сопротивляемость макроорганизма к действию неблагоприятных факторов окружающей среды.
Перспективными источниками веществ, обладающих пребиотической активностью, могут быть экстракты растений, которые широко применяются в народной медицине для профилактики и лечения различных заболеваний. Экстракты растений представляют собой смеси высокоактивных биологических веществ, в частности, полифенолов. В низких дозах эти вещества способны выполнять функции
(С Самойлова 3. Ю.. Безматерных К. В., Смирнова Г. В , Октябрьский О. Н., 2016
регуляторных молекул и стимулировать защитные системы клетки. Известно. что полифенолы растений способны оказывать противовоспалительноСк противоопухолевое, антиоксидантное действие, а также положительные эффекты при заболеваниях сердечно-сосудистой и нервной системы [Hanh Shen. Lou, 2007]. Считается, что механизмы положительного влияния субстратов растительного происхождения на организм опосредованы через воздействие на активность кишечной микрофлоры [Halliwell, Rafter. Jenner, 2005; Parkar, Stevenson. Skinner. 2008]. Являясь представителями нормальной микрофлоры человека и животных, бактерии Escherichia сой хорошо изучены в физиологическом и генетическом отношении и поэтому’ являются удобными тест-системами для оценки пробиотической активности экстрактов растений.
Ранее нами было изучено антиоксидантное действие низких доз экстрактов растений и индивидуальных полифенолов на планктонные культуры бактерий Е. сой [Smirnova et al_ 2009, 2012; Okty-abrsky et al., 2009], а также стимулирующее влияние растительных субстратов на образование планктонными культурами Е. сой биопленок [Samoilova et al., 2014]. В научной литературе данные о ВЛИЯНИИ высоких доз растительных субстратов на биопленкообразование противоречивы.
Малоизученным остается влияние экстрактов растений на биопленкообразование зрелых ссе-сильных культур бактерий. Преимуществом и новизной нашего исследования является одновременное изучение в динамике эффектов высоких и низких доз экстрактов растений на биопленкообразование кишечных бактерий и их колониеобра-зутошую способность.
Материалы и методы
В работе использовали штаммы Е. сой BW25113 (wt) из коллекции Keio [Baba et al., 2006]. Биопленки получали следующим образом. Ночные культуры бактерий выращивали в пробирках при 37 °C без встряхивания на минимальной среде М9 (5 мл) [Millen 1972] с добавлением 2.0 г/л глюкозы в течение 16-18 ч. Затем, после центрифугирования при 8000g в течение 5 мин. на центрифуге Thermo Scientific (Германия). клетки из ночной культуры ресуспсндировали в лунках полистироловых 96-луночных планшетов со свежей средой М9 с добавлением 4.0 г/л глюкозы. 0.2%-ных казаминовых кислот тиамина (10.0 мкг/мл) до значения оптической плотности при 600 нм (OD^oo) 0.1. Конечный объем среды составил 200 мкл. Далее эти культуры выращивали в течение 22 ч. при 37°С.
Полученные зрелые биопленки дважды отмывали физиологическим раствором (0.9% NaCI) и ресуспсндировали в 200 мкл свежей среды М9 с добавлением 4.0 г/л глюкозы, 0.2%-ных казаминовых кислот, тиамина (10.0 мкг/мл) и экстрактов растений (действующая доза составляла 0.83 или 6.64 мг сухого вещества/мл). Затем биопленки культивировали в течение 3 ч. на термостатируемом шейкере GFL (Германия) при 37°С, 330 об/мин, каждый час с помощью планшетного спектрофотометра xMark™ Bio-Rad (США) определяя изменение интенсивности биопленкообразования модифицированным методом окрашивания биопленок генцианвиолетом [O’Toole. Kolter, 1998; Naves et al., 2008]. Среду удаляли, и лунки дважды отмывали 200 мкл стерильного физиологического раствора. Лунки подсушивали на воздухе и окрашивали 150 мкл 0.1%-ным раствором красителя генцианового фиолетового в течение 30 мин. Далее краситель удаляли и пятикратно отмывали лунки дистиллированной водой и подсушивали планшеты на воздухе в течение часа. Затем в каждую лунку добавляли 200 мкл 96%-ного этанола, 125 мкл раствора переносили в новый планшет, в котором измеряли светопоглощение OD^o. Интенсивность биоплекообразования рассчитывали согласно формуле
BF = АВ - CW, где АВ - значение OD?^, окрашенных биопленок. CW - значение OD540 окрашенных лунок без клеток.
Для определения колониеобразующей способности лунки планшетов с биопленками дважды отмывали и ресуспсндировали в 200 мкл физиологического раствора. Затем подвергали ультразвуковой дезинтеграции (2 пульса продолжительностью 1 мин, с перерывом в 1 мин, между пульсами, 37 kHz, 30W) в ультразвуковой бане Ultrasonic cleaning unit Elmasonic SI0 H. Elma (Германия). Далее готовили 10-кратные разведения в физиологическом растворе. Капли по 10 мкл высевали на чашки с LB-агаром (1.5%). Подсчет колоний производили через 24 ч. после инкубирования чашек при 37°С.
Тестируемые экстракты растений готовили из отечественных коммерческих препаратов ОАО «Красногорсклексредства» и ЗАО «Иван-Чай» (Россия), зеленый и черный чай - из продуктов марки Greenfield «Golden Ceylon», Greenfield tea Ltd (Великобритания).
Перечень экстрактов приведен в таблице Сухую навеску (1 г) заливали 30 мл горячей воды и заваривали на водяной бане в течение 30 мин., охлаждали, фильтровали на мембранном фильтре. Для получения концентрированных экстрактов пользовались концентратором IKA RV10 (Германия). Во всех экспериментах использовали свежие экстракты.
Результаты и их обсуждение
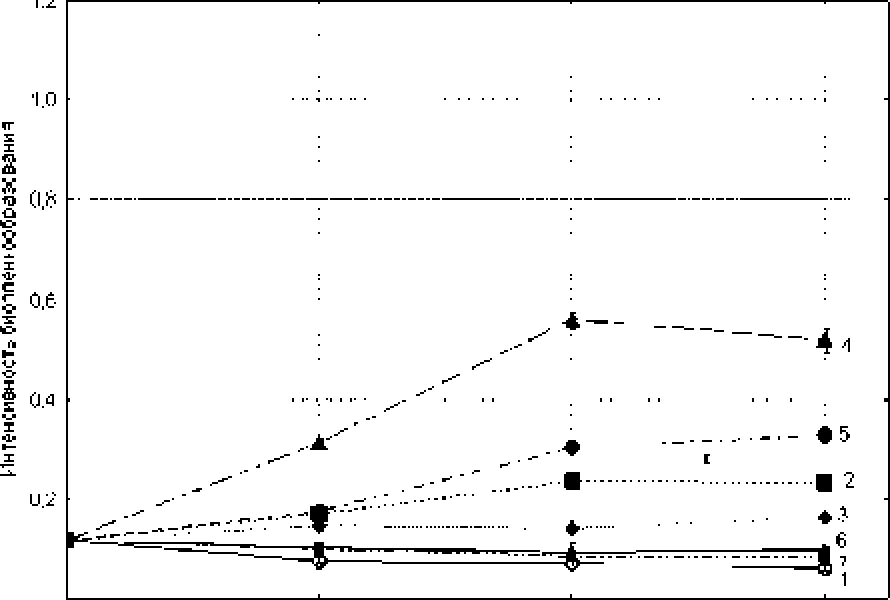
В начале культивирования зрелых биопленок Е. сой BW25113 на свежей среде в отсутствие экстрактов растений показатель OD^n составил 0.116 ± 0.012, а через час резко упал до 0.076 ± 0.007, а к концу культивирования понизился до 0.061 ± 0*007. В присутствие низкой дозы (0*83 мг сухого вещества/мл) экстрактов Г vitis-idaea, A. ava-arsi. зеленого и черного чая через час после начала культивирования наблюдалось, напротив, достоверное увеличение интенсивности биопленкообра-зования (БПО) в 2.3, 4.2, 2.3 и 1*9 раза, соответственно. по сравнению с необработанными экстрактами биопленками (рис* 1)* Через 2 ч* низкие дозы указанных экстрактов повышали биопленкообра-зование в 7 9,4 х 3 3 и 2 раза, соответственно.
Перечень испытуемых экстрактов растений
|
Название коммерческого препарата |
Латинское название растений |
|
Зеленый чай |
Camellia sinensis |
|
Черный чай |
Camellia sinensis |
|
Uvae ursi folia, толокнянки листья |
Arctostaphylos uva-ursi |
|
Vitis-idaeae folia, брусники листья |
Coccinium vitis-idaea |
|
Betulae folia, берёзы листья |
Benda pendula |
|
Laminariae thali, ламинарии слоевища |
Laminaria japonica |
Время. ч
Рис. L Изменение интенсивности биоплен-кообразования Е. colt BW25113 при инкубации с низкими дозами экстрактов (0 83 мг сухого вещества/мл):
1 - контроль (без экстракта); 2 - С sinensis (зеленый чай); 3 - С. sinensis (черный чай); 4 - А. uva-«rsi\ 5 - I" vitis-idaea; 6 -В. pendula; 1 -L. japonka
В конце культивирования наблюдалось БПО в 8.5, 5.4, 3.8 и 2.7 раза, соответственно. Примечательно, что при этом низкие дозы всех экстрактов, за исключением В. pendukh стимулировали повышение колониеобразующих единиц (КОЕ) бактерий в составе сессильных культур (рис. 2). Низкие дозы всех испытуемых экстрактов оказывали стимулирующее влияние на колониеобразутошую способность бактерий, повышая показатель КОЕ в 1.9 (зеленый чай) - 7.6 (толокнянка) раза. Максимальный стимулирующий эффект на БПО и ный стимулирующий эффект на БПО и колониеобразующую способность Е. со И BW25113 на протяжении всего периода культивирования оказывали низкие дозы Л. uva-ursi и К 17Г^г-/^^<7*
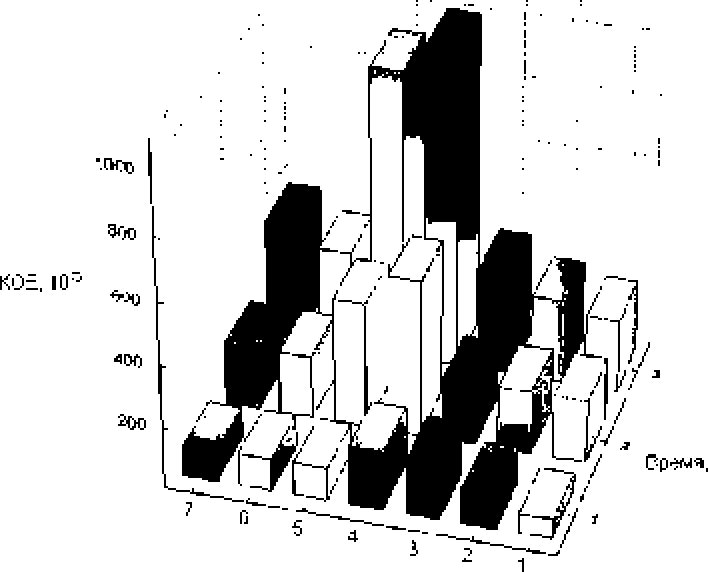
Рис. 2* Изменение показателя колониеобразующих единиц биопленок при культивировании в присутствии низких доз экстрактов.
Обозначения как на рис. 1
В целом действие высоких доз (6.64 мг сухого вещества/мл) экстрактов на БПО имело еще более выраженный стимулирующий характер (рис. 3). Через час обработки высокими дозами экстрактов А» uva-ursi, Г* vitis-idaea, зеленого и черного чая БПО увеличивалось в 5.4, 5.4, 2.5 и 1.7 раза, соответственно, по сравнению с необработанными экстрактами биопленками. При этом экстракты К vi-iis-idaea и В. pendula (6.64 мг сухого вещества/мл) снижали показатель КОЕ в 7.5 н 1.7 раза. А высокие дозы экстракта Л+ uva-ursi повышали КОЕ в 2 раза (рис. 4).
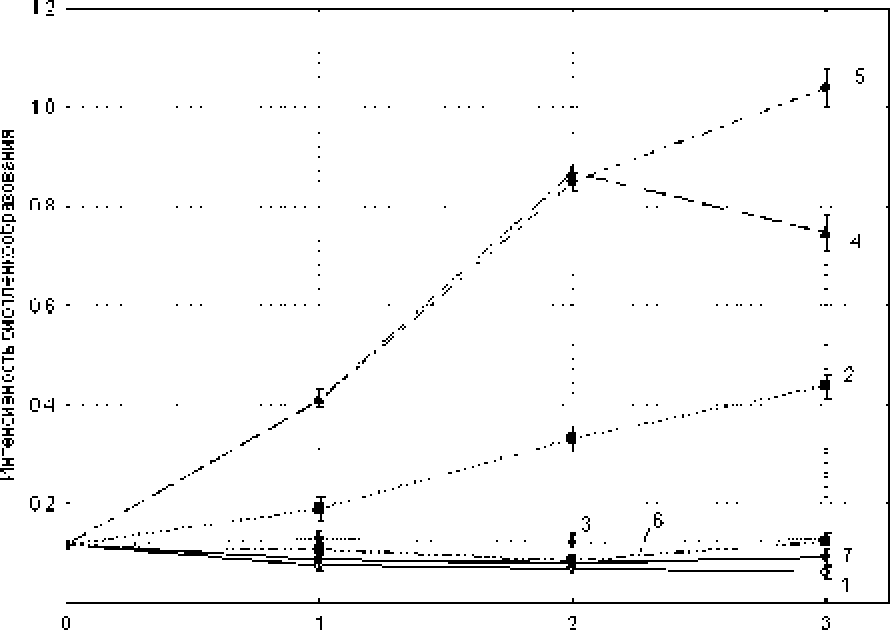
бремя ч
Рис* 3, Изменение интенсивности биоплен-кообразования Е. соii BW25113 при инкубации с высокими дозами экстрактов (6.64 мг сухого вещества/мл)*
Обозначения как на рис. 1
Через 2 ч. после начала культивирования А. uva-ursi, С. vitis-idaea, зеленого и черного чая БПО увеличилось в 12.0, 12*0, 4*6 и 1.7 раза, соответст- венно. Повышение интенсивности БПО в присутствии высоких доз A. uva-ursi и V. vitis-idaea сопровождалось понижением КОЕ б 2*6 и 2.3 разак соответственно. Хотя высокие дозы экстрактов В. pendula и L. japonica нс влияли на БПО* в их присутствии отмечалось достоверное снижение КОЕ в 2*7 и 2.0 раза, соответственно. К концу культивирования высокие дозы экстрактов .4. uva-ursh И vitis-idaea, зеленого, черного чая и березы стимулировали БПО в 12.0, 17.0, 7.2, 2.1 и 2.0 раза. При этом высокие дозы экстрактов зеленого чая стимулировали колониеобразующую способность в 1.7 раза, а экстракт В. pendula снижал показатель КОЕ в 1.4 раза.
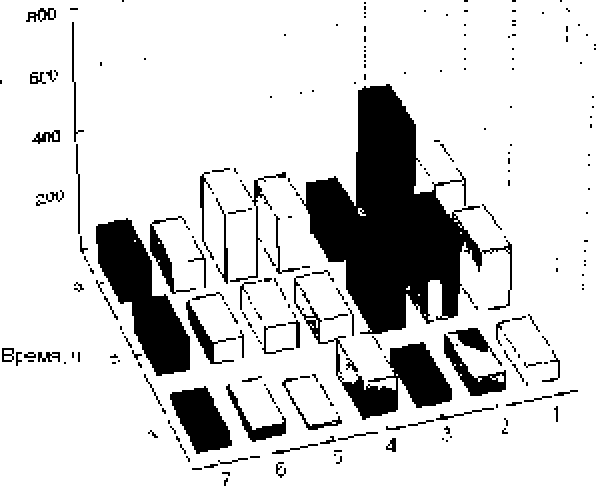
Рис 4* Изменение показателя колониеобра-зутощих единиц биопленок при культивировании в присутствии высоких доз Экстрактов.
Обозначения как на рис. 1
Б совокупности, наши результаты свидетельствуют о стимулирующем влиянии высоких и низких доз экстрактов A. uva-ursi. К vitis-idaea, зеленого и черного чая на БПО кишечных бактерий и неоднозначном влиянии на показатель КОЕ.
Учитывая оба исследованных показателя, в наших условиях наиболее высокой пребиотической активностью обладали низкие ДОЗЫ A. uva-ursi и К vitis-idaea, а также высокие дозы зеленого чая.
Наблюдаемые нами стимулирующие эффекты на БПО могли быть вызваны подавлением подвижности и стимуляцией факторов адгезии гра-мотрицательных бактерий [LaPlante et al.? 2012]. Имеются сведения о пребиотических эффектах компонентов зеленого чая на бактерии spp. Bifidobacterium и Lactobacillus [Lee et al., 2006: Tzounis et al., 2008]* Сообщается, что высокие дозы J< vitis-idaea и В. pendula (10-20 мг сухого веса/мл) оказывали бактерицидные эффекты на бактерии Е. coli [Wojnicz et al * 2012]. В наших условиях используемые дозы указанных экстрактов были ниже* однако 6.64 мг сухого вещества/мл приводили к снижению показателя КОЕ* Высокие дозы экстрактов В. pendula и L. japonica также проявляли умеренную бактерицидную активность.
Заключение
Выявленные стимулирующие эффекты НИЗКИХ доз экстрактов Л. uva-ursi, К vitis-idaea, а также высоких доз зеленого чая на БПО и колониеобразующую способность свидетельствуют о высокой пребиотической активности, а также указывают на перспективность создания пребиотических препаратов на основе указанных растений.
В целом выявленные эффекты расширяют представления о физиологии И ЭКОЛОГИИ кишечных бактерий, однако лежащие в их основе механизмы нуждаются в дальнейшем исследовании.
Работа поддержана грантом РФФИ-Урал №14-04-96031.
Список литературы Оценка пребиотической активности экстрактов растений для разработки препаратов, стимулирующих кишечную микрофлору
- Baba T. et al. Construction of Escherichia coli strain K-12 in-frame, single-gene knockout mutants: the Keio Collection//Mol. Biol. Syst. Biol. 2006. Vol. 2: 0008.
- Halliwell B., Rafter J., Jenner A. Health promotion by flavonoids, tocopherols, tocotrienols, and other phenols: direct or indirect effects? Antioxidants or not?//Am. J. Clin. Nutr. 2005. Vol. 81(suppl.). P. 268S-276S.
- Han X., Shen T., Lou H. Dietary polyphenols and their biological significance//Int. J. Mol. Sci. 2007. Vol. 8. P. 950-988.
- LaPlante K.L. et al. Effects of cranberry extracts on growth and biofilm production of Escherichia coli and Staphylococcus species//Phytother. Res. 2012. Vol. 26. P. 1371-1374.
- Lee H.C. et al. Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota//Res. Microbiol. 2006. Vol. 157. P. 876-884.
- Miller J.H. Experiments in molecular genetics. Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 1972
- Naves P. et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is methoddependent//J. Appl. Microbiol. 2008. Vol. 105. P. 585-590.
- Oktyabrsky O. et al. Assessment of antioxidant activity of plant extracts using microbial test systems//J. Appl. Microbiol. 2009. Vol. 106. P. 1175-1183.
- O’Toole G.A., Kolter R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signaling pathways: a genetic analysis//Mol. Microbiol. 1998. Vol. 28. P. 449-461.
- Parkar S.G. Stevenson D.E., Skinner M.A. The potential influence of fruit polyphenols on colonic microflora//Int. J. Food Microbiol. 2008. Vol. 124. P. 295-298.
- Samoilova Z. et al. Medicinal plant extracts can variously modify biofilm formation in Escherichia coli//Antonie van Leeuwenhoek. 2014. Vol. 105. P. 709-722
- Smirnova G.V. et al. Influence of polyphenols on Escherichia coli resistance to oxidative stress//Free Radic. Biol. Med. 2009. Vol. 46. P. 759-768.
- Smirnova G. et al. Influence of plant polyphenols and medicinal plant extracts on antibiotic susceptibility of Escherichia coli//J. Appl. Microbiol. 2012. Vol. 113. P. 192-199.
- Tzounis X. et al. Flavanol monomer-induced changes to the human faecal microflora//Br. J. Nutr. 2008. Vol. 99. P. 782-792.
- Von Rosenvinge E.C. et al. Microbial biofilms and gastrointestinal diseases//Pathogens and disease. 2013. Vol. 67. P. 25-38.
- Wojnicz D. et al. Medicinal plant extracts affect virulence factors expression and biofilm formation by the uropathogenic Escherichia coli//Urol. Res. 2012. Vol.40. P. 683-697.


