Оценка противолучевой эффективности инкапсулированного в липосому лекарственного средства
Автор: Плотникова Э.М., Василевский Н.М., Ефимова М.А., Гайнуллин Р.Р., Шакуров М.М., Вафин Ф.Р.
Статья в выпуске: 1 т.261, 2025 года.
Бесплатный доступ
Профилактика и лечение острой лучевой болезни животных являются одним из ведущих направлений развития и совершенствования противолучевых препаратов. Организм человека и животных не содержит специфические рецепторы для осязания ионизирующих излучений, но в свою очередь, гамма-кванты отвечают ионизацией молекул биологических структур и водных сред. В результате образования свободных радикалов происходит вторичное повреждение биологических структур. Главная опасность для организма - это образование свободных радикалов, которые поражают клетки и структуры организма. Поэтому основной защитой организма при лучевой болезни заключается в нейтрализации свободных радикалов и восстановлении поврежденных структур - клеток мишеней. Для этого разработаны и разрабатываются радиозащитные препараты различного механизма действия. Наиболее эффективно использование таких средств в липосомальной форме. С учетом актуальности проблемы, сотрудниками ФГБНУ «ФЦТРБ-ВНИВИ» разработана технология получения липосомальной формы конъюгированного противолучевого средства, которое будет являться перспективным средством доставки биологически активных соединений в места локализации продуктов радиолиза в органах и тканях, подвергнутых действию ионизирующего излучения.
Липосома, радиопротектор, лучевая болезнь, облучение, лечение
Короткий адрес: https://sciup.org/142244548
IDR: 142244548 | УДК: 665.37 | DOI: 10.31588/2413_4201_1883_1_261_200
Текст научной статьи Оценка противолучевой эффективности инкапсулированного в липосому лекарственного средства
В течение последних десятилетий актуальным остается вопрос создания инновационных препаратов, которые содержат системы направленной доставки или системы направленного транспорта лекарственных веществ, например, такие как липосомы [8, 9]. Немаловажной проблемой в области разработки и применения лекарственных веществ (ЛВ) является обеспечение локального воздействия и снижение негативного влияния на организм в целом. На современном этапе липосомы наиболее эффективно используются в медицине в качестве носителей биологически активных веществ [6, 7].
Липосомальные препараты обладают рядом преимуществ – защищают здоровые клетки от токсического действия лекарственных веществ, способны проявлять нацеленную специфичность за счет селективного проникновения из крови в ткани, защищают лекарственные вещества от деградации; изменяют фармакокинетику лекарственных препаратов, повышая их фармакологическую эффективность, позволяют создавать водорастворимые лекарственные формы для гидрофобных субстанций, увеличивая тем самым их биодоступность [4, 5].
Профилактика и лечение острой лучевой болезни животных являются одним из ведущих направлений развития и совершенствования противолучевых препаратов. Организм человека и животных не содержит специфические рецепторы для осязания ионизирующих излучений, но в свою очередь, гамма-кванты отвечают ионизацией молекул биологических структур и водных сред. В результате образования свободных радикалов происходит вторичное повреждение биологических структур. Главная опасность для организма – это образование свободных радикалов, которые поражают клетки и структуры организма. Поэтому основной защитой организма при лучевой болезни заключается в нейтрализации свободных радикалов и восстановлении поврежденных структур – клеток мишеней [1, 2, 3]. Для этого разработаны и разрабатываются радиозащитные препараты различного механизма действия. Наиболее эффективно использование таких средств в липосомальной форме. С учетом актуальности проблемы, сотрудниками ФГБНУ «ФЦТРБ-ВНИВИ» разработана технология получения инкапсулированного в липосому радиотерапевтического средства, которое будет являться перспективным средством доставки биологически активных соединений в места локализации продуктов радиолиза в органах и тканях, подвергнутых действию ионизирующего излучения.
Материал и методы исследований. Исследования проведены в отделении радиобиологии ФГБНУ
«ФЦТРБ-ВНИВИ» (г. Казань). В работе использованы фосфолипиды, полученные из материалов животного (яичный лецитин) происхождения. Липосомы получали методом гидратации липидной пленки. Формирование однослойных липосом осуществляли путем обработки ультразвуком на установке УЗДН. Для стерилизации липосомальной дисперсии использовали метод радиационной обработки на гамма-установке «Пума» с источником ионизирующего излучения Cs137. Для получения стабильных форм липосом проводили лиофилизацию на установке лиофильной сушки «Лозанна» согласно стандартно установленным параметрам. В качестве тестируемого материала использовали экспериментально полученный образец инкапсулированного
Животных 1 группы облучали на гамме-установке «Пума» в летальной дозе 7,7 Гр (ЛД 100/30) при мощности поглощённой дозы 2,87 Гр/ч, они служили группой биологического контроля облучения. Животных второй группы также, как и животных первой группы подвергали облучению в летальной дозе 7,7 Гр и через 24 ч в качестве радиозащитного средства подкожно однократно вводили созданный липосомальный препарат в объеме 0,1 мл животное. 3 группа облучению и лечению не подвергалась, она служила биологическим контролем. За животными в динамике (30 сут) вели наблюдение, изучая клинику ОЛБ, регистрируя павших и выживших животных на фоне применения испытуемого препарата. В качестве критерия оценки эффективности в липосому противолучевого средства.
В качестве биологической модели использовали 30 белых мышей массой от 18 до 20 г, которые были разделены на 3
препарата использовали
на
начальном
этапе
выживаемость животных,
которую выражали в виде процента выживаемости (ПВ %).
животных в каждой.
группы по 10
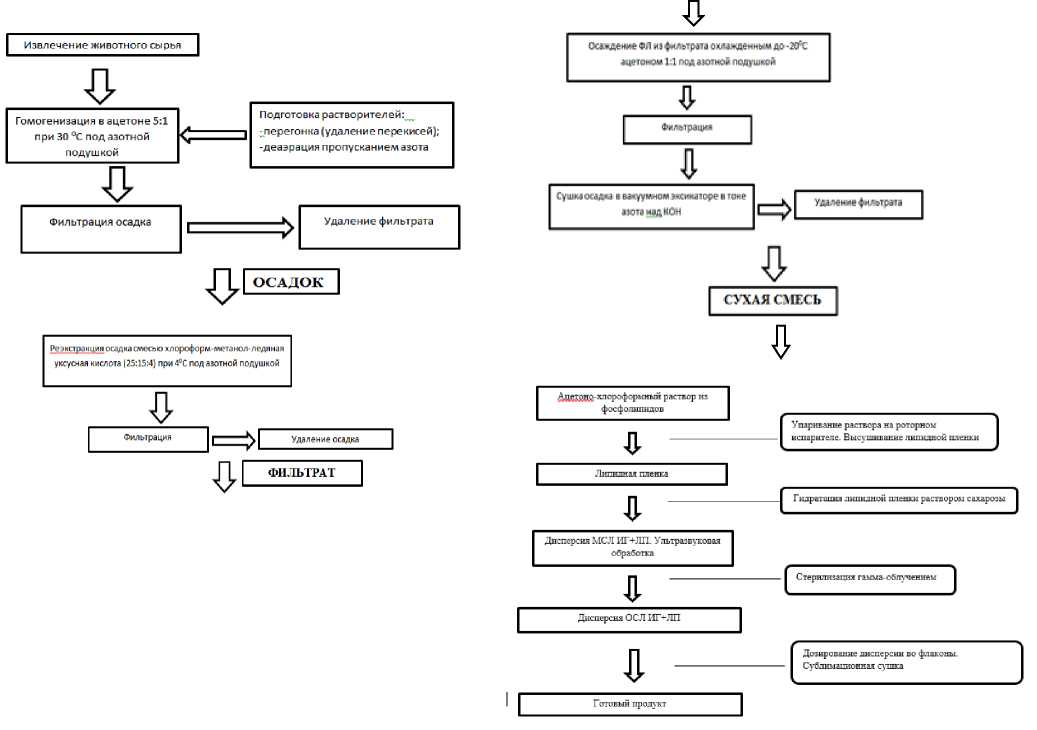
Рисунок 1 – Технологическая схема получения конъюгированного с липосомой радиозащитного препарата
Полученные в ходе экспериментов результаты подвергали статистической обработке с целью установления достоверности выявленных различий в программе Microsoft Exсel.
Результат исследований. Конструирование конъюгированного с липосомой радиозащитного средства осуществляли по схеме (Рисунок 1).
В результате проведенных исследований удалось получить модельные фосфолипиды способом, преимущества которого состоят, во-первых, в том, что гомогенизация с ацетоном и при незначительно повышенной температуре позволяет провести однократную экстракцию фосфолипидов (ФЛ) из яичного лецитина с одновременным обезвоживанием и очисткой ФЛ от не липидных примесей; во – вторых, полученная экспериментальным путем смесь хлороформа с метанолом и ледяной уксусной кислотой 25:15:4 при пониженной температуре и интенсивном перемешивании значительно снижает время экстракции ФЛ и повышает их выход; в-третьих, выделение ФЛ из полученного экстракта путем осаждения их осажденным ацетоном обеспечивает получение сбалансированного эквимолярного состава комплекса ФЛ, в – четвертых, применение перегнанных растворителей и тока азота в процессе экстракции уменьшает вероятность окисления выделяемых ФЛ и повышает их выход до 6,0 (2,85 %).
С целью дальнейшего получения липосом, смесь фосфолипидов (ФЛ) в количестве 3 г растворяли в 300 мл смеси эфира с хлороформом в соотношении 2:1 (хлороформ 100: эфир 200), вносили в круглодонную колбу объёмом 100 см3 0,01 М фосфатно-солевого буфера рН 7,4. Добавляли лечебную иммунотропную субстанцию соотношении 1:1. После обрабатывали ультразвуком частотой 22 кГц мощностью 500 Вт (УЗДН- 2т) в течение 3 мин дважды. Образовалась эмульсия типа «вода в масле», которую пропускали через роторный испаритель при вращении колбы, постепенно понижали давление, чтобы не происходило кипения органического растворителя. Об окончании выпаривания судили по образованию геля в колбе и исчезновению запаха органического вещества. Колбу снимали с испарителя, к образовавшему гелю добавляли 500 мл 0,01 М фосфатносолевого буфера и встряхивали до образования гомогенной суспензии.
После корректировки рН (7,4) раствора, смесь выдерживали 2 ч при постоянном встряхивании при температуре от 18оС до 24 оС, затем диализовали против солевого буфера, (рН 7,4) при температуре 4 оС в течение 1 сут с 2-3-кратной сменой буфера. Полученный указанным способом конечный продукт испытывали на противолучевую защитную эффективность при введении лабораторным животным. Результаты исследований представлены (Таблица 1).
Таблица 1 – Радиозащитная активность липосомального препарата на летально облученных животных после введения через 24 ч после облучения
|
№ груп пы |
Условия проведения |
Количество животных |
Результаты опытов |
||
|
П |
В |
ПВ % |
|||
|
1 |
Биологический контроль облучения (7,7 Гр) |
10 |
10 |
0 |
0 |
|
2 |
Облучение в дозе 7,7 Гр и лечение липосомальным препаратом |
10 |
4 |
6 |
60 |
|
3 |
Биологический контроль (без облучения лечения) |
10 |
0 |
10 |
100 |
Из данных таблицы видно, что испытуемый липосомальный препарат обладал достаточно высокой радиозащитной способностью, обеспечивая 60 %-ную выживаемость летально облученных животных.
Заключение. В результате проведенных исследований разработана технологическая схема получения липосомального препарата. При этом установлена целесообразность и перспективность его применения для лечения острых радиационных поражении. Оценивая результаты исследований групп животных, подвергнутых облучению в дозе 7,7 Гр и лечению, экспериментальным липосомальным препаратом необходимо отметить, что испытуемый образец показал положительную динамику в сохранении 60 % облученных в летальной дозе лабораторных животных на протяжении 30 сут исследований. Данные биологических экспериментов указывают на перспективность проведения дальнейших исследований с целью создания высокоэффективных отечественных липосомальных препаратов для профилактики и лечения острой лучевой болезни животных, как одного из ведущих направлений в развитии и совершенствовании противолучевых препаратов.
Список литературы Оценка противолучевой эффективности инкапсулированного в липосому лекарственного средства
- Гайнуллин, Р. Р. Теоретические аспекты создания синтетического аналога лучевого антигена// Актуальные проблемы ветеринарной радиобиологии, агроэкологии и радиационных технологий в АПК. - 2023.- С. 88-93. EDN: EMIXQU
- Конюхов, Г. В. Молекулярно-биологические принципы разработки противорадиационных диагностических и лечебнопрофилактических средств // Ветеринарный врач. - 2016. - №. 3. - С. 39. EDN: WBEDTP
- Курбангалеев, Я. М. Определение безопасности облученной продукции по содержанию хинонов // Ученые записки Казанской государственной академии ветеринарной медицины им. Н. Э. Баумана. - 2021. - Т. 246. - № 2. - С. 122-127. EDN: FLSLPY
- Михеев, А. А. Катионные липосомы как средства доставки нуклеиновых кислот // Тонкие химические технологии. - 2020. - Т. 15. - № 1. - С. 727. EDN: EVMFWO
- Паштецкая, А. В. Формирование питательных свойств мышечной ткани у овец на фоне применения липосомальной формы антиоксидантов / А. В. Паштецкая, П. С. Остапчук, С. А. Емельянов // Современное состояние, проблемы и перспективы развития аграрной науки. - 2020. - С. 290291. EDN: FLCAON
- Поздеев, А. В. Методика получения липосомальных систем доставки лекарственных веществ в организм животных // Ветеринарный врач. - 2021. - № 3. - С. 33-39. EDN: TZDGHB
- Плотникова, Э. М. Изучение морфологических изменений в организме белых мышей после введения липосом // В сборнике материалов Третьей Международной научно-практической конференции, посвященной 95-летию со дня рождения профессора В. А. Киршина "Современные проблемы ветеринарной радиобиологии, агроэкологии и радиационных технологий в АПК", 12 октября 2023 г. - Казань, 2023. - С. 217220. EDN: GKXUTF
- Плотникова, Э. М. Современные проблемы технологии получения фосфолипидов (обзор) // Вестник Марийского государственного университета. Серия "Сельскохозяйственные науки. Экономические науки". - 2023. - Т. 9. - № 2. - С. 168 - 177. EDN: LPZWHD
- Lombardo, D. Methods for obtaining liposomes: formation and control factors of universal nanocarriers for biomedical and nanomedical applications / D. Lombardo, M. A. Kiselev. // Pharmaceutics. - 2022. - T. 14. - No. 3. - P. 543. EDN: SMLAPL


