Оценка противоопухолевой активности локальной внутрибрюшинной гипертермии на модели распространенной High-Grade карциномы яичника у крыс
Автор: Муразов Ярослав Геннадьевич, Семенов Александр Леонидович, Сенчик Константин Юрьевич, Нюганен Анна Олеговна, Артемьева Анна Сергеевна, Беляев Алексей Михайлович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.20, 2021 года.
Бесплатный доступ
Проведены разведочная оценка противоопухолевой активности гипертермической интраперитонеальной перфузии (ГИПП) с 0,9 % раствором натрия хлорида и сравнение ее с эффектами однократного нормотермического внутрибрюшинного (в/б) введения цисплатина в максимально переносимой дозе (МПД). Тридцать шесть половозрелых крыс-самок Wistar с трансплантированной в/б сингенной карциномой яичника были рандомизированы в три группы: контрольная (в/б инъекция 2 мл 0,9 % раствора натрия хлорида при комнатной температуре, n=12); группа цисплатина (в/б инъекция цисплатина 4 мг/кг при комнатной температуре, n=12); группа ГИПП (открытая в/б перфузия с 0,9 % раствором натрия хлорида при температуре 40,5-41,5 °C в течение 45 мин, n=12). Первичной конечной точкой была оценка общей выживаемости (ОВ) животных в каждой из трех групп. На аутопсии павших животных оценивали общий индекс перитонеального канцероматоза (ИПК), массу и степень геморрагии асцита. Медиана ОВ в контрольной группе, ГИПП и цисплатина составила 19, 39 и 40 дней соответственно (логранговый тест p
Карцинома яичника, перитонеальный канцероматоз, внутрибрюшинная химиотерапия, hipec, цисплатин, доклинические исследования
Короткий адрес: https://sciup.org/140261355
IDR: 140261355 | УДК: 618.11-006.6-085:616.38 | DOI: 10.21294/1814-4861-2021-20-6-78-87
Текст научной статьи Оценка противоопухолевой активности локальной внутрибрюшинной гипертермии на модели распространенной High-Grade карциномы яичника у крыс
Несмотря на успехи в хирургическом и лекарственном лечении рака яичника, смертность от этого злокачественного новообразования остается высокой [1]. Эпителиальный рак яичника (ЭРЯ) является основным гистологическим типом. Серозная карцинома высокой степени злокачественности (СКВСЗ) – основной подтип ЭРЯ, на долю которого приходится до 90 % случаев смерти [2]. Из-за отсутствия специфических клинических симптомов около 80 % случаев ЭРЯ диагностируются на стадии распространенного процесса. Внутрибрюшинная диссеминация является превалирующим вариантом метастазирования ЭРЯ [3]. У больных ЭРЯ и перитонеальным канцероматозом (ПК) 5-летняя общая выживаемость (ОВ) не превышает 25–29 % [4]. Применение системной химиотерапии (ХТ) позволяет добиться высокой частоты опухолевого ответа, однако рецидивы распространенного ЭРЯ возникают примерно в 75 % [3].
Перитонеальный канцероматоз следует рассматривать как локальное заболевание, требующее особых подходов к лечению. Внутрибрюшинное распространение, характерное как для первичного ЭРЯ, так и для его рецидивов, стало поводом для широкого изучения локальной ХТ. Внутрибрюшинная химиотерапия (ВБХТ) направлена против микроскопических опухолевых очагов, невидимых для глаза хирурга, оставшихся после выполнения оптимального циторедуктивного вмешательства. Введение противоопухолевых препаратов в брюшную полость может осуществляться несколькими способами: 1) адъювантная нормотермическая ВБХТ через перитонеальную порт-систему после циторедуктивных вмешательств; 2) периоперационная перфузия брюшной полости нагретым до определенной температуры (40,5–43 ℃)
раствором-носителем, содержащим противоопухолевый препарат (гипертермическая интраперитонеальная химиотерапия, HIPEC). Известную неопределенность в оценке эффективности, безопасности и целесообразности проведения HIPEC и нормотермической ВБХТ при ПК у пациентов с ЭРЯ вносит отсутствие прямых проспективных сравнительных исследований этих локальных методов лечения. Так, крупное хорошо спланированное исследование III фазы van Driel W.J. et al. [5] подвергается критике из-за отсутствия сравнения HIPEC с нормотермической ВБХТ.
Следует отметить, что гипертермия не только повышает противоопухолевую активность цитостатиков, но и сама обладает противоопухолевой активностью. Гипертермия для лечения злокачественных новообразований стала применяться с конца XIX в. В работах Coley, Byrne, Gottschalk, Mayo, Percy и др. описаны случаи применения локальной гипертермии для лечения различных видов опухолей [6]. Важной задачей в изучении гипертермических перфузионных технологий является получение современных данных о противоопухолевой активности и механизмах действия самой гипертермии в отношении ПК при распространенных опухолях яичника. В представленном исследовании мы изучили противоопухолевую активность открытой ГИПП (40,5–41,5℃) с 0,9 % раствором натрия хлорида и сравнили ее с эффектами однократного нормотермического в/б введения цисплатина в МПД (4 мг/кг) у крыс-самок Wistar с трансплантированной сингенной карциномой яичника.
Цель исследования – оценка противоопухолевой активности гипертермической интраперитонеальной перфузии (ГИПП) с 0,9 % раствором натрия.

Рис. 1. Аппаратурнотехническое оснащение для экспериментальной ГИПП. Примечание: 1 – набор магистралей и переходников; 2 – резервуар-приемник для перфузата; 3 – роликовый перфузионный насос;
4 – термостатируемая водяная баня; 5 – ветеринарный наркозный испаритель Fig. 1. Hardware and technical equipment for the experimental HIPEP.
Note: 1 – a set of tubes and adapters; 2 – reservoir for perfusate; 3 – perfusion roller pump;
-
4 – thermostatic water bath;
-
5 – veterinary anesthetic vaporizer
Материал и методы
Дизайн эксперимента. День перевивки опухолевого штамма был принят за день 0. Все экспериментальные воздействия проводили через 48 ч после трансплантации опухолевого штамма. Животные были рандомизированы в три группы: ОЯ контроль в/б (n=12) – однократно в/б вводили 2 мл стерильного 0,9 % раствора натрия хлорида; ОЯ цисплатин в/б (n=12) – однократно в/б вводили цисплатин (Pharmachemie, Haarlem, Netherlands) в МПД (4 мг/кг); ОЯ ГИПП (n=12) – открытая ГИПП со стерильным 0,9 % раствором натрия хлорида.
Штамм сингенной карциномы яичника (штамм ОЯ) был получен в результате трансплацентарного канцерогенеза высоких доз 7,12-диметилбензан-трацена (ДМБА) [7]. Исходный гистологический тип опухоли – метастазирующая папиллярная аденокарцинома, в настоящее время – асцитная опухоль. Штамм поддерживается на крысах-самках Wistar. На 7–9-й день после внутрибрюшинной перевивки осуществляли забор асцита и трансплантировали экспериментальным животным по 1×107 клеток в 0,5 мл стерильного 0,9 % раствора натрия хлорида в/б на крысу.
Уход и все манипуляции с животными выполнялись в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS N 123) и Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС о защите животных, использующихся для научных целей. Протокол был одобрен локальным этическим коми- тетом ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. Эксперимент был проведен на 36 половозрелых аутбредных крысах-самках Wistar разводки ФГУП «Питомник лабораторных животных «Рапполово» (Ленинградская область, Россия) с медианой начальной массы тела 295 г (мин-макс 270–385 г). Животные содержались в конвенциональном виварии в полипропиленовых клетках при температуре воздуха 20–24 °C, относительной влажности 50–60 % с 12-часовым циклом светлого/темного времени суток. Крысы получали полнорационный брикетированный комбикорм производства компании «Лабораторкорм» (Москва, Россия) и водопроводную питьевую воду без ограничений.
Экспериментальная установка для ГИПП состояла из роликового перфузионного насоса, термостатируемой водяной бани, резервуара для перфузата, одной приносящей и одной выносящей магистралей, полипропиленовых трубок диаметром 4 мм и переходников для сборки перфузионного контура (рис. 1). Объем перфузата 210 мл, скорость потока перфузата 30 мл/мин, температура в брюшной полости 40,5–41,5 ℃, температура водяной бани 47 ℃, время перфузии 45 мин. Для равномерного распределения тепла приносящую магистраль устанавливали слева в поддиафрагмальном пространстве, выносящую – в нижней части правого латерального кармана (рис. 2).
Наблюдение за животными-реципиентами осуществляли в течение всего периода жизни. Первичной конечной точкой была оценка ОВ животных в каждой из трех групп. Общая выживаемость
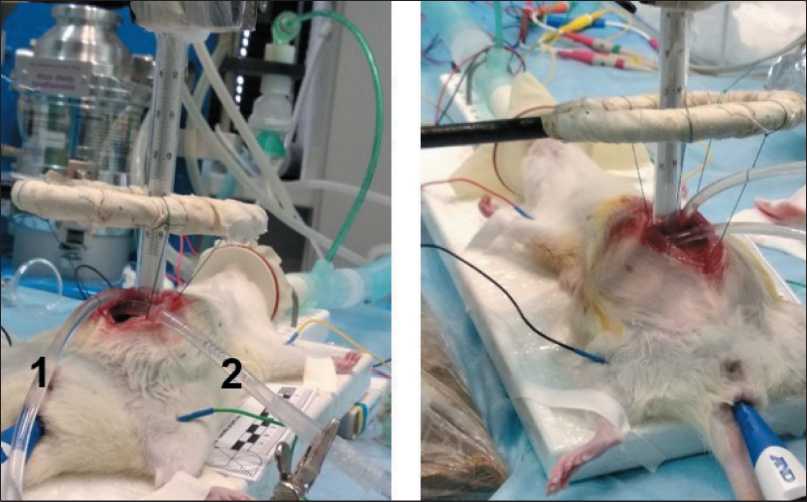
Рис. 2. Техника выполнения открытой ГИПП. Примечание: 1 – приносящая магистраль; 2 – выносящая магистраль Fig. 2. Open abdominal HIPEP technique.
Note: 1 – inflow port;
2 – outflow port
Таблица/table
Результаты определения ИПК по данным аутопсииResults of the pci calculation according to autopsy data
|
Исследуемая зона † / Studied area |
ОЯ контроль в/б (n=12)/ Ovarian tumor Control i.p. (n=12) |
ОЯ цисплатин в/б (n=12)/ Ovarian tumor cisplatin i.p. (n=12) |
ОЯ ГИПП (n=7)/ Ovarian tumor HIPЕP (n=7) |
|
Большой сальник/ The greater omentum |
3 (3–3) |
3 (0–3) |
1 (0–3) |
|
Пространство между печенью и диафрагмой/ The space between the liver and the diaphragm |
3 (0–3) |
3 (0–3) |
0 (0–3) |
|
Ворота печени/ The hepatic hilum |
3 (0–3) |
3 (0–3) |
0 (0–3) |
|
Брыжейка/Mesentery |
3 (0–3) |
2,5 (0–3) |
0 (0–3) |
|
Диафрагма/Diaphragm |
0 (0–3) |
0 (0–0) |
0 (0–3) |
|
Яичники/Ovaries |
1 (0–3) |
2 (0–3) |
0 (0–2) |
|
Париетальная брюшина/ Parietal peritoneum |
0 (0–2) |
0,5 (0–3) |
0 (0–3) |
|
Тело и рога матки с парагонадной клетчаткой/ Uterine body and horns paragonadal adipose tissue |
2,5 (0–3) |
2,5 (1–3) |
0 (0–3) |
|
Общий ИПК*a/ The total peritoneal carcinomatosis index*a |
14 (2) |
14 (2) |
5 (2)b,c |
|
Масса асцита, г†/ Ascites mass, g† |
67,4 (19,6–124,5) |
96,1 (14,5–206,2) |
24,6 (10,7–103,5) |
|
Степень геморрагии асцита†d/ The grade of hemorrhagic ascites†d |
2 (1–3) |
2 (2–2) |
3 (2–3)e,f |
Примечание: ИПК – индекс перитонеального канцероматоза; 5 крыс из группы ГИПП были исключены из подсчета ИПК; данные представлены в виде: † – медианы (мин-макс) и * – среднего (ошибка средней, SEM); a – однофакторный ANOVA тест, р=0,0136; b – множественное сравнение тестом Тюки (ОЯ ГИПП vs. ОЯ контроль в/б), adj р=0,0340; c – множественное сравнение тестом Тюки(ОЯ ГИПП vs. ОЯ цисплатин в/б), adj р=0,0185; d – тест Краскела – Уоллиса, р=0,0037; e – множественное сравнение тестом Данна(ОЯ ГИПП vs. ОЯ контроль в/б), adj р=0,0182; f – множественное сравнение тестом Данна (ОЯ ГИПП vs. ОЯ цисплатин в/б), adj р=0,0039.
Note: IPC –index of peritoneal carcinomatosis; 5 rats in the HIPЕP group were excluded from the IPC count; data are presented as † – median (min-max) and * – mean (error of the mean, SEM); a – one-way ANOVA test, p=0,0136; b – multiple comparison using the Tukey’s test (OС HIPЕP vs. OС control i.p.), adj p=0.0340; c – multiple comparison using the Tukey’s test (OС HIPЕP vs. OС cisplatin i.p.), adj h=0.0185; d – Kruskal-Wallis test, p=0.0037; e – multiple comparison using the Dunn’s test (OС HIPЕP vs. OС control i.p.), adj p=0.0182; f – multiple comparison using the Dunn’s test (OС HIPЕP vs. OС cisplatin i.p.), adj p=0.0039.
определялась как время со дня перевивки опухоли до дня гибели животного. Павших животных подвергали полной аутопсии. Оценивали ИПК по модифицированной методике, предложенной Y.L. Klaver et al. [8]. После лапаротомии брюшная полость внимательно исследовалась на предмет наличия опухолевых узлов в 8 зонах (таблица). Опухолевый рост в каждой зоне оценивали полуколичественно, где 0 баллов – нет макроскопически видимой опухоли; 1 балл – ограниченный рост опухоли (диаметр опухолевых узлов 1–2 мм); 2 балла – умеренный рост опухоли (диаметр опухолевых узлов 2–4 мм); 3 балла – выраженный рост опухоли (диаметр опухолевых узлов более 4 мм). При наличии множественных узлов в органе выбирали узел с наибольшим диаметром. Сумма баллов всех зон равнялась общему ИПК. Определяли массу асцита в брюшной полости. Степень выраженности геморрагии асцита оценивали с помощью полуколичественной визуальной шкалы, где 0 соответствовал отсутствию геморрагии; 1 – слабая степень геморрагии; 2 – умеренная степень геморрагии; 3 – выраженная степень геморрагии. Оба яичника каждой крысы, а также органы и ткани с макроскопическими признаками ПК подвергали стандартному гистологическому исследованию при световой микроскопии после окраски гематоксилином и эозином. Готовили цитологические мазки асцита и плеврального выпота с окраской по методу Паппенгейма.
Статистический анализ проводился с использованием пакета GraphPad Prism версии 8.0. Размер выборки был рассчитан на основании анализа выживаемости животных в предыдущем разведочном исследовании. Было достаточно по 12 животных в группу, чтобы отклонить нулевую гипотезу, что выживаемость в контрольной группе и группе ГИПП одинакова с мощностью (1–β) 80 % и α=0,05
[9]. Нормальность распределения проверялась на основании критерия Шапиро–Уилка и графиков квантиль-квантиль (QQ plot). Критерий Левина использовался для оценки равенства дисперсий. Однофакторный дисперсионный анализ (one-way ANOVA) с post-hoc тестом Тюки (Tukey’s test) использовался для множественных сравнений нормально распределенных количественных данных. Критерий Краскела–Уоллиса с post-hoc тестом Данна (Dunn’s test) был использован для множественных сравнений количественных данных, имевших ненормальное распределение. Все критерии были двусторонними. Различия считались статистически значимыми при р<0,05. В случае множественных сравнений приведено скорректированное значение уровня значимости (adj P). Данные по ОВ животных графически представлены в виде кривых Каплана–Мейера. Для сравнения кривых ОВ применяли логранговый критерий. При множественном сравнении ОВ в трех группах использовалась поправка Бонферрони с критическим уровнем значимости р<0,017 (0,05/3). Отношение рисков (Hazard Ratio, ОР) и границы его 95 % доверительного интервала (ДИ) рассчитывали с помощью регрессионной модели Кокса.
Результаты
Энграфтмент штамма карциномы яичника был около 100 %. Практически все животные трех групп погибли от перевитой опухоли. Лишь 1 из 12 крыс в группе ГИПП погибла от инфекционных осложнений на 32-й день после процедуры. В результате имплантационного распространения опухоли макроскопически наблюдали обширное поражение рогов и тела матки, яичников, пара-гонадной клетчатки. Большой сальник выглядел набухшим из-за опухолевой инфильтрации. Также определялись множественные узлы в брыжейке
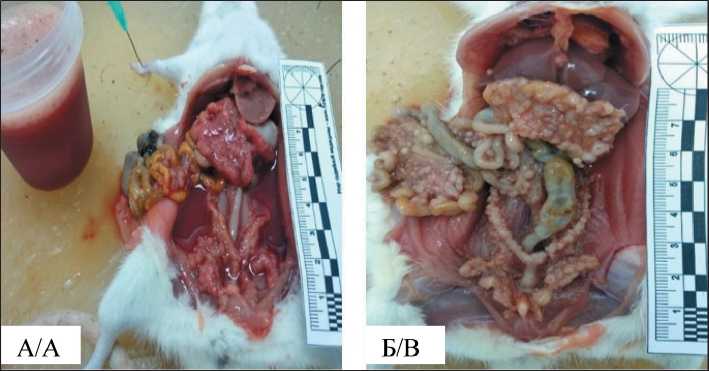
Рис. 3. Макроскопическая картина ПК у крыс с трансплантированной карциномой яичника. Примечание: А – ПК и геморрагический асцит, группа ОЯ цисплатин в/б; Б – множественные опухолевые имплантаты в брыжейке кишечника, в большом сальнике, в рогах и теле матки, в парагонадной клетчатке, асцит эвакуирован, группа ОЯ контроль в/б
Fig. 3. Macroscopic view of the PC in rats with transplanted ovarian carcinoma (OC). Note: A – PC and hemorrhagic ascites, OC cisplatin i.p. group; B – multiple tumor implants in the mesentery, in the greater omentum, in the uterine horns and the body of the uterus, in the paragonadal fat pads, ascites evacuated, OC control i.p. group
кишечника, опухолевые массы в воротах печени, узлы в куполе диафрагмы (рис. 3). Частыми находками на аутопсии были опухолевые конгломераты творожистой консистенции в различных зонах брюшной полости.
При гистологическом исследовании аутоп-сийного материала во всех образцах тканей крыс обнаруживались поля инвазивной злокачествен-
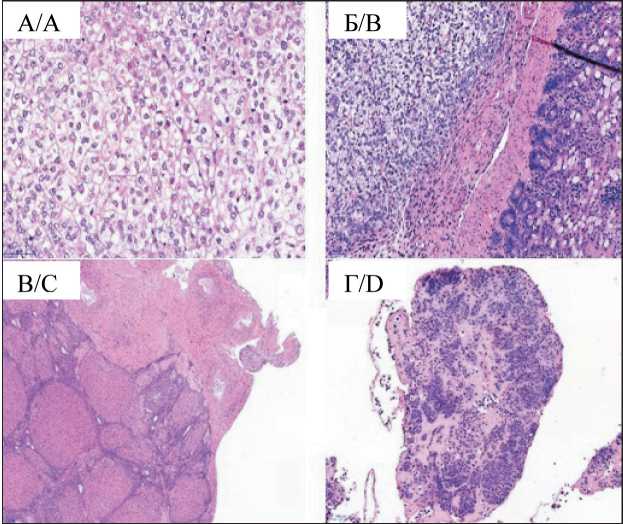
Рис. 4. Микрофото. Опухолевое поражение органов и тканей у крыс с трансплантированной карциномой яичника. Примечание: А – фокус серозной карциномы high-grade, гематок-силин/эозин, ×400; Б – опухоль в серозной оболочке стенки тонкой кишки, гематоксилин/эозин, ×200; В – субтотальное замещение опухолью ткани яичника с инвазией в капсулу, гематоксилин/эозин, ×40; Г – фрагмент большого сальника с инфильтрацией опухолью, гематоксилин/эозин, ×40
Fig. 4. Microphoto. Hhistologic images of tumor lesions of organs and tissues in rats with transplanted OC. Note: A – focus of highgrade serous carcinoma, haematoxylin and eosin, ×400;
B – tumor in the serosa of small intestine, haematoxylin and eosin, ×200; C – subtotal tumor replacement of ovarian tissue with invasion of the capsule, haematoxylin and eosin, ×40;
D – a fragment of the greater omentum with tumor infiltration, haematoxylin and eosin, ×40
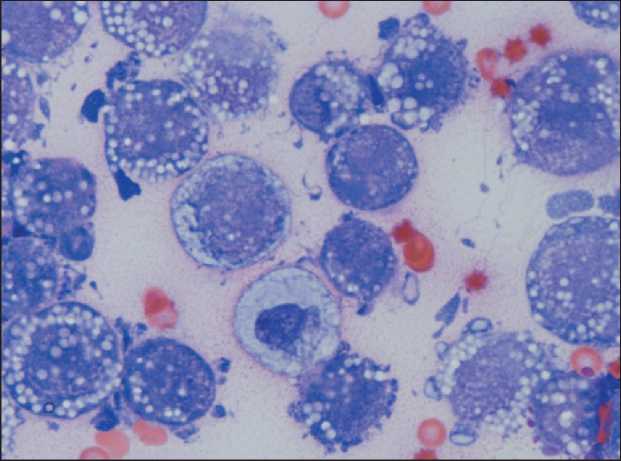
Рис. 5. Мазок асцитической жидкости. Окраска по Паппенгейму, ×1000 Fig. 5. Ascitic fluid smear, Pappenheim’s stain, ×1000
ной опухоли папиллярно-солидного строения, состоящей из округлых клеток со скудной эозинофильной или оптически пустой цитоплазмой, с крупными резко атипичными полиморфными ядрами, с высоким ядерно-цитоплазматическим соотношением. Опухоль инфильтрировала ткань большого сальника, субтотально замещала ткань яичников и распространялась на маточные трубы, матку. Аналогичные множественные фокусы опухоли были в серозной оболочке стенки кишки и брюшине диафрагмы с инвазией в мышечный слой. Данная гистологическая картина характерна для СКВСЗ (рис. 4). В мазках асцитической жидкости определялись обширные поля клеток карциномы high-grade. Клетки полиморфные, резко атипичные с крупными ядрами и ядрышками и высоким ядерно-цитоплазматическим соотношением, дискретно лежащие среди полей клеток моноцитарного ряда (рис. 5).
Интересным наблюдением в группе ГИПП было наличие на аутопсии у 3 из 12 крыс злокачественного плеврального выпота с метастатическим поражением органов грудной полости (легкие, перикард, внутригрудные лимфоузлы) без признаков внутрибрюшинной диссеминации опухоли (рис. 6). Эти животные были исключены из подсчета ИПК.
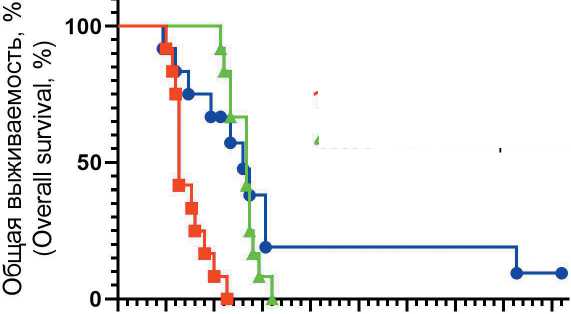
Медиана ОВ в группе ОЯ контроль в/б, ОЯ цисплатин в/б и ОЯ ГИПП составила 19, 40 и 39 дней на (рис. 7) соответственно (логранговый тест р<0,0001). Статистически значимые различия ОВ в сравнении с контролем наблюдались в группе цисплатина (ОР=0,22; 95 % ДИ 0,08–0,62; логран-говый тест р<0,0001) и в группе ГИПП (ОР=0,32; 95 % ДИ 0,13–0,82; логранговый тест р=0,0013). Значимых различий в ОВ между группами цисплатина и ГИПП не было (логранговый тест р=0,4853). В группе ГИПП 1 из 12 крыс оставалась жива на момент окончания наблюдения (138-й день).
В контрольной группе и в группе цисплатина на аутопсии наблюдалось обширное внутрибрюшинное распространение опухоли и поражение половых органов крыс-самок. В группе ГИПП общий ИПК был значимо ниже в сравнении с контрольной группой (adj р=0,0340) и группой цисплатина (adj р=0,0185). Результаты определения общего ИПК в исследуемых группах представлены в таблице. Значимых различий в массе асцита среди экспериментальных групп выявлено не было из-за большой вариабельности этого показателя. Асцитическая жидкость у животных из группы ГИПП имела более выраженную степень геморрагии. Влияние экспериментальных воздействий на динамику массы тела животных в течение эксперимента представлено на рис. 8.
Обсуждение
Многообещающей стратегией в лечении больных с ПК при опухолях различной локализации
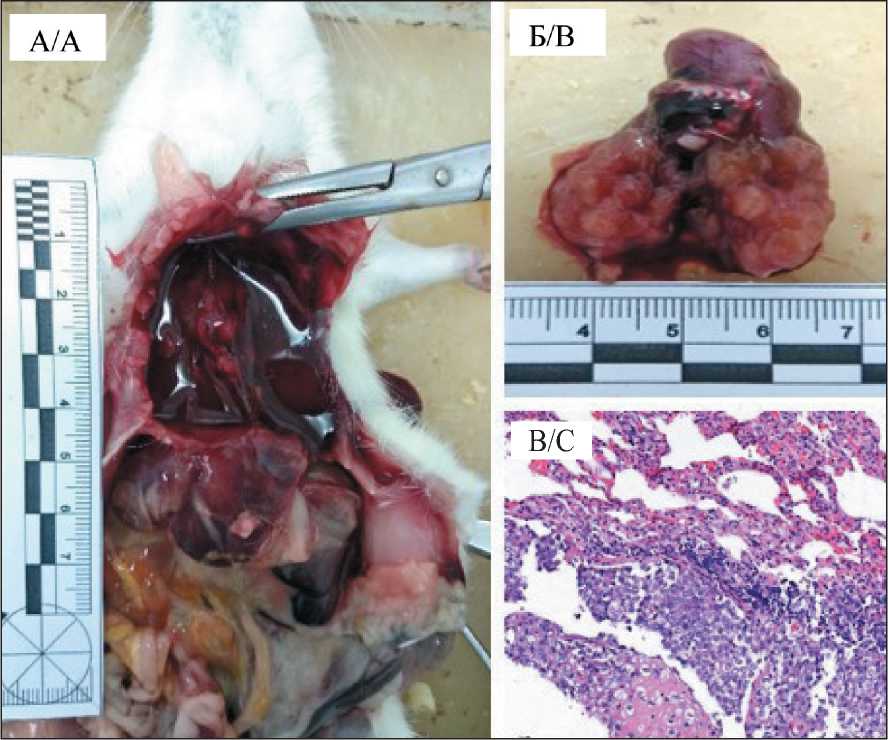
Рис. 6. Изменения в органах грудной полости у крысы из группы ОЯ ГИПП. Примечание: А – геморрагический злокачественный плевральный выпот;
Б – опухолевое поражение легких;
на рис. В/С – фокус high-grade карциномы в легком, гематоксилин/эозин, ×100 Fig. 6. Malignant lesions in the thoracic cavity in a rat from the OC HIPEP group. Note: A – hemorrhagic malignant pleural effusion;
B – pulmonary metastases;
C – focus of high-grade carcinoma in the lung, haematoxylin and eosin, ×100
Медиана OB, дни
Median OS, days
39.00 -*- ОЯ ГИПП (ОС HIPEP)
19.00 -■- ОЯ контроль в/б (ОС control IP)
40.00 -* ОЯ цисплатин в/б (ОС cisplatin IP)
0 15 30 45 60 75 90 105 120 135
Время после трансплантации, дни (Time after tumor transplantation, days)
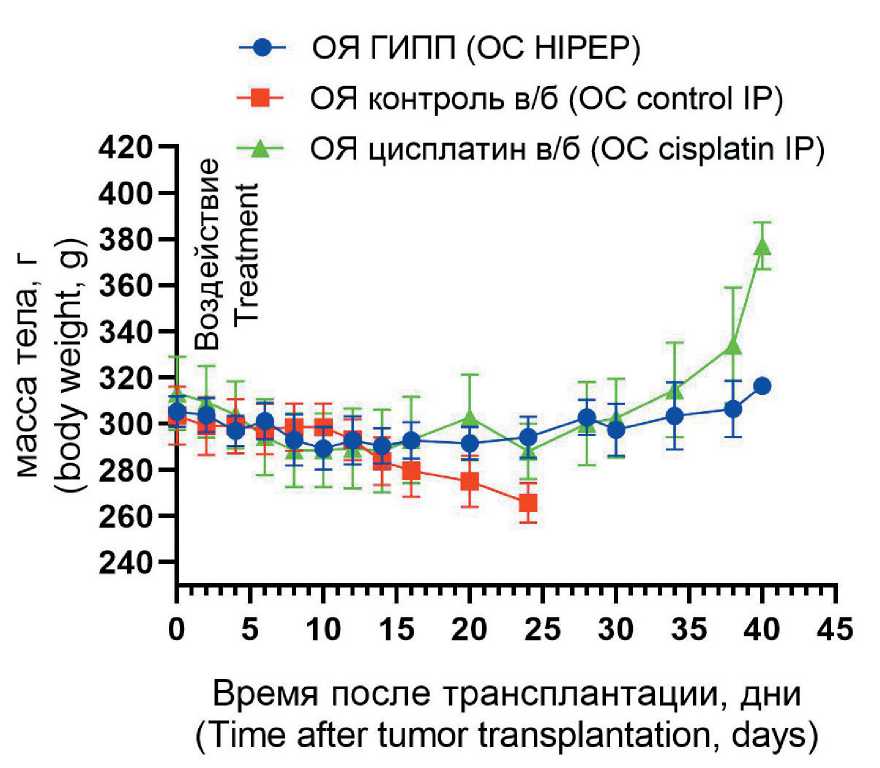
Рис. 8. Динамика массы тела животных в течение эксперимента. Данные представлены в виде среднего (ошибка среднего) минимум трех измерений Fig. 8. Course of mean body weight during study. Data points represent mean (SEM) of minimum 3 measurements
Рис. 7. Влияние экспериментальных воздействий на ОВ крыс с трансплантированной карциномой яичника (Кривые Каплана–Мейера)
Fig. 7. Effect of experimental treatment on OS in rats with transplanted OC (Kaplan– Meier curves)
является сочетание хирургического лечения и внутрибрюшинной лекарственной терапии [10]. Известный синергизм действия регионарной гипертермии и химиотерапевтических агентов стал поводом для широкого изучения и внедрения процедуры HIPEC в клиническую практику [11]. Тем не менее для первичного ЭРЯ и его рецидивов HIPEC пока остается экспериментальным методом в крупных центрах. Точный механизм противоопухолевого действия супранормальных температур до конца неизвестен. Цитотоксические эффекты гипертермии многогранны. Они обусловлены повреждением клеточных мембран, ядер, денатурацией белка и изменением проницаемости для ионов кальция. Гипертермия нарушает митотические процессы не только в опухолевых, но и в нормальных клетках. Этот процесс носит тран-зиторный характер. В опухолевых клетках после воздействия гипертермии происходит увеличение количества лизосом и активности лизосомальных ферментов. Микроциркуляция в опухолевой ткани подавляется гипертермией, что приводит к уменьшению кровотока в опухоли или полному ее стазу. В то же время в нормальных тканях, наоборот, кровоток усиливается. Эти эффекты наряду с нарушением процессов клеточного дыхания приводят к накоплению молочной кислоты и закислению микроокружения опухоли, что приводит к увеличению числа и «хрупкости» лизосом, сопровождающейся повышенной гибелью опухолевых клеток. Синтез РНК при воздействии гипертермии подавляется как в нормальных, так и в опухолевых клетках. В меньшей степени подавляется синтез ДНК и белка [6].
В нашем исследовании мы оценили изолированную противоопухолевую активность локальной гипертермии в виде открытой ГИПП и сравнили ее с эффектом нормотермической ВБХТ цисплатином в МПД. Выбранный нами штамм карциномы яичника, трансплантируемый крысам-самкам Wistar, достаточно правдоподобно воспроизводит клиническую ситуацию распространенного ЭРЯ (III–IV cтадии) у пациенток с ПК и асцитом. Выбор открытой техники выполнения ГИПП был не случаен. В сравнении с закрытым вариантом перфузии техника «колизея» позволяет добиться равномерного распределения тепла в брюшной полости, обеспечивает лучший контроль распределения перфузата, кроме того, есть постоянный легкий доступ к органам брюшной полости. При открытой перфузии отсутствуют пузыри в контуре, практически не случается «присасывание» органов к выносящей магистрали (если случается, то это легко исправляется), а риск термического повреждения органов и тканей минимален [12, 13]. По сравнению с контрольной группой открытая ГИПП с 0,9 % раствором натрия хлорида значимо увеличила ОВ крыс с распространенной карциномой яичника – с 19 до 39 дней (логранговый тест р=0,0013). Локальная гипертермия на 68 % снижала риск смерти животных с трансплантированной опухолью (ОР=0,32; 95 % ДИ 0,13–0,82). Интересен и «хвостообразный» профиль кривой Каплана–Мейера в группе ГИПП. Наличие таких «хвостов» характерно для кривых ОВ пациентов со злокачественными новообразованиями, получавших чекпоинт-ингибиторы и длительно отвечающих на иммунотерапию. Доля таких больных при монотерапии чекпоинт-ингибиторами, как правило, невелика [14]. Это наблюдение может косвенно свидетельствовать об активации компонентов противоопухолевого иммунитета у иммунокомпетентных животных на фоне гипертермии. Известно, что гипертермия при процедуре HIPEC стимулирует выработку белков теплового шока (HSPs), презентация которых на поверхности опухолевых клеток активирует противоопухолевый иммунный ответ [15]. Изучение синергизма гипертермии и противоопухолевой иммунотерапии является перспективной и быстро развивающейся областью экспериментальной и клинической онкологии [16].
По данным аутопсии павших животных общий ИПК был достоверно ниже в группе ГИПП в сравнении с контролем и нормотермической ВБХТ цисплатином в МПД (5, 14 и 14 баллов соответственно, однофакторный ANOVA тест р=0,0136). Значимых различий в массе асцита среди групп не было. Асцит у животных из группы ГИПП имел более выраженную степень геморрагии. Это, вероятно, и стало основной причиной гибели животных в группе ГИПП. Развитие у 3 из 12 животных в группе ГИПП плеврального выпота и опухолевого поражения органов грудной полости без макроскопических признаков в/б распространения опухоли, вероятно, объясняется миграцией опухолевых клеток под действием повышенного давления в брюшной полости и супранормальных температур во время процедуры ГИПП.
Заключение
Локальная гипертермия в виде открытой ГИПП с 0,9 % раствором натрия хлорида значимо увеличивает ОВ животных с распространенной сингенной карциномой яичника, оказывает выраженное терапевтическое воздействие на развитие ПК. По показателю ОВ противоопухолевая активность ГИПП сопоставима с эффектом нормотермической ВБХТ цисплатином в МПД. Разработанная технология выполнения открытой ГИПП в эксперименте и аппаратурно-техническое оснащение для перфузионного контура позволят изучить новые противоопухолевые агенты и рецептуры растворов-носителей для HIPEC, а также проводить изыскания в области комбинированного воздействия гипертермии и иммунотерапии на опухолевый рост.
Список литературы Оценка противоопухолевой активности локальной внутрибрюшинной гипертермии на модели распространенной High-Grade карциномы яичника у крыс
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [published correction appears in CA Cancer J Clin. 2020 Jul; 70(4): 313]. CA Cancer J Clin. 2018; 68(6): 394–424. doi:10.3322/caac.21492.
- Momenimovahed Z., Tiznobaik A., Taheri S., Salehiniya H. Ovarian cancer in the world: epidemiology and risk factors. Int J Womens Health. 2019 Apr; 11: 287–99. doi: 10.2147/IJWH.S197604.
- van Baal J.O.A.M., van Noorden C.J.F., Nieuwland R., Van de Vijver K.K., Sturk A., van Driel W.J., Kenter G.G., Lok C.A.R. Development of Peritoneal Carcinomatosis in Epithelial Ovarian Cancer: A Review. J Histochem Cytochem. 2018 Feb; 66(2): 67–83. doi: 10.1369/0022155417742897.
- Helderman R.F.C.P.A., Löke D.R., Kok H.P., Oei A.L., Tanis P.J., Franken N.A.P.K., Crezee J. Variation in Clinical Application of Hyperthermic Intraperitoneal Chemotherapy: A Review. Cancers (Basel). 2019 Jan; 11(1): 78. doi: 10.3390/cancers11010078.
- van Driel W.J., Koole S.N., Sikorska K., Schagen van Leeuwen J.H., Schreuder H.W.R., Hermans R.H.M., de Hingh I.H.J.T., van der Velden J., Arts H.J., Massuger L.F.A.G., Aalbers A.G.J., Verwaal V.J., Kieffer J.M., Van de Vijver K.K., van Tinteren H., Aaronson N.K., Sonke G.S. Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer. N Engl J Med. 2018 Jan; 378(3): 230–40. doi: 10.1056/NEJMoa1708618.
- Sticca R.P., Dach B.W. Rationale for hyperthermia with intraoperative intraperitoneal chemotherapy agents. Surg Oncol Clin N Am. 2003 Jul; 12(3): 689–701. doi: 10.1016/s1055-3207(03)00029-2.
- Погосянц Е.Е., Пригожина Е.Л., Еголина Н.А. Перевиваемая асцитная опухоль яичника крысы (штамм ОЯ). Вопросы онкологии. 1962; 8(11): 29–36. [Pogosiants E.E., Prigozhina E.L., Egolina N.A. Transplantable ascitic ovary tumour of the rat. Problems in Oncology. 1962; 8: 29–36. (in Russian)].
- Klaver Y.L., Hendriks T., Lomme R.M., Rutten H.J., Bleichrodt R.P., de Hingh I.H. Intraoperative hyperthermic intraperitoneal chemotherapy after cytoreductive surgery for peritoneal carcinomatosis in an experimental model. Br J Surg. 2010 Dec; 97(12): 1874–80. doi: 10.1002/bjs.7249.
- Schoenfeld D.A., Richter J.R. Nomograms for calculating the number of patients needed for a clinical trial with survival as an endpoint. Biometrics. 1982 Mar; 38(1): 163–70.
- Goodman M.D., McPartland S., Detelich D., Saif M.W. Chemotherapy for intraperitoneal use: a review of hyperthermic intraperitoneal chemotherapy and early post-operative intraperitoneal chemotherapy. J Gastrointest Oncol. 2016 Feb; 7(1): 45–57. doi: 10.3978/j.issn.2078-6891.2015.111.
- Sugarbaker P.H., Graves T., DeBruijn E.A., Cunliffe W.J., Mullins R.E., Hull W.E., Oliff L., Schlag P. Early postoperative intraperitoneal chemotherapy as an adjuvant therapy to surgery for peritoneal carcinomatosis from gastrointestinal cancer: pharmacological studies. Cancer Res. 1990 Sep; 50(18): 5790–4.
- González-Moreno S., González-Bayón L.A., Ortega-Pérez G. Hyperthermic intraperitoneal chemotherapy: Rationale and technique. World J Gastrointest Oncol. 2010 Feb; 2(2): 68–75. doi: 10.4251/wjgo.v2.i2.68.
- McCabe-Lankford E., Peterson M., McCarthy B., Brown A.J., Terry B., Galarza-Paez L., Levi-Polyachenko N. Murine Models of Intraperitoneal Perfusion for Disseminated Colorectal Cancer. J Surg Res. 2019 Jan; 233: 310-322. doi: 10.1016/j.jss.2018.07.063.
- Harris S.J., Brown J., Lopez J., Yap T.A. Immuno-oncology combinations: raising the tail of the survival curve. Cancer Biol Med. 2016 Jun; 13(2): 171–93. doi: 10.20892/j.issn.2095-3941.2016.0015.
- Zunino B., Rubio-Patiño C., Villa E., Meynet O., Proics E., Cornille A., Pommier S., Mondragón L., Chiche J., Bereder J.M., Carles M., Ricci J.E. Hyperthermic intraperitoneal chemotherapy leads to an anticancer immune response via exposure of cell surface heat shock protein 90. Oncogene. 2016 Jan; 35(2): 261–8. doi: 10.1038/onc.2015.82.
- Skitzki J.J., Repasky E.A., Evans S.S. Hyperthermia as an immunotherapy strategy for cancer. Curr Opin Investig Drugs. 2009 Jun; 10(6): 550–8.


