Оценка противоопухолевых, токсических эффектов и характера экспрессии генов-мишеней MIR-204-5P при применении ее имитатора на модели меланомы В-16 in vivo
Автор: Лапкина Е.З., Палкина Н.В., Аверчук А.С., Есимбекова А.Р., Рукша Т.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Цель исследования - оценка влияния имитатора miR-204-5p на рост меланомы В-16 in vivo при внутрибрюшинном трехкратном его введении, определение изменения при этом экспрессии генов-мишеней miR-204-5p в опухоли и дистантных органах, а также выраженности токсических реакций. Материал и методы. Исследование проводили на мышах c57Bl/6 с подкожно перевитой меланомой B-16. Животным опытной группы внутрибрюшинно вводили имитатор микроРНК miR-204-5p (5нМоль) на 8, 10, 12-е сут после трансплантации опухолевых клеток. Согласно результатам биоинформатического анализа определяли уровень экспрессии генов-мишеней микроРНК BCL2 и SIRT1 методом ПЦР в реальном времени. Определяли токсический эффект воздействия имитатора по динамике массы тела и органов, объему опухолевого узла, изменению двигательной активности и внешнего вида животных в течение эксперимента. Результаты. Оценка внешних признаков и динамики двигательной активности животных, а также динамики их массы и массы органов при вскрытии свидетельствует об отсутствии токсического эффекта имитатора miR-204-5p. К 13-14-му дню эксперимента двигательная активность в контрольных группах животных статистически значимо снизилась по сравнению с группой животных, которым вводился имитатор miR-204-5p (р=0,011) Отмечено повышение экспрессии BCL2 в легких и почках мышей и SIRT1 - в легких мышей (p˂0,05). Отмечалась тенденция к снижению массы опухолевого узла к 14-му дню эксперимента. Заключение. Модуляция уровня микроРНК miR-204-5p приводит к изменению экспрессии генов-мишеней - SIRT1 и BCL2 в легких животных, BCL2 - в почках. Введение имитатора микроРНК не вызывает нарушений двигательной активности животных, изменения массы внутренних органов, что может свидетельствовать об отсутствии развития токсического эффекта. Дальнейшее исследование требуется для разъяснения биодоступности модуляторов микроРНК в опухолевую ткань, а также влияния имитатора miR-204-5p на пролиферацию клеток меланомы in vivo .
Меланома b-16, b16, mir-204-5p, микрорнк, гены мишени, биоинформатический анализ
Короткий адрес: https://sciup.org/140295081
IDR: 140295081 | УДК: 616.5-006.81:575.113]-092.9 | DOI: 10.21294/1814-4861-2022-21-3-61-69
Текст научной статьи Оценка противоопухолевых, токсических эффектов и характера экспрессии генов-мишеней MIR-204-5P при применении ее имитатора на модели меланомы В-16 in vivo
Меланома является злокачественным новообразованием кожи в результате неограниченной пролиферации меланоцитов. Актуальной задачей современной онкологии является поиск новых подходов в лечении данного заболевания, поскольку его диссеминированные формы трудно поддаются терапии [1, 2]. Одним из направлений при лечении меланомы кожи может быть воздействие на микроРНК. МикроРНК – малые некодирующие молекулы РНК длиной в среднем 22 нуклеотида [3]. Доказано, что микроРНК играют важную роль в регуляции эпигенетических изменений при развитии онкологических заболеваний, влияя на профиль экспрессии белков-регуляторов во время реализации биологических процессов. Таким образом, действуя как онкогены и гены-супрессоры опухолей, они могут либо способствовать, либо ингибировать развитие и формирование злокачественных новообразований [4]. Выявлено, что каждое заболевание демонстрирует уникальный профиль экспрессии микроРНК, который отличается от экспрессии в здоровой ткани. Такие дифференциальные микроРНК называются «сигнатурными» и являются диагностическими или прогностическими маркерами, которые могут быть применены для совершенствования традиционных методов диагностики заболеваний [5]. Установлена роль микроРНК в регуляции биологических процессов, таких как пролиферация, дифференцировка и апоптоз через посттранскрипционное изменение экспрессии генов. Механизм негативной регуляции микроРНК обеспечивается связыванием с 3´ неко-дируемой областью целевой мРНК, что приводит к блокировке трансляции или деградации РНК [6]. Одна микроРНК может регулировать изменение уровня экспрессии нескольких сотен генов [7]. Для модуляции уровня экспрессии микроРНК в клетке возможно использование ее имитатора – синтетического аналога. Данный подход хорошо отражен в современной литературе. В частности, показано, что повышенная экспрессия miR-30a ингибирует метастазирование in vivo за счет воздействия на ZEB2 и E-кадгерин [8]. Cверхэкспрессия miR-9 снижает рост опухоли, тогда как избыточная экспрессия гена NRP1 усиливает прогрессию злокачественной меланомы [9]. Также при злокачественной меланоме обнаружена онкосупрессорная роль miR-18b и miR-33a посредством прямого воздействия на HIF-1α [10, 11]. В экспериментах in vivo установлено, что miR-21 регулирует метастазирование клеток меланомы B-16, способствуя пролиферации, выживанию и миграции/инвазии клеток [12].
Ранее нами было показано, что уровень микроРНК miR-204-5p в клетках меланомы уменьшается по сравнению с меланоцитарными невусами, а восстановление его уровня приводит к изменению пролиферативной активности опухолевых клеток [13].
На основе биоинформатического анализа было установлено 235 генов-мишеней miR-204-5p, участвующих в 32 биологических процессах. SIRT1 регулирует процессы апоптоза, адгезию и межклеточное взаимодействие. Проведение нокдауна гена SIRT1 микроРНК в клетках меланомы линии BRO приводило к изменению их пролиферативной активности [14]. BCL2 кодирует регулятор апоптоза с антиапоптическими функциями, повышенный уровень экспрессии BCL2 является прогностическим маркером метастазирования меланомы кожи [15]. Впервые в настоящем исследовании проведена оценка токсического и противоопухолевого эффектов имитатора miR-204-5p на модели меланомы В-16 у мышей, а также исследовано его влияние на уровень экспрессии целевых генов SIRT1 и BCL2 в опухоли и внутренних органах животных.
Цель исследования – оценка влияния имитатора miR-204-5p на рост меланомы В-16 in vivo при внутрибрюшинном трехкратном его введении, определение изменения при этом экспрессии генов-мишеней miR-204-5p в опухоли и дистантных органах, выраженности токсических реакций.
Материал и методы
Исследование одобрено локальным этическим комитетом Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого (протокол № 3 от 22.04.2021). Манипуляции с животными осуществляли в соответствии с правилами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki 1964, 2008 ред.), а также в «Международных рекомендациях по проведению медико-биологических исследований с использованием лабораторных животных» и приказе Министерства здравоохранения РФ от 01.04.2016 № 199 н. «Об утверждении Правил надлежащей лабораторной практики».
Эксперимент выполнен на половозрелых мышах-самках линии С57Bl/6 в возрасте 7–8 нед со средней массой тела 16,5 г, полученных из Федерального государственного унитарного предприятия «Питомник лабораторных животных «РАППОЛОВО» национального исследовательского центра «Курчатовский институт» (НИЦ «Курчатовский институт» – «ПЛЖ «Рапполово»). Животных содержали в клетках при естественном освещении с неограниченным доступом к корму и воде, температуру воздуха в помещении поддерживали на уровне 20–22 ºС. Клетки меланомы B-16 были предоставлены Научно-исследовательским институтом фундаментальной и клинической иммунологии (г. Новосибирск). Опухоль перевивали по общепринятым методам мышам подкожно в боковую поверхность живота 10 % взвесью диссоциированных клеток в 1 мл раствора Хенкса без фенолового красного [16].
Все животные были разделены на 3 группы случайным образом. Животным контрольной группы (n=4) на 8, 10, 12-е сут после трансплантации опухолевых клеток внутрибрюшинно вводили раствор фосфатно-солевого буфера (VWR Radnor, USA) объемом 250 мкл. Количество животных в каждой группе определялось исходя из этических принципов организации исследований с использованием позвоночных животных, экономической доступности выбранного метода воздействия. В эксперименте применяли этический принцип 3Rs («replace», «reduce», «refine») для минимизации количества животных и получения статистически достоверных результатов [17, 18].
В группе отрицательного контроля (n=4) применялся негативный контроль имитатора (mirvana™mirnaMimic NegativeControl#1, Ambion, Carlsbad, USA). Вещество вводили внутрибрюшинно в дозировке 5 нМоль в 250 мкл буферного раствора трижды на 8, 10, 12-е сут после трансплантации опухолевых клеток. Животным опытной группы (n=4) вводился синтетический аналог (имитатор) miR-204-5p (mirVana® miR-204-5p mimic, Ambion, Carlsbad, USA) в дозировке 5 нМоль трижды на 8, 10, 12-е сут после трансплантации клеток меланомы. В качестве растворителя использовали Invivofectamine® 3.0 Reagent (Invitrogen, Carlsbad, USA). Инвивофектамин является трансфецирующим реагентом для создания катионных комплексов с имитаторами микроРНК. Использование трансфектанта обусловлено низкой эффективностью доставки нуклеиновых кислот в клетки-мишени и условий для их длительного функционирования [19]. Выбор метода доставки может иметь существенное влияние на модуляцию последующих молекулярных мишеней и, в конечном итоге, на терапевтические результаты. Оптимизированная доставка также предлагает другие практические преимущества, такие как уменьшение количества используемого имитатора. По данным литературы, тканевое распределение имитатора микроРНК при внутрибрюшинном введении сопоставимо по уровню с внутривенным [20]. Для взаимодействия с отрицательно заряженными компонентами мембраны клетки формируются липокомплексы нуклеиновых кислот в небольшом избытке катионного носителя. В нашем исследовании комплекс имитатор микроРНК-инвивофектамин для разовой дозы получали путем объединения 5 нМоль имитатора микроРНК с равным количеством буфера для образования комплекса инвивофектамина с последующим добавлением 12,5 мкл инвивофектамина. Полученную смесь перемешивали, затем инкубировали при 50 °C в течение 30 мин. Полученный объем комплекса инвивофектамина с действующим веществом доводили раствором фосфатно-солевого буфера (VWR Radnor, USA) до 250 мкл.
Для оценки динамики роста опухоли, начиная с 7-х сут после трансплантации клеток меланомы, проводили ежедневные линейные замеры опухоли в двух взаимно перпендикулярных направлениях. Объем опухоли рассчитывали по формуле
V = (A×(B)2)/2, где А – больший, а В – меньший линейный размер узла.
Оценивалась масса тела мышей. Животных взвешивали каждые сутки в течение 14 дней после трансплантации клеток меланомы В-16. Анализ внешних признаков проводили ежедневно путем балльной оценки изменения окраса шерсти и волосяного покрова: 1 балл – шерстяной покров тусклый; 2 балла – яркий; изменения двигательной активности: 5 баллов – активное передвижение животного по клетке, выраженные избегательно-оборонительные реакции; 4 балла – медленные активные движения по клетке, избегательно-оборонительные реакции с попытками укусов; 3 балла – реакция на раздражение избегательная, спонтанная двигательная активность угнетена, стимулированная сохранена, животное передвигается на несколько шагов только при подталкивании; 2 балла – реакция на тактильные раздражители угнетена, минимальная стимулированная двигательная активность животного; 1 балл – кома, отсутствие спонтанной и стимулированной двигательной активности; 0 баллов – животное пало.
Животных после эвтаназии визуально осматривали. При вскрытии животных проводили оценку внутренних органов: цвета, формы, консистенции. Определяли массу внутренних органов и опухолевого узла. Вывод из эксперимента осуществляли на 14-е сут путем декапитации под эфирным наркозом. После вскрытия фрагменты органов (легкие, печень, почки) и опухолевый узел консервировали в жидком азоте, используя фиксатор IntactRNA (Евроген, Москва, Россия).
Выделение РНК осуществляли в ламинарном боксе, соблюдая правила асептики и антисептики. Из образцов тканей с помощью набора DiaGen 3317.0050 (ДиаЭм, Москва, Россия), согласно протоколу производителя получали 100 мкл РНК. Реакцию обратной транскрипции проводили с использованием набора реактивов MMLVRTkit (Евроген, Москва, РФ). Другую часть органов фиксировали в 10 % забуференном формалине с последующей заливкой в парафин.
Для определения уровня экспрессии исследуемых генов SIRT1 и BCL2 был произведен анализ ПЦР в реальном времени на приборе StepOneTMReal-TimePCR-System (AppliedBiosystems, Singapore).
Нормализацию результатов осуществляли одновременно по двум эндогенным контролям – ACTB и GABGH (AppliedBiosystems, USA).
Определяли величину Ct, соответствующую количеству циклов, при которых кривая флюоресценции пересекала заданный уровень фона. Каждый эксперимент выполняли в двух технологических повторах с дальнейшим расчетом среднего значения. Относительные уровни экспрессии генов для исследуемых образцов рассчитывали по формуле: 2–ΔCT, где ΔCT=CT исследуемого мар- кера – CT эндогенного контроля. Общий относительный уровень экспрессии по двум эндогенным контролям рассчитывали как квадратный корень от произведения уровней экспрессии по каждому эндогенному контролю.
Статистическая обработка и анализ данных осуществляли с помощью пакета программного обеспечения Statistica 7 (StatSoft, Россия). При сравнении парных независимых выборок использовали непараметрический критерий U-тест Манна–Уитни. Межгрупповые сравнения проводили с помощью непараметрического дисперсионного анализа Краскела–Уолеса, при p˂0,05 результаты считали статистически значимыми.
Результаты
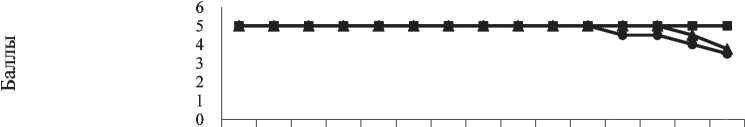
Для определения возможного токсического эффекта используемого имитатора miR-204-5p оценивались динамика массы тела, внешний вид и двигательная активность животных в течение эксперимента. Животные проявляли выраженные избегательно-оборонительные реакции и нормальную двигательную активность во всех исследуемых группах, имели яркие, незагрязненные покровы тела, а к 13–14-му дню двигательная активность в контрольных группах животных статистически значимо снизилась по сравнению с группой имитатора miR-204-5p (р=0,011) (рис. 1). Динамика массы тела животных в исследуемых группах за период эксперимента значимо не различалась и составляла 16–16,5 г.
При вскрытии животных в исследуемых группах не было отмечено дистрофических изменений внутренних органов (легких, печени, селезенки, почек, головного мозга), масса органов статистически не различалась (рис. 2.). При определении массы опухолевого узла на 14-е сут после трансплантации клеток меланомы отмечена тенденция к уменьшению массы опухолевого узла в группе животных, которым вводился имитатор miR-204-5p (p=0,061) (рис. 3).
Для определения генов-мишеней miR-204-5p использовали следующие базы данных: MiRDB 5.0
Двигательная активность животных после воздействия имитатором miR-204-5p
|
—•—PBS |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
4,5 |
4,5 |
4 |
3,5 |
|
—*— Негативный контроль |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
4,5 |
3,75 |
|
—■—Имитатор miR-204-5p |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
|
Уровень значимости Р |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
1,00 |
0,12 |
0,01 |
Рис. 1. Влияние имитатора miR-204-5p на динамику двигательной активности мышей С57Bl/6 с меланомой В-16 в течение 14 сут после трансплантации опухоли (PBS – контрольная группа)
Fig. 1. Effect of the miR-204-5p mimic on the changes in locomotor activity of С57Bl/6 mice with B-16 melanoma within 14 days after tumor transplantation (PBS – control group)
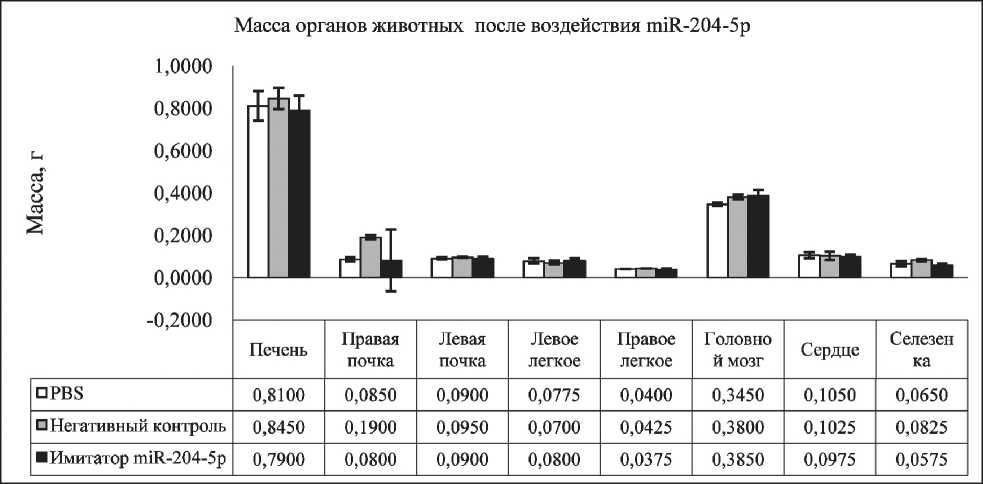
Рис. 2. Масса внутренних органов мышей С57Bl/6 с меланомой В-16 на 14-е сут после трансплантации опухоли (PBS – контрольная группа)
Fig. 2. Weight of internal organs of С57Bl/6 mice with B-16 melanoma on the 14th day after tumor transplantation (PBS – control group)
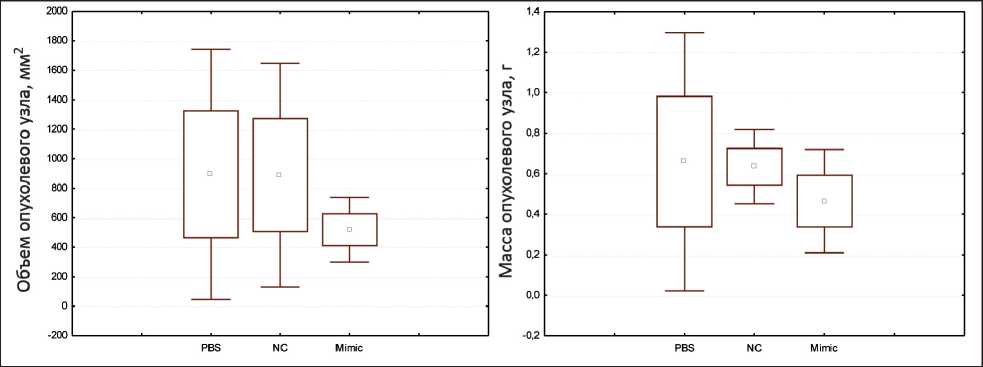
Рис. 3. Влияние имитатора miR-204-5p на объем и массу опухолевого узла у мышей С57Bl/6 с меланомой В-16
(14-е сут после трансплантации опухоли. PBS – контрольная группа, NС – негативный контроль; Mimic – имитатор miR-204-5p) Fig. 3. Effect of the miR-204-5p mimic on the volume and mass of the tumor node in С57Bl/6 mice with B-16 melanoma (14-th day after tumor transplantation. PBS – control group, NС – negative control, Mimic – miR-204-5p mimic)
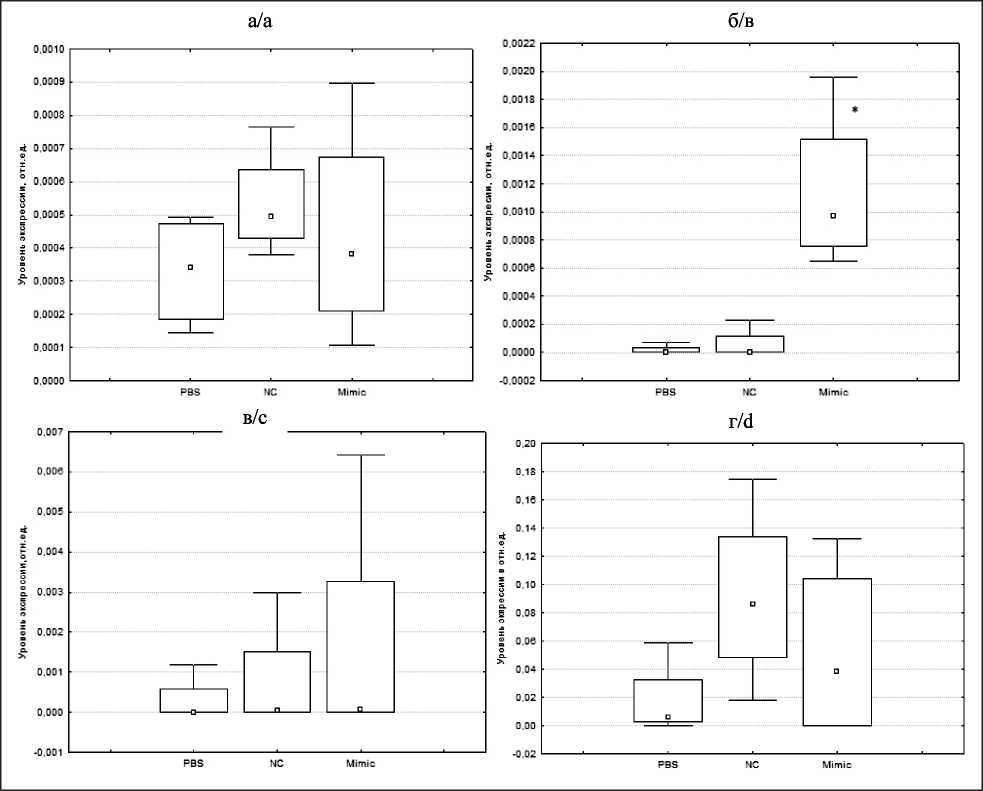
Рис. 4. Влияние имитатора miR-204-5p на относительный уровень экспрессии SIRT1 в опухолевом узле (а), легких (б), печени (в), почках (г) у мышей С57Bl/6 с меланомой В-16
Fig. 4. Effect of the miR-204-5p mimic on the relative level of SIRT1 expression in the tumor node (a), lungs (b), liver (c), kidneys (d) in С57Bl/6 mice with B-16 melanoma
, TargetScan 7.1 (http://www. , miRWalk 2.0 . Для последующих исследований по оценке эффективности трансфекции miR-204-5p были выбраны гены-мишени, идентифицированные только с помощью трех баз.
МикроРНК miR-204-5p регулирует большое количество генов-мишеней, участвующих в жизнедеятельности клеток. Часть генов ( Foxc1, Myo10, Rhobtb3, Tmod3 ) обеспечивает миграционную способность клеток, другие же гены регулируют процесс апоптоза ( Rnf122, Cdc73, Nr3c1, Bcl2 ).
По результатам оценки экспрессии SIRT1 и BCL2 в опухолевом узле и органах (легкие, печень, почки) мышей через 24 ч после 3-й внутрибрюшинной инъекции установлено, что значимо (р=0,017) увеличивается уровень экспрессии SIRT1 в легких мышей – в 59,8 раза в сравнении с базовым уровнем и в 19,6 раза в сравнении с негативным контролем – и составляет 113,62х10–5 усл. ед (рис. 4). Показаны медиана (центр столбцов), интерквартильный размах (размер столбцов), минимум и максимум (вертикальные отрезки). PBS – базовый уровень экспрессии, NC – негативный контроль, Mimic – имитатор miR-204-5p,* – статистически значимые различия между имитатором miR-404-5p и базовым уровнем экспрессии (р≤0,05). Значимых различий по уровню экспрессии SIRT1 в опухолевом узле, печени и почках мышей не выявлено.
По результатам оценки экспрессии BCL2 в опухолевом узле и дистантных органах (легкие, печень, почки) мышей через 24 ч после 3-й внутрибрюшинной инъекции установлено, что статистически значимо (p=0,043) увеличивается уровень экспрессии
BCL2 в легких мышей – в 20,2 раза в сравнении с базовым уровнем – и составляет 1802,9·10-5 усл. ед (рис. 5). В почках мышей увеличивается уровень экспрессии BCL2 (p=0,021) в 16,8 раза и составляет 1333,4·10-5 усл. ед. Значимых различий по уровню экспрессии BCL2 в опухолевом узле и печени мышей не выявлено. Показаны медиана (центр столбцов), интерквартильный размах (размер столбцов), минимум и максимум (вертикальные отрезки). PBS – базовый уровень экспрессии, NC – негативный контроль, Mimic – имитатор miR-204-5p, * – значимые различия между имитатором miR-404-5p и базовым уровнем экспрессии (р≤0,05).
Обсуждение
В ранее проведенных исследованиях выявлена супрессорная роль miR-204-5p в развитии опухолей посредством посттранкрипционной репрессии целевых генов, регулирующих процессы канцерогенеза. Применение имитатора miR-204-5p снижает пролиферацию клеток рака щитовидной железы [21], плоскоклеточного рака полости рта [22]. Модуляция уровня исследуемой микроРНК приводит к уменьшению миграции и инвазии клеток глиомы посредством регуляции экспрессии белка семейства RAS Rab22a [23]. В экспериментах in vitro на клетках линии BRO и SK-MEL1 определена роль имитатора miR-204-5p в регуляции их пролиферативной активности и жизнеспособности [24]. Помимо этого, выявлено, что экспрессия miR-204-5p снижается при меланоме по сравнению с меланоцитарными невусами [25].
Существуют механизмы негативной и позитивной регуляции микроРНК путем воздействия
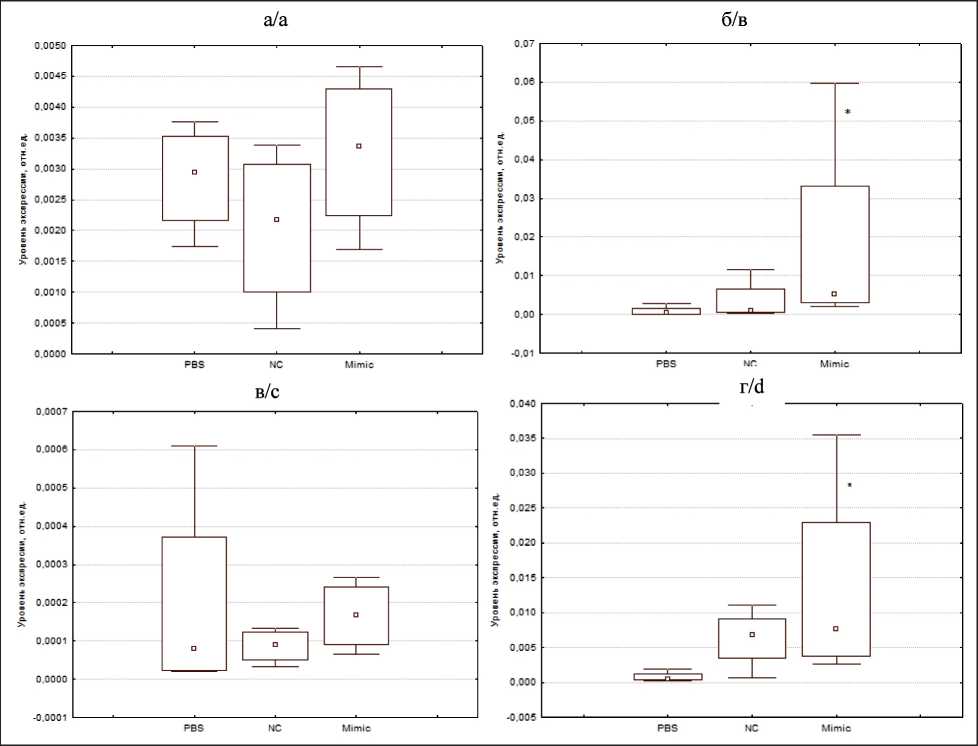
Рис. 5. Влияние имитатора miR-204-5p на относительный уровень экспрессии BСL2 в опухолевом узле (а), легких (б), печени (в), почках (г) у мышей С57Bl/6 с меланомой В-16 Fig. 5. Effect of the miR-204-5p mimic on the relative level of BСL2 expression in the tumor node (a), lungs (b), liver (c), kidneys (d) in С57Bl/6 mice with B-16 melanoma
на гены-мишени. МикроРНК способны подавлять экспрессию определенных генов, при этом сохраняя стабильность трансляционно репрессированных мРНК генов-мишеней [26]. Другой вариант функционирования микроРНК характеризуется индуцированным воздействием на ген-мишень через сайты в комплиментарных промоторных областях [27].
Оценка внешних признаков, динамики двигательной активности и массы мышей C57Bl/6 с меланомой B-16, а также измерение массы внутренних органов при вскрытии свидетельствуют об отсутствии выраженной токсичности имитатора miR-204-5p на организм животных. В проведенном исследовании отмечена тенденция к снижению массы опухолевых узлов под влиянием имитатора miR-204-5p, и представляет интерес дальнейшее исследование его влияния на развитие опухолевого процесса при увеличении дозы и длительности курса введения.
На фоне введения имитатора miR-204-5p мышам с меланомой В-16 нами зарегистрировано повышение уровня генов-мишеней данной микроРНК –SIRT1 и BCL2: BCL2 в легких и почках, SIRT1 – в легких. В ранее проведенных исследованиях in vitro было установлено, что имитатор miR-204-5p вызывает снижение пролиферативной активности в клетках меланомы, при этом однократное внутривенное введение имитатора in vivo не показало противоопухолевого эффекта, и определялось только изменение уровня miR-204-5p в почках [28]. Таким образом, повышение кратности введения, изменение способа введения с внутривенного на внутрибрюшинный позволили увеличить
Список литературы Оценка противоопухолевых, токсических эффектов и характера экспрессии генов-мишеней MIR-204-5P при применении ее имитатора на модели меланомы В-16 in vivo
- Arozarena I., Wellbrock C. Phenotype plasticity as enabler of melanoma progression and therapy resistance. NatRevCancer. 2019. 19(7): 377-91. doi: 10.1038/s41568-019-0154-4.
- Рукша Т.Г., Аксененко М.Б., Гырылова С.Н. Злокачественные новообразования кожи: анализ заболеваемости в Красноярском крае, проблемы профилактики и совершенствования ранней диагностики. Вестник дерматологии и венерологии. 2010. 4: 4-9. [Ruksha T.G., AksenenkoM.B., GyrylovaS.N. Malignant skin neoplasms: analysis ofthe incidence rate in the Krasnoyarsk Territory, problems of prevention and improvement of early diagnostics. Herald of Dermatology and Venerology. 2010. 4: 4-9. (in Russian)].
- Chen Z., Li Z., SouttoM, Wang W, PiazueloM.B., Zhu S., Guo Y, Maturana M.J., Corvalan A.H., Chen X., Xu Z., El-Rifai W. Integrated analysis of mouse and human gastric neoplasm sidentifiescon served microRNA network sin gastric carcinogenesis. Gastroenterology. 2019. 156(4): 1127-39. doi: 10.1053/j.gastro.2018.11.052.
- Fasoulakis Z., Daskalakis G., DiakosavvasM., Papapanagiotou I., TheodoraM., BourazanA., Alatzidou D., Pagkalos A., KontomanolisE.N. MicroRNAs Determining Carcinogenesis by Regulating Oncogenes and Tumor Suppressor Genes During Cell Cycle. MicroRNA. 2020; 9(2): 82-92. doi: 10.2174/2211536608666190919161849.
- Lee T.J., YuanX., Kerr K., YooJ.Y., Kim D.H., Kaur B., Eltzschig H.K. Strategies to Modulate MicroRNA Functions for the Treatment of Cancer or Organ Injury. Pharmacol Rev. 2020; 72(3): 639-67. doi: 10.1124/ pr. 119.019026.
- Noori J., Sharifi M., Haghjooy Javanmard S. miR-30a Inhibits Melanoma Tumor Metastasis by Targeting the E-cadherin and Zinc Finger E-box Binding Homeobox 2. Adv Biomed Res. 2018; 7: 143. doi: 10.4103/ abr.abr_146_18.
- XuD., ChenX., He Q., Luo C. MicroRNA-9 suppresses the growth, migration, and invasion of malignant melanoma cells via targeting NRP1. Onco Targets Ther. 2016; 9: 7047-57. doi: 10.2147/0TT.S107235.
- Chen Y., Zhang Z., Luo C., Chen Z., Zhou J. MicroRNA-18b inhibits the growth of malignant melanoma via inhibition of HIF-1a-mediated glycolysis. Oncol Rep. 2016; 36(1): 471-9. doi: 10.3892/or.2016.4824.
- Zhou J., Xu D., Xie H., Tang J., Liu R., Li J., Wang S., Chen X., Su J., Zhou X., Xia K., He Q., Chen J., Xiong W., Cao P., Cao K. miR-33a functions as a tumor suppressor in melanoma by targeting HIF-1a. Cancer Biol Ther. 2015; 16(6): 846-55. doi: 10.1080/15384047.2015.1030545.
- Yang C.H., Yue J., Pfeffer S.R., Handorf C.R., Pfeffer L.M. Mi-croRNA miR-21 regulates the metastatic behavior of B16 melanoma cells. J Biol Chem. 2011; 286(45): 39172-8. doi: 10.1074/jbc.M111.285098.
- Lai X., Wolkenhauer O., Vera J. Understanding microRNA-medi-ated gene regulatory networks through mathematical modelling. Nucleic Acids Res. 2016; 44(13): 6019-35. doi: 10.1093/nar/gkw550.
- HeL., HeX., Lim L.P., de StanchinaE., Xuan Z., Liang Y., Xue W., Zender L., Magnus J., Ridzon D., Jackson A.L., Linsley P.S., Chen C., Lowe S.W., Cleary M.A., Hannon G.J. A microRNA component of the p53 tumour suppressor network. Nature. 2007; 447(7148): 1130-4. doi: 10.1038/nature05939.
- TodaH., Kurozumi S., Kijima Y., Idichi T., Shinden Y., Yamada Y., Arai T., MaemuraK., Fujii T., Horiguchi J., Natsugoe S., SekiN. Molecular pathogenesis of triple-negative breast cancer based on microRNA expression signatures: antitumor miR-204-5p targets AP1S3. J Hum Genetics. 2018. 63(12): 1197-210. doi: 10.1038/s10038-018-0510-3.
- Дубовцева И.Ю., Аксененко М.Б., Рукша Т.Г. Роль сиртуина 1 в регуляции клеток меланомы. Сибирский онкологический журнал. 2019; 18(6): 82-9. [DubovtsevaI.Yu., AksenenkoM.V., Ruksha T.G. Role of sirtuin 1 in regulation of melanoma cell proliferation. Siberian Journal of Oncology. 2019; 18(6): 82-9. (in Russian)]. doi: 10.21294/1814-48612019-18-6-82-89.
- Frenzel A., Grespi F., Chmelewskij W., Villunger A. Bcl2 family protein sincarcino genesis and the treatment of cancer. Apoptosis. 2009. 14: 584-96. doi: 10.1007/s10495-008-0300-z.
- Трещалина Е.М., Жукова О.С., Герасимова Г.К., Андронова Н.В., Гарин А.М. Методические рекомендации по доклиническому изучению противоопухолевой активности лекарственных средств. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М., 2012. С. 642-57. [Treshchalina E.M., Zhukova O.S., Gerasimova G.K., Andronova N.V., Garin A.M. Guidelines for the preclinical study of the antitumor activity of drugs. Guidelines for conducting preclinical studies of drugs. Part 1. M., 2012. P. 642-57. (in Russian)].
- Dunn R. Brexit: A Boon or a Curse for Animals Used in Scientific Procedures? Animals (Basel). 2021; 11(6): 1547. doi: 10.3390/ ani11061547.
- Flecknell P. Replacement, reduction and refinement. ALTEX. 2002; 19(2): 73-8.
- Михеев А.А., Шмендель Е.В., Жестовская Е.С., Назаров Г.В., Маслов М.А. Катионные липосомы как средства доставки нуклеиновых кислот. Тонкие химические технологии. 2020. 15(1): 7-27. [Mikheev A.A., Shmendel E.V., Zhestovskaya E.S., Nazarov G.V., Maslov M.A. Cationic liposomes as delivery systems for nucleic acids. Fine Chemical Technologies. 2020. 15(1): 7-27. (in Russian)]. doi:10.32362/2410-6593-2020-15-1-7-27.
- Schlosser K., Taha M., Stewart D.J. Systematic Assessmentof Strategies for Lung-targeted Delivery of MicroRNA Mimics. Theranostics. 2018. 8(5): 1213-26. doi: 10.7150/thno.22912.
- Liu L., Wang J., Li X., Ma J., Shi C., Zhu H., Xi Q., Zhang J., Zhao X., Gu M. MiR-204-5p suppresses cell proliferation by inhibiting IGFBP5 in papillary thyroid carcinoma. Biochem Biophys Res Commun. 2015; 457(4): 621-6. doi: 10.1016/j.bbrc.2015.01.037.
- Wang X., Li F., Zhou X. miR-204-5p regulates cell proliferation and metastasis through inhibiting CXCR4 expression in OSCC. Biomed Pharmacother. 2016; 82: 202-7. doi: 10.1016/j.biopha.2016.04.060.
- Xia Z., Liu F., Zhang J., Liu L. Decreased Expression of MiRNA-204-5p Contributes to Glioma Progression and Promotes Glioma Cell Growth, Migration and Invasion. PLoS One. 2015; 10(7). doi: 10.1371/ journal.pone.0132399.
- Palkina N., Komina A., Aksenenko M., MoshevA., Savchenko A., Ruksha T. miR-204-5p and miR-3065-5p exert antitumor effects on melanoma cells. Oncol Lett. 2018; 15(6): 8269-80. doi: 10.3892/ol.2018.8443.
- Палкина Н.В., Комина А.В., Аксененко М.Б., Белоногов Р.Н., Лаврентьев С.Н., Рукша Т.Г. Жизнеспособность клеток меланомы b16 in vitro и токсичность ингибитора mir-204-5p (lna™) in vivo при модуляции экспрессии mir-204-5p у мышей. Цитология. 2018. 60(3): 180-7. [Palkina N.V., Komina A.V., Aksenenko M.B., Belonogov R.N., Lavrentev S.N., Ruksha T.G. Toxicity of mir-204-5p inhibition for melanoma b16 cells in vitro and mice in vivo. Cell and Tissue Biology. 2018. 60(3): 180-7. (in Russian)].
- Ambros V. The functions of animal microRNAs. Nature. 2004; 431(7006): 350-5. doi: 10.1038/nature02871.
- Place R.F., Li L.C., Pookot D, Noonan E.J., Dahiya R. Mi-croRNA-373 induces expression of genes with complementary promoter sequences. Proc Natl Acad Sci U S A. 2008; 105(5): 1608-13. doi: 10.1073/ pnas.0707594105.
- White P.J., Anastasopoulos F., Pouton C.W., BoydBJ. Overcoming biological barriers to in vivo efficacy of antisense oligonucleotides. Expert Rev Mol Med. 2009; 11. doi: 10.1017/S1462399409001021.
- Vartanian A., Baryshnikova M., Burova O., Afanasyeva D., Misyu-rin V., BelyGvskyA., Shprakh Z. Inhibitor of vasculogenic mimicry restores sensitivity of resistant melanoma cells to DNA-damaging agents. Melanoma Res. 2017; 27(1): 8-16. doi: 10.1097/CMR.0000000000000308.
- Григорьева И.Н., Бурова О.С., Степанова Е.В., Харатишви-ли Т.К., Барышников А.Ю. Способность клеточных линий метастатической меланомы кожи к васкулогенной мимикрии. Российский биотерапевтический журнал. 2010. 9(4): 97-102. [Grigorieva I.N., Burova O.S., Stepanova E.V., Kharatishvili T.K., Baryshnikov A.Yu. Ability of metastatic cutaneous melanoma cell lines to vasculogenic mimicry. Russian Journal of Biotherapy. 2010. 9(4): 97-102. (in Russian)].
- Courboulin A., Paulin R., Giguère N.J., Saksouk N., Perreault T., Meloche J., PaquetE.R., Biardel S., Provencher S., Côté J., SimardM.J., Bonnet S. Role for miR-204 in human pulmonary arterial hypertension. J Exp Med. 2011; 208(3): 535-48. doi: 10.1084/jem.20101812.


