Оценка радиационной безопасности радиофармпрепарата «Микросферы альбумина 5-10 мкм, меченые 188Re» при проведении радиосиновэктомии коленного сустава
Автор: Хвостунов И.К., Крылов В.В., Петриев В.М., Коровчук О.Н., Гераськина А.С., Луговая А.В., Петросян К.М., Железнов А.А., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 3 т.34, 2025 года.
Бесплатный доступ
Радиосиновэктомия коленного сустава может сопровождаться побочным радиационным воздействием на здоровые органы и ткани пациента, что необходимо корректно учитывать для дальнейшего внедрения этого метода в широкую практику. Цель проведённого исследования – оценка радиационной безопасности радиофармпрепарата «Микросферы альбумина 510 мкм, меченые 188Re» («МСА 510 мкм, 188Re) для пациентов, страдающих хроническими синовитами коленных суставов, резистентными к стандартной терапии. Проведено цитогенетическое обследование 23 пациентов (12 мужчин и 11 женщин), страдающих рецидивирующими синовитами коленных суставов, включая внутрисуставное введение глюкокортикоидов. Обследованные пациенты получали терапию с введением 370, 555, 740 и 925 МБк «МСА 510 мкм, 188Re» в один коленный сустав. Побочное радиационное воздействие оценивалось по индукции хромосомных аберраций в лимфоцитах периферической крови. Всего было проанализировано 66 образцов крови (ОК). ОК брались у всех пациентов до введения (контроль, 23 ОК) и далее через 1 день (1 ОК), 3 дня (22 ОК), 23 дня (5 ОК) и 28 дней (15 ОК) после введения радиофармпрепарата. Для биологической дозиметрии по частоте аберраций была использована собственная калибровочная дозовая зависимость в форме линейноквадратичной модели с учётом эффекта мощности дозы. Проведённое цитогенетическое обследование пациентов показало, что частота наблюдаемых после введения «МСА 510 мкм, 188Re» хромосомных аберраций незначительно превышает контроль и не зависит от величины введённой активности в диапазоне 370925 МБк. Побочное радиационное воздействие от введения радиофармпрепарата является безопасным, поскольку частота индуцированных хромосомных аберраций не превышает спонтанный уровень у здоровых доноров. Биодозиметрическая оценка средней побочной дозы общего облучения у обследованных пациентов варьирует в пределах 104182 мГр с верхней 95% доверительной границей в диапазоне 410521 мГр. Результаты проведённого исследования показали, что при радиосиновэктомии коленного сустава с однократным внутрисуставным введением препарата «МСА 510 мкм, 188Re» побочное радиационное воздействие на пациента не представляет опасности, поскольку побочная доза не превышает воздействия от естественного радиационного фона.
Радиационная безопасность, радиосиновэктомия, радиофармпрепарат, 188Re, микросферы альбумина, лимфоциты крови, аберрации хромосом, радиобиология, ядерная медицина.
Короткий адрес: https://sciup.org/170210840
IDR: 170210840 | УДК: 616.728.3:615.849.2:546-071-036.8 | DOI: 10.21870/0131-3878-2025-34-3-98-115
Текст научной статьи Оценка радиационной безопасности радиофармпрепарата «Микросферы альбумина 5-10 мкм, меченые 188Re» при проведении радиосиновэктомии коленного сустава
Радиосиновэктомия (РСЭ) представляет собой особый метод лучевой терапии, состоящий во внутрисуставном введении радиофармацевтических лекарственных препаратов (РФЛП), содержащих β-излучающие радионуклиды, например, 198Аu, 90Y, 32Р, 169Er, 166Но, 186Re, 188Re и ряд других. Принцип терапевтического действия РФЛП основан на локальном облучении синовиальной оболочки сустава. Введённый препарат захватывается путём фагоцитоза клетками поверх-
Хвостунов И.К.* – гл. науч. сотр., д.б.н.; Крылов В.В. – зав. отд., д.м.н.; Петриев В.М. – зав. отд., д.б.н.; Коровчук О.Н. – науч. сотр.; Гераськина А.С. – науч. сотр.; Луговая А.В. – врач-радиолог; Петросян К.М. – врач-радиолог; Железнов А.А. – клин. ординатор; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. кафедры РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
ностного эпителия синовиальной оболочки, оказывая тем самым повреждающее действие на воспаленную ткань. За счёт местного облучения воспаленной синовиальной оболочки сустава в ней возникает процесс абляции и гибели функционально активных клеток, ответственных за поддержание воспаления. В результате достигается снижение, как болевого синдрома, так и проявлений активного воспаления [1, 2]. В настоящее время частота использования РСЭ в клинической практике разных стран существенно различается, что связано как с доступностью метода, так и с традициями национальных ревматологических служб. В отличие от отечественной практики, где РСЭ в настоящее время применяется только в МРНЦ им. А.Ф. Цыба, за рубежом подобное лечение применяется широко, но распространено неравномерно. Так, в Великобритании за год выполняется около 100 процедур РСЭ, а в Германии – от 40 до 60 тыс. [3].
При проведении РСЭ РФЛП вводится непосредственно в полость воспалённого сустава для того, чтобы радиоактивные частицы фагоцитировались синовиоцитами синовиальной оболочки. Идеальный РФПЛ для РСЭ должен обеспечивать лучевое поражение синовиальной оболочки при минимальном побочном воздействии, иметь короткий период полураспада, высокую химическую чистоту при отсутствии токсических свойств, быть полностью биоразлагаемым и иметь приемлемое соотношение стоимости и эффективности [2]. В результате благодаря избирательному накоплению РФПЛ в зоне поражения обеспечивается интенсивное лучевое воздействие на клетки синовиальной оболочки, которые участвуют в развитии хронического воспалительного процесса.
РСЭ является признанным методом лечения персистирующего синовита при воспалительных заболеваниях суставов уже более 50 лет [4, 5]. РСЭ обычно применяют, когда другие методы не показывают ожидаемой эффективности и пациенты должным образом не отвечают на проводимую терапию, включая локальную терапию глюкокортикоидами. При применении РСЭ может быть получен благоприятный и стойкий эффект, поскольку в результате лучевого воздействия обычно возникает поверхностный фиброз синовии, что и определяет эффект на длительное время [5, 6].
Показаниями к РСЭ являются различные ревматические заболевания, сопровождающиеся синовитом (ревматоидный артрит, псориатический артрит, болезнь Бехтерева, остеоартроз с синовитом и др.), а также виллонодулярный синовит, гемофилический артрит, состояние после эндопротезирования сустава с хроническим образованием выпота. По эффективности РСЭ сопоставима с хирургическим вмешательством, однако она значительно менее травматична и проста в выполнении, поскольку не требует длительных послеоперационных реабилитационных мероприятий, а также экономически оправдана.
Лучевое терапевтическое воздействие на синовию отличается по своим последствиям от её хирургического удаления. Так, при хирургическом лечении воспалённая ткань полностью удаляется почти на всей площади капсулы сустава, после чего начинается её регенерация. Однако уже через 2 мес. после операции во вновь сформировавшейся синовии нередко можно обнаружить признаки воспаления. При РСЭ через 2 недели после внутрисуставного введения РФЛП в синовии отмечается формирование воспалительного инфильтрата, содержащего плазматические клетки, гистиоциты и фибробласты. Наряду с этим развиваются окклюзия множества капилляров синовиальных ворсин и очаговая пролиферация покровного слоя синовиоцитов. Через 4 недели воспалительные изменения уменьшаются, возрастает количество фиброцитов. Через 12 недель клеточная инфильтрация субсиновиального слоя значительно уменьшается, наблюдаются фиброзированные сосуды и увеличение количества интерстициальной фиброзной ткани. Определяется частичная регенерация разрушенного покровного слоя. Через 24 недели можно видеть нарастание субсиновиального склероза и процесс регенерации покровного слоя синовии, но суставной хрящ остаётся интактным.
Воздействие β-излучения 188Re при внутрисуставном введении РФЛП является строго локальным, ограничиваясь областью конкретного сустава, в который вводится препарат, с формированием максимальной поглощённой дозы в синовиальной оболочке. Однако, учитывая, что пациенты, получающие РСЭ, в отличие от онкологических больных, в среднем живут значительно дольше, необходимо исследование радиационной безопасности РСЭ. Доказательное обоснование радиационной безопасности процедуры РСЭ важно и для дальнейшего внедрения этого метода в широкую практику. Поскольку методы лучевой терапии в отечественной ревматологии не являются рутинной процедурой, исследование радиационной безопасности РСЭ является востребованным и актуальным.
Метод биологической дозиметрии на основе анализа хромосомных аберраций в лимфоцитах крови пациентов является одним из перспективных и предпочтительных подходов. Структурные хромосомные изменения являются наиболее тщательно изученными биологическими параметрами радиационно-индуцированных повреждений клеток. В частности, повышенная частота дицентрических хромосом в лимфоцитах крови является чувствительным и специфичным биоиндикатором радиационного воздействия на человека. Используя частоту радиационно-индуцированных дицентриков в лимфоцитах крови в качестве показателя облучения всего тела, можно достоверно оценить побочную дозу у пациентов после внутреннего облучения [7].
В настоящей работе был использован метод биологической дозиметрии на основе анализа радиационных повреждений хромосом в лимфоцитах периферической крови. У пациентов, получающих РСЭ при помощи РФЛП «МСА 5-10 мкм, 188Re», подобное исследование было выполнено впервые. Для биологической дозиметрии был применён математический алгоритм расчёта дозы с использованием частоты аберраций хромосом и собственная дозовая калибровочная зависимость в соответствии с международными рекомендациями МАГАТЭ [7]. При расчёте поглощённой дозы учитывался эффект мощности дозы [8].
Цель настоящего исследования – оценка радиационной безопасности РФЛП «МСА 5-10 мкм, 188Re» при РСЭ с однократным внутрисуставном введении РФЛП пациентам, страдающим хроническими синовитами коленных суставов, резистентными к стандартной терапии.
Материал и методы
В МРНЦ им. А.Ф. Цыба был разработан и в 2018 г. прошёл доклинические испытания оригинальный РФЛП на основе микросфер альбумина, меченых 188Re, для проведения РСЭ. Микросферы данного РФЛП имеют правильную сферическую форму с диаметром от 5 до 10 мкм. Микросферы РФЛП являются полностью биодеградируемыми субстанциями.
В настоящей работе были обследованы 23 пациента (12 мужчин и 11 женщин), страдающих рецидивирующими синовитами коленных суставов, резистентными к стандартной терапии, включая внутрисуставное введение глюкокортикоидов (табл. 1). Возраст обследованных лиц варьировал от 28 до 73,3 лет (медиана 39,9). Пациенты получали РСЭ с введением 370, 555, 750 и 925 МБк «МСА 5-10 мкм, 188Re». Каждый пациент получал однократное внутрисуставное введение РФЛП в один коленный сустав. Число заборов крови на каждого пациента составило от 2 до 3. Число проанализированных метафаз на одного пациента варьировало в пределах от 86 до 1000, в среднем – 334. Всего в анализ были включено 66 образцов крови (ОК) с суммарным анализом 22039 метафаз.
Побочное радиационное воздействие на пациента оценивалось по индукции хромосомных аберраций в лимфоцитах периферической крови в результате введения РФЛП. ОК брали у всех пациентов до введения (контроль, 23 ОК) и далее через 1 день (1 ОК), 3 дня (22 ОК), 23 дня (5 ОК) и 28 дней (15 ОК) после введения РФЛП (табл. 2). Оценку побочного радиационного воздействия на обследованных пациентов производили путём анализа повреждений хромосом в лимфоцитах крови.
Таблица 1 Список обследованных пациентов
|
Код |
Возраст, лет |
Пол (М/Ж) |
РФЛП, МБк |
Диагноз* |
|
П1 |
39,8 |
М |
370 |
псориатический артрит |
|
П2 |
37,5 |
М |
370 |
артрит неуточнённый |
|
П3 |
43,6 |
Ж |
370 |
гонартроз |
|
П4 |
39,9 |
М |
370 |
псориатический артрит |
|
П5 |
37,6 |
М |
370 |
спондилоартрит |
|
П6 |
43,7 |
Ж |
370 |
ревматоидный артрит |
|
П7 |
73,3 |
Ж |
370 |
гонартроз |
|
П8 |
62,2 |
Ж |
370 |
посттравматический остеоартрит |
|
П9 |
37,2 |
Ж |
555 |
хронический синовит |
|
П10 |
66,2 |
М |
555 |
артрит неуточнённый |
|
П11 |
37,6 |
М |
555 |
псориатический артрит |
|
П12 |
37,8 |
М |
555 |
виллонодулярный синовит |
|
П13 |
39,7 |
М |
555 |
псориатический артрит |
|
П14 |
61,2 |
Ж |
740 |
артроз |
|
П15 |
65,1 |
Ж |
740 |
гонартроз |
|
П16 |
40,8 |
Ж |
740 |
ревматоидный артрит |
|
П17 |
61,8 |
М |
740 |
подагрический артрит |
|
П18 |
62,5 |
Ж |
740 |
посттравматический остеоартрит |
|
П19 |
37,8 |
М |
925 |
псориатический артрит |
|
П20 |
60,1 |
Ж |
925 |
синвит неуточнённый |
|
П21 |
39,9 |
М |
925 |
псориатический артрит |
|
П22 |
35,2 |
М |
925 |
псориатический артрит |
|
П23 |
28,0 |
Ж |
925 |
псориатический артрит |
Примечание: * – все пациенты имели хронический рецидивирующий синовит одного или обоих коленных суставов, резистентный к стандартной терапии.
Для цитогенетического анализа использовали образцы крови, которые брали у всех обследованных лиц в соответствии с действующим законодательством РФ и нормами медицинской этики после получения информированного согласия. Хромосомные аберрации изучали стандартным метафазным методом в клетках первого митоза с периодом инкубации 48 ч в соответствии с рекомендациями МАГАТЭ [7]. При анализе идентифицировали ацентрические парные фрагменты (ace), центрические кольца (rc) и дицентрики (dic). Пример результатов цитогенетического анализа представлен на рис. 1. Детали методики стандартного анализа были опубликованы ранее [8, 9].
Для биологической дозиметрии по частоте аберраций была использована линейно-квадратичная модель, в рамках которой при облучении лимфоцитов в течение периода T частота аберраций Y как функция дозы D подчиняется следующей закономерности:
Y = c + aD + G(T)0D2, (1)
где c , α , β – коэффициенты дозовой зависимости при остром облучении; G(T) – обобщённый временной фактор модели Lea-Catcheside.
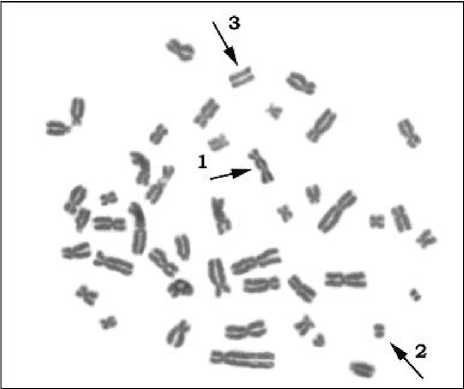
Рис. 1. Фотоиллюстрация аберрантной метафазы с аберрациями хромосомного типа при стандартном анализе: 1 - дицентрик, 2, 3 - ацентрические парные фрагменты.
Фактор G(T) вычисляется по следующей формуле с учётом эффекта мощности дозы и репарации разрывов хромосом:
tW^ £ R^dt Й М~ t')R(t')dt' ,
где R(t) - мощность поглощённой дозы в зависимости от времени за период облучения T ; Ф ( t ) - вероятность того, что разрывы хромосом остаются нерепарированными до времени t ; D - доза облучения. Мощность дозы в зависимости от времени t рассчитывалась по формуле:
ад = й 0 (1 - е -^ ) ,
где Ro - начальное значение мощности дозы; Aef- эффективная константа снижения мощности дозы за счёт радиоактивного распада 188Re и выведения РФЛП из организма. В данной работе принято 2ef=0,0408 ч-1, T1/2=17 ч [10].
Вероятность репарации разрыва хромосом рассчитывали по модели неполной репарации [11]
по формуле:
1 1+nt ,
где ^ - константа модели. В данной работе принято ^ =0,438 ч-1 ( т =1/ р =2,28 ч) [11]. В результате численного интегрирования формулы (2) с учётом (3) и (4) фактор G(T) варьировал в диапазоне 0,1814-0,0847 при продолжительности облучения T в пределах от 1 до 28 сут.
На рис. 2 представлена калибровочная дозовая зависимость частоты индуцированных хромосомных аберраций (ace+rc+dic), рассчитанная по формуле (1) с учётов фактора G ( T =3 сут) и зависимости частоты аберраций, полученной нами ранее при облучении лимфоцитов крови in vitro с низкой ЛПЭ [8]. Верхний и нижний 95% доверительный интервал дозовой зависимости был рассчитан в соответствии с рекомендованной МАГАТЭ методикой [7].
Статистический анализ проводили в соответствии со следующими положениями. В качестве критерия значимости для проверки гипотезы о равенстве средних использовалась Z-статистика без дополнительных предположений о дисперсиях исследуемых распределений. Статистическая оценка погрешности среднего значения индивидуальной частоты хромосомных аберра- ций выполнялась по выборочной дисперсии на основе распределения суммы хромосомных аберраций по клеткам. При сопоставлении средних величин учитывались стандартные ошибки средних значений частот детектированных аберраций. Статистическую обработку результатов и регрессионный анализ осуществляли с помощью стандартных алгоритмов, представленных в приложениях Microsoft Excel и OriginLab-6.0.
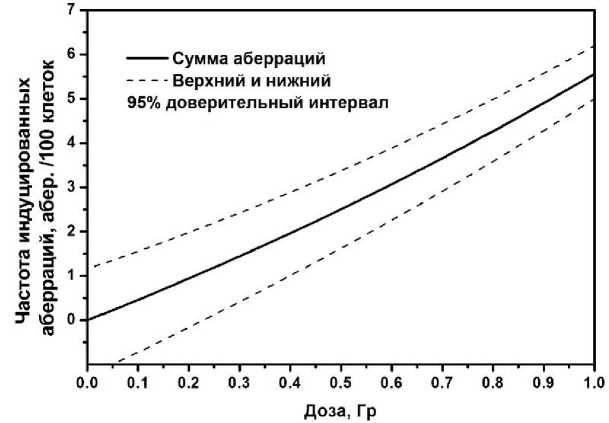
Рис. 2. Калибровочная дозовая зависимость частоты хромосомных аберраций для побочного радиационного воздействия РФЛП с учётом эффекта мощности дозы. Период облучения T =3 сут; G(T) =0,095; Л >»=0,0408 ч-1 ( T eff 1/2=17 ч); ^ =0,438 ч-1 ( т =1/ д =2,28 ч).
Проведение данного исследования осуществлялось в соответствии с протоколом, принципами Хельсинкской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013), трёхсторонним соглашением по Надлежащей клинической практике (ICH GCP) и приказом Министерства здравоохранения и социального развития РФ от 31 августа 2010 г. № 774н «О Совете по этике».
Результаты
В табл. 2 представлены результаты цитогенетического анализа и статистическая оценка частоты наблюдаемых аберраций хромосомного типа в лимфоцитах крови обследованных пациентов - M и её прирост (индукция) в результате введения РФЛП - AM. Прирост частоты аберраций вычислялся как разница между частотами после и до введения РФЛП (контроль, день 0) с учётом статистической погрешности.
В табл. 2 также приведены распределения суммы аберраций хромосомного типа по клеткам, относительная вариация показателя (σ/M) и статистика (U) [12]. Подобная информация позволяет сделать заключение о том, соответствует ли наблюдаемое распределение Пуассоновскому или нет, что в свою очередь свидетельствует, было ли облучение пула лимфоцитов равномерным или нет. При статистическом анализе для заключения о равномерности облучения величина статистики U должна быть менее 1,96 [12]. По данному критерию 20 из 66 (30,3%) распределений отражают неравномерное облучение лимфоцитов крови пациентов.
Таблица 2
Результаты цитогенетического обследования пациентов с рецидивирующими синовитами коленных суставов. M=100 (ace+rc+dic)/Cells; ∆M=M – M (день 0)
|
Код |
День |
Cells |
ace |
rc |
dic |
M±SE* |
∆M±SE* |
Распределение аберраций по клеткам |
σ/M |
U |
||||
|
0 |
1 |
2 |
3 |
4 |
||||||||||
|
П1 |
0 |
300 |
3 |
1 |
0 |
1,33±0,81 |
0±1,62 |
297 |
2 |
1 |
0 |
1,49 |
6,54 |
|
|
П1 |
3 |
300 |
2 |
0 |
0 |
0,67±0,47 |
-0,66±1,28 |
298 |
2 |
0 |
1,0 |
-0,06 |
||
|
П2 |
0 |
300 |
2 |
0 |
1 |
1,00±0,58 |
0±1,16 |
297 |
3 |
0 |
0,99 |
-0,10 |
||
|
П2 |
1 |
531 |
6 |
0 |
1 |
1,32±0,56 |
0,32±1,14 |
525 |
5 |
1 |
0 |
1,27 |
4,83 |
|
|
П3 |
0 |
300 |
1 |
0 |
0 |
0,33±0,33 |
0±0,66 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П3 |
3 |
600 |
5 |
0 |
1 |
1,00±0,67 |
0,67±1,00 |
595 |
4 |
1 |
0 |
1,33 |
6,17 |
|
|
П4 |
0 |
300 |
5 |
0 |
0 |
1,67±0,74 |
0±1,48 |
295 |
5 |
0 |
0,99 |
-0,18 |
||
|
П4 |
3 |
300 |
3 |
0 |
2 |
1,67±0,74 |
0±3,34 |
295 |
5 |
0 |
0,99 |
-0,18 |
||
|
П4 |
28 |
300 |
5 |
0 |
1 |
2,00±0,81 |
0,33±1,14 |
294 |
6 |
0 |
0,98 |
-0,27 |
||
|
П5 |
0 |
300 |
5 |
0 |
1 |
2,00±0,81 |
0±1,62 |
294 |
6 |
0 |
0,98 |
-0,27 |
||
|
П5 |
3 |
300 |
0 |
1 |
0 |
0,33±0,33 |
-1,67±1,14 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П5 |
28 |
600 |
8 |
0 |
3 |
1,83±0,55 |
-0,17±1,36 |
289 |
11 |
0 |
0,98 |
-0,30 |
||
|
П6 |
0 |
300 |
2 |
0 |
0 |
0,67±0,47 |
0±0,94 |
299 |
0 |
1 |
0 |
2,0 |
17,3 |
|
|
П6 |
3 |
1000 |
11 |
8 |
13 |
3,20±0,59 |
2,53±1,06 |
970 |
28 |
2 |
0 |
1,09 |
2,14 |
|
|
П6 |
28 |
300 |
2 |
0 |
2 |
1,33±0,66 |
0,66±1,13 |
296 |
4 |
0 |
0,99 |
-0,14 |
||
|
П7 |
0 |
300 |
4 |
0 |
0 |
1,33±0,81 |
0±1,62 |
297 |
2 |
1 |
0 |
1,49 |
6,94 |
|
|
П7 |
3 |
300 |
10 |
0 |
0 |
3,33±1,14 |
2,0±1,95 |
291 |
8 |
1 |
0 |
1,17 |
2,20 |
|
|
П7 |
28 |
300 |
4 |
1 |
2 |
2,33±0,99 |
1,0±1,80 |
294 |
5 |
1 |
0 |
1,27 |
3,52 |
|
|
П8 |
0 |
300 |
0 |
0 |
2 |
0,67±0,47 |
0±0,94 |
298 |
2 |
0 |
1,0 |
-0,06 |
||
|
П8 |
3 |
300 |
4 |
1 |
0 |
1,67±0,74 |
1,0±1,21 |
295 |
5 |
0 |
0,99 |
-0,18 |
||
|
П8 |
28 |
320 |
1 |
1 |
1 |
0,94±0,54 |
0,27±1,01 |
317 |
3 |
0 |
0,99 |
-0,10 |
||
|
П9 |
0 |
300 |
0 |
1 |
0 |
0,33±0,33 |
0±0,66 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П9 |
3 |
300 |
3 |
0 |
0 |
1,00±0,74 |
0,67±1,07 |
298 |
1 |
1 |
0 |
1,66 |
5,92 |
|
|
П9 |
28 |
600 |
4 |
0 |
1 |
0,83±0,37 |
0,50±0,70 |
595 |
5 |
0 |
0,99 |
0,13 |
||
|
П10 |
0 |
300 |
1 |
0 |
1 |
0,67±0,47 |
0±0,94 |
298 |
2 |
0 |
1,0 |
-0,06 |
||
|
П10 |
3 |
300 |
3 |
1 |
5 |
3,00±1,13 |
2,33±1,60 |
296 |
0 |
1 |
1 |
0 |
2,58 |
25,7 |
|
П10 |
28 |
300 |
4 |
0 |
1 |
1,67±0,88 |
1,0±1,35 |
296 |
3 |
1 |
0 |
1,39 |
5,30 |
|
|
П11 |
0 |
300 |
0 |
0 |
1 |
0,33±0,33 |
0±0,66 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П11 |
3 |
300 |
2 |
0 |
1 |
1,00±0,58 |
0,67±0,91 |
297 |
3 |
0 |
0,99 |
-0,10 |
||
|
П11 |
28 |
600 |
1 |
0 |
0 |
0,17±0,17 |
-0,16±0,50 |
599 |
1 |
0 |
1,00 |
0 |
||
|
П12 |
0 |
300 |
0 |
0 |
0 |
0±0,46 |
0±0,92 |
300 |
0 |
0 |
0 |
|||
|
П12 |
3 |
302 |
0 |
1 |
0 |
0,33±0,33 |
0,33±0,79 |
301 |
1 |
0 |
1,0 |
0 |
||
|
П12 |
28 |
300 |
0 |
0 |
1 |
0,33±0,33 |
0,33±0,79 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П13 |
0 |
300 |
0 |
0 |
1 |
0,33±0,33 |
0±0,66 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П13 |
3 |
300 |
3 |
0 |
0 |
1,00±0,58 |
0,67±0,91 |
297 |
3 |
0 |
0,99 |
-0,10 |
||
|
П13 |
28 |
600 |
6 |
0 |
1 |
1,17±0,50 |
0,84±0,83 |
594 |
5 |
1 |
0 |
1,28 |
5,16 |
|
|
П14 |
0 |
300 |
4 |
1 |
0 |
1,67±1,10 |
0±2,20 |
297 |
2 |
0 |
1 |
0 |
2,19 |
16,3 |
|
П14 |
3 |
300 |
5 |
0 |
0 |
1,67±0,10 |
0±1,20 |
297 |
2 |
0 |
1 |
0 |
2,19 |
16,3 |
|
П14 |
28 |
300 |
5 |
0 |
0 |
1,67±0,74 |
0±0,84 |
295 |
5 |
0 |
0,99 |
-0,18 |
||
|
П15 |
0 |
300 |
2 |
0 |
0 |
0,67±0,46 |
0±0,92 |
298 |
2 |
0 |
1,0 |
-0,06 |
||
|
П15 |
3 |
300 |
3 |
0 |
0 |
1,00±0,58 |
0,33±1,05 |
297 |
3 |
0 |
0,99 |
-0,10 |
||
|
П15 |
28 |
300 |
6 |
1 |
2 |
3,00±1,28 |
2,33±1,75 |
293 |
6 |
0 |
1 |
0 |
1,64 |
8,33 |
|
П16 |
0 |
300 |
0 |
0 |
0 |
0±0,46 |
0±0,92 |
300 |
0 |
0 |
0 |
|||
|
П16 |
3 |
300 |
2 |
0 |
1 |
1,00±0,58 |
1,00±1,04 |
297 |
3 |
0 |
0,99 |
-0,10 |
||
|
П16 |
28 |
300 |
0 |
0 |
1 |
0,33±0,33 |
0,33±0,79 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П17 |
0 |
86 |
0 |
1 |
0 |
1,16±1,16 |
0±2,32 |
85 |
1 |
0 |
1,0 |
0 |
||
|
П17 |
3 |
300 |
0 |
0 |
1 |
0,33±0,33 |
-0,83±1,49 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П17 |
28 |
300 |
9 |
0 |
3 |
4,00±1,62 |
2,84±2,78 |
291 |
8 |
0 |
0 |
1 |
1,97 |
12,3 |
|
П18 |
0 |
300 |
1 |
0 |
1 |
0,67±0,47 |
0±0,94 |
298 |
2 |
0 |
1,0 |
-0,06 |
||
|
П18 |
3 |
300 |
2 |
1 |
1 |
1,33±0,66 |
0,66±1,13 |
296 |
4 |
0 |
0,99 |
-0,14 |
||
|
П18 |
28 |
300 |
0 |
0 |
0 |
0±0,46 |
-0,67±0,93 |
300 |
0 |
0 |
0 |
|||
|
П19 |
0 |
300 |
1 |
0 |
1 |
0,67±0,47 |
0±0,94 |
298 |
2 |
0 |
1,0 |
-0,06 |
||
|
П19 |
3 |
300 |
1 |
0 |
3 |
1,33±0,66 |
0,66±1,13 |
296 |
4 |
0 |
0,99 |
-0,14 |
||
|
П19 |
23 |
300 |
6 |
0 |
0 |
2,00±0,14 |
1,33±0,61 |
295 |
4 |
1 |
0 |
1,32 |
4,26 |
|
|
П20 |
0 |
300 |
0 |
0 |
1 |
0,33±0,33 |
0±0,66 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П20 |
3 |
300 |
3 |
0 |
1 |
1,33±0,66 |
1,0±0,99 |
296 |
4 |
0 |
0,99 |
-0,14 |
||
|
П20 |
23 |
300 |
6 |
0 |
1 |
2,33±0,99 |
2,0±1,32 |
294 |
5 |
1 |
0 |
1,27 |
3,52 |
|
|
П21 |
0 |
300 |
0 |
0 |
0 |
0±0,46 |
0±0,92 |
300 |
0 |
0 |
0 |
|||
|
П21 |
3 |
300 |
5 |
1 |
1 |
2,33±1,10 |
2,33±1,56 |
295 |
3 |
2 |
0 |
1,55 |
7,31 |
|
|
П21 |
23 |
300 |
1 |
0 |
3 |
1,33±0,66 |
1,33±1,12 |
296 |
4 |
0 |
0,99 |
-0,14 |
||
|
П22 |
0 |
300 |
0 |
0 |
0 |
0±0,46 |
0±0,92 |
300 |
0 |
0 |
0 |
|||
|
П22 |
3 |
300 |
0 |
0 |
1 |
0,33±0,33 |
0,33±0,79 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П22 |
23 |
300 |
1 |
0 |
0 |
0,33±0,33 |
0,33±0,79 |
299 |
1 |
0 |
1,0 |
0 |
||
|
П23 |
0 |
300 |
8 |
1 |
2 |
3,67±1,66 |
0±3,32 |
293 |
5 |
1 |
0 |
1 |
2,24 |
16,0 |
|
П23 |
3 |
300 |
4 |
1 |
3 |
2,67±0,93 |
-1,0±2,59 |
292 |
8 |
0 |
0,98 |
-0,31 |
||
|
П23 |
23 |
300 |
4 |
0 |
3 |
2,33±0,87 |
-1,34±2,53 |
293 |
7 |
0 |
0,98 |
-0,27 |
||
Примечание: * – стандартная ошибка среднего.
В табл. 3 представлены результаты анализа наличия хромосомных аберраций в лимфоцитах крови обследованных пациентов для различных подгрупп в зависимости от введённой активности РФЛП и времени после его введения. На день 3 и день 28 статистический анализ показал, что средние значения частоты аберраций в подгруппах в зависимости от введённой активности РФЛП и средней величины по всем активностям на указанную дату не различаются (p<0,05) (рис. 3). Исключение представляет одна точка для средней частоты аберраций на день 28 при введении 555 МБк. Тем не менее, проведённый анализ позволяет заключить, что наблюдаемая частота аберраций у пациентов после введения РФЛП практически не зависит от величины введённой активности в пределах статистических погрешностей (рис. 3).
Таблица 3
Хромосомные аберрации в лимфоцитах крови обследованных пациентов в различные сроки после введения РФЛП
|
Cells |
ace |
rc 1 |
dic 1 |
M±SE 1 |
∆M±SE |
|
|
Д |
ень 0 |
|||||
|
Контроль |
6686 1 |
39 |
5 1 |
12 1 |
0,84±0,11 1 |
0±0,22 |
|
Д |
ень 1 |
|||||
|
370 МБк 1 |
531 1 |
6 |
0 1 |
1 1 |
1,32±0,50 1 |
0,48±0,59 |
|
Д |
ень 3 |
|||||
|
370 МБк |
3100 |
35 |
10 |
16 |
1,97±0,25 |
1,13±0,36 |
|
555 МБк |
1502 |
11 |
2 |
6 |
1,26±0,29 |
0,42±0,40 |
|
740 МБк |
1500 |
12 |
1 |
3 |
1,07±0,27 |
0,23±0,38 |
|
925 МБк |
1500 |
13 |
2 |
9 |
1,60±0,33 |
0,76±0,44 |
|
Все 4 активности |
7602 |
71 |
15 |
34 |
1,58±0,14 |
0,74±0,25 |
|
Д |
ень 23 |
|||||
|
925 МБк 1 |
1500 1 |
18 |
0 1 |
7 1 |
1,67±0,33 1 |
0,83±0,45 |
|
Д |
ень 28 |
|||||
|
370 МБк |
1820 |
20 |
2 |
9 |
1,70±0,31 |
0,86±0,42 |
|
555 МБк |
2400 |
15 |
0 |
4 |
0,79±0,18 |
-0,05±0,29 |
|
740 МБк |
1500 |
20 |
1 |
6 |
1,80±0,35 |
0,96±0,46 |
|
Все 3 активности |
5720 |
55 |
3 |
19 |
1,35±0,15 |
0,51±0,26 |
Результаты цитогенетического обследования пациентов в подгруппах в зависимости от времени после введения РФЛП были сопоставлены со спорадическим уровнем аберраций у здоровых доноров [9] (рис. 4). Статистический анализ средних значений частоты индуцированных аберраций в подгруппах по сравнению со спорадическим уровнем показал, что они значимо не различаются (p<0,05). Данный вывод свидетельствует о том, что общее побочное облучение от РСЭ является ничтожным и не может быть статистически значимо идентифицировано по сравнению со спонтанным фоном хромосомных аберраций.
По результатам цитогенетического обследования пациентов были выполнены биодозимет-рические расчёты по частоте индуцированных хромосомных аберраций и линейно-квадратичной модели лабораторной дозовой зависимости (1-4) (рис. 2). В табл. 4 приведена частота хромосомных аберраций (ace+rc+dic) до и после введения РФЛП в различные сроки, её прирост и биодо-зиметрическая оценка дозы общего облучения с учётом фактора мощности дозы. В результате биодозиметрическая оценка побочной дозы общего облучения у обследованных пациентов варьировала в пределах 104-182 мГр с верхней 95% доверительной границей в диапазоне 410-521 мГр. Статистически значимых различий между оценками побочной дозы в зависимости от времени после введения РФЛП не выявлено (p<0,05).
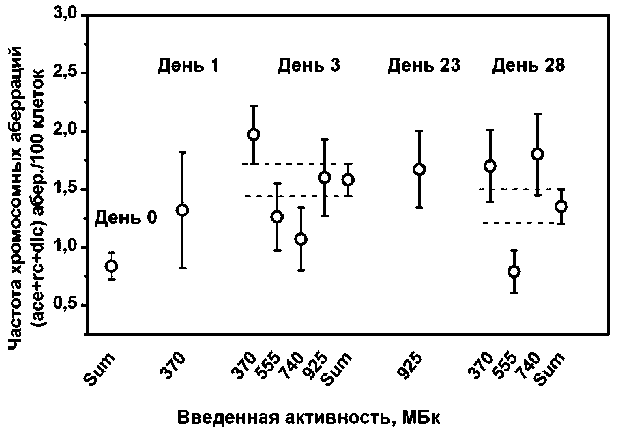
Рис. 3. Частота хромосомных аберраций в подгруппах по величине введенной активности РФЛП и средние по подгруппам на 0, 1, 3, 23 и 28 сут после введения препарата. Sum – средняя величина по всем активностям.
Таблица 4
Частота радиационных маркеров 100 (ace+rc+dic)/Cells и биодозиметрическая оценка дозы общего облучения обследованных пациентов
|
Период, дней |
До введения РФЛП |
T , ч |
После введения РФЛП |
Прирост ∆M±SE* |
G ( T ) |
Доза, мГр (CI**) |
||
|
Cells |
M 1 ±SE* |
Cells |
M 2 ±SE* |
|||||
|
0-1 |
6686 |
0,84±0,11 |
24 |
531 |
1,32±0,50 |
0,48±0,61 |
0,181 |
104 (0-478) |
|
0-3 |
6686 |
0,84±0,11 |
72 |
7302 |
1,58±0,14 |
0,74±0,25 |
0,095 |
162 (0-442) |
|
0-23 |
6686 |
0,84±0,11 |
552 |
1500 |
1,67±0,33 |
0,83±0,45 |
0,085 |
182 (0-521) |
|
0-28 |
6686 |
0,84±0,11 |
672 |
4820 |
1,35±0,15 |
0,51±0,26 |
0,085 |
113 (0-410) |
Примечание: * – стандартная ошибка среднего; ** – 95% доверительный интервал.
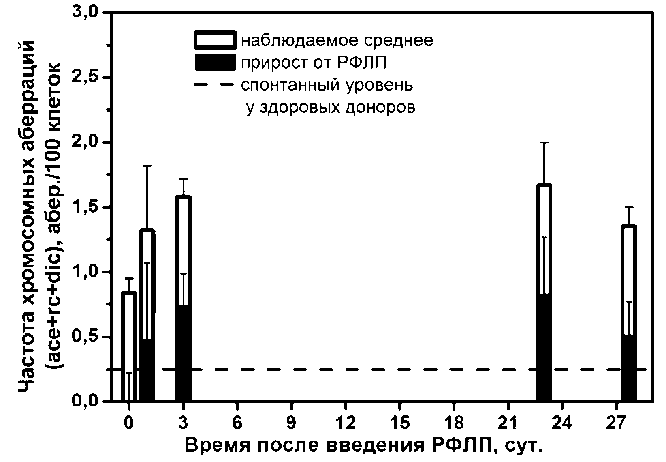
Рис. 4. Средняя частота хромосомных аберраций в подгруппах по величине введённой активности РФЛП и её прирост у обследованных пациентов в различные сроки после введения.
Обсуждение
При обследовании 23 пациентов в настоящей работе частота хромосомных аберраций на день 0 (контроль) составила 0,84±0,11 абер./100 клеток, из них 0,18±0,05 составляли дицентрики. Для сравнения контрольное значение для здоровых людей, оценённое ранее в той же лаборатории [9] было 0,25±0,01 абер./100 клеток, из них 0,044±0,004 составляли дицентрики, т.е. в 3,4 и 4 раза ниже, чем у пациентов до РСЭ по сумме аберраций и дицентрикам соответственно. Похожее соотношение было получено и в аналогичных исследованиях за рубежом. Так, в работе [13] до РСЭ у 10 пациентов, получавших 186Re, и у 13 пациентов, получавших 169Er, контрольное значение частоты дицентриков составляло 0,393±0,062 и 0,229±0,043 диц./100 клеток соответственно. В работе [14] для 10 пациентов, получавших 90Y, оно составило 0,257±0,050 диц./100 клеток. В работе [15] для 20 пациентов, получавших 90Y, контроль составил 0,20±0,07 диц./100 клеток. Согласованное контрольное значение для здоровых людей по данным зарубежной литературы составляет 0,095±0.014 диц./100 клеток [16], т.е. в 2,7-4 раза ниже, чем у пациентов до РСЭ. Таким образом, логично предположить, что пациенты до РСЭ перед забором крови подвергались воздействию ионизирующего излучения с диагностической целью. Возможно, что также имело место последствие агрессивных химических агентов, например, цитостатических препаратов.
Результаты проведённого в настоящей работе цитогенетического обследования пациентов после РСЭ показали, что частота наблюдаемых после введения РФЛП хромосомных аберраций лишь незначительно превышает контроль (день 0) и практически не зависит от величины введенной активности в диапазоне 370-925 МБк. Слабая индукция хромосомных аберраций после введения РФЛП может быть обусловлена в частности особенностью распределения радионуклидов в организме пациента. Ионизирующее воздействие β-излучения 188Re при внутрисуставном введении РФЛП реализуется локально, ограничиваясь лишь областью сустава, в который вводится препарат, с формированием максимальной поглощённой дозы только в синовиальной оболочке. Вместе с тем, вследствие утечки незначительной части РФЛП из суставной сумки в кровяное русло, побочному облучению могут быть подвержены все лимфоциты крови пациента [13, 17]. При радиометрии мочи пациентов в течение 2 сут после внутрисуставного введения «МСА 5-10 мкм, 188Re» утечка препарата составляла не более 2,9% от введённой в сустав активности, что свидетельствовало о крайне незначительном попадании изотопов 188Re в общий кровоток [10]. Существенную роль играет также короткий период эффективного выведения препарата 188Re (17 ч).
Статистический анализ распределений числа хромосомных аберраций по клеткам показал, что существенная часть из них (30,3%) свидетельствует о неравномерном облучении пула лимфоцитов. Формально это проявляется в наличии нескольких метафаз с высокой концентрацией аберраций в одной клетке в пределах до 3-4: пациенты П17, П23 (табл. 2). Наиболее вероятной причиной появления таких клеток является локальное микрораспределение β-излучения 188Re, содержащегося в микросфере, вблизи облучаемой клетки. Подобный эффект наблюдался и в ряде других исследований [13, 14]. Необходимо отметить, что с точки зрения возникновения негативных отдалённых последствий от облучения такого рода, то они крайне маловероятны. Соматические аберрантные клетки с множественными повреждениями нежизнеспособны и обычно гибнут при попытке деления или вследствие апоптоза, не приводя, таким образом, к накоплению мутаций и повышению вероятности канцерогенного перерождения клетки. Кроме того, следует отметить, что клетки с множественными повреждениями могут иметь также вирусное происхождение [18].
C началом применения РСЭ для лечения синовитов риск побочного облучения здоровых органов и тканей изучался при помощи биологической дозиметрии для РФЛП на основе 90Y, 169Er, 166Но и 186Re. Биологическая дозиметрия для РФЛП на основе 188Re в настоящей работе была выполнена впервые. Опыт показывает, что метод биологической дозиметрии является перспективным направлением оценки побочного радиационного риска. В частности, прямое измерение повреждений ДНК в форме одно- и двунитевых разрывов является специфичным и чувствительным показателем. Однако, подобная методика ещё далека от рутинного применения в клинической практике вследствие её сложности и высокой стоимости. Ряд исследований побочного воздействия был выполнен с использованием микроядерного теста, анализа хромосомных аберраций, а также расчётным путем [13]. Несмотря на консолидированное заключение о радиационной безопасности РСЭ, результаты проведённых исследований по биодозиметрии плохо согласовывались друг с другом, приводя к оценкам побочной дозы, хоть и ничтожно низкой, но различающейся в разы. В результате задача совершенствования и уточнения оценки радиационной безопасности проведения РСЭ остаётся востребованной и актуальной.
В настоящей работе в рамках биологической дозиметрии показано, что прирост (индукция) частоты наблюдаемых после введения РФЛП хромосомных аберраций ∆M для каждого из проанализированных ОК статистически значимо не отличается от нуля (p<0,05) (табл. 2). В 8 случаях из 66 (12,1%) данный прирост оказался меньше нуля. Аналогичный результат получился и в работе [19] при анализе частоты дицентриков. Таким образом, в настоящей работе не выявлено ни одного статистически значимого превышения контроля по частоте хромосомных аберраций ни в одной из индивидуальных пар ОК пациентов (день N – день 0). Полученный результат согласуется с заключением, сделанным другими авторами, в аналогичных исследованиях об отсутствии значимых побочных радиационных последствий РСЭ [13-15, 17, 19, 20].
В частности, в работе [13] было проведено исследование побочного радиационного эффекта от РСЭ при введении в лучезапястные суставы РФЛП на основе 186Re с активностью 45-58 МБк. Авторы обследовали 10 пациентов путём забора крови до введения РФЛП и через 17-19 дней с последующим цитогенетическим анализом хромосомных аберраций. Кроме того, они определяли утечку активности из суставной сумки через 3 дня после РСЭ с помощью сцинтиграфии всего тела, которую проводили с использованием гамма-камеры (Bodyscan, MIE). В результате утечка составила в среднем 3,9±7% от введённой активности с максимумом у одного из пациентов до 23,4%. Побочную дозу авторы оценивали не по частоте аберраций, а расчётным методом на основе величины утечки активности. Средняя частота дицентриков до РСЭ составила 0,39±0,06, после неё – 0,57±0,07 диц./100 клеток. Прирост частоты (индукция) составил 0,18 с вариацией до 1,31.
В настоящей работе средняя частота дицентриков до РСЭ была 0,18±0,05, после неё на день 3 – 0,45±0,08 и на день 28 – 0,33±0,08 диц./100 клеток. Таким образом, несмотря на существенные отличия настоящего исследования и работы [13] по РФЛП, вводимой активности, типа сустава для РСЭ и пр., прирост (индукция) частоты дицентриков от РСЭ оказался достаточно близким: 0,18 (максимум 1,31) в работе [13] и 0,15-0,27 (максимум 1,30) в настоящей работе. Однако итоговые оценки побочной дозы в указанных работах существенно различаются. Даже при максимальной утечке РФЛП в работе [13] было получено 13,8 мЗв, что в 7 раз ниже минимальной оценки средней дозы по частоте аберраций у обследованных пациентов в настоящей работе (104 мГр).
В работе [19] было проведено исследование побочного радиационного эффекта от РСЭ при терапии суставов средних размеров с применением РФЛП на основе 186Re с введением 70 МБк. Авторы обследовали 20 пациентов с забором крови до введения РФЛП, через 6, 24 ч и 7 дней с последующим цитогенетическим анализом хромосомных аберраций. Кроме того, было выполнено сканирование всего тела, статическое изображение суставов и локорегионарных лимфатических узлов. Физическая дозиметрия на основе сканирования в гамма-камере показала эффективную побочную дозу 26,7 мЗв. У большинства пациентов (16 из 20) индивидуальная биодозиметрия по частоте аберраций оказалась невозможной из-за низкого уровня аберраций, а для остальных авторы оценили побочную дозу около 200 мГр. В среднем по всей группе частота ди-центриков до РСЭ составила 0,050±0,025, а после РСЭ на день 7 – 0,165±0,041 диц./100 клеток, т.е. средний прирост (индукция) частоты составил 0,115 с вариацией до 0,86.
В работе [14] было проведено исследование побочного радиационного эффекта от РСЭ коленного сустава с применением РФЛП на основе 90Y c введением 188-203 МБк. Авторы обследовали 10 пациентов с забором крови до введения РФЛП и через 11-13 дней с последующим цитогенетическим анализом хромосомных аберраций при инкубировании в течение 48 ч. В среднем по всей группе частота дицентриков до РСЭ составила 0,257±0,051, а после РСЭ – 0,337±0,058 диц./100 клеток, т.е. прирост (индукция) частоты в среднем был 0,080 с довольно высокой вариабельностью. Так, у одного пациента (#03), прошедшего 2 курса РСЭ, прирост частоты дицентриков составил 0,580±0,415 диц./100 клеток [14].
В работе [15] было проведено исследование побочного радиационного эффекта от РСЭ при терапии коленного сустава с применением РФЛП на основе 90Y c введением 111-185 МБк. Авторы обследовали 20 пациентов с забором крови до введения РФЛП и через 6 недель с последующим цитогенетическим анализом хромосомных аберраций. В среднем по всей группе частота дицентриков до РСЭ составила 0,20±0,07, а после нее – 1,43±0,19 диц./100 клеток, т.е. прирост (индукция) частоты в среднем был 1,23.
При анализе проведённых исследований побочного радиационного воздействия от РСЭ с РФЛП на основе рения и иттрия обращает на себя внимание как существенная вариация в оценке побочной дозы при помощи биологической дозиметрии, так и систематическое отличие между оценкой физической дозы по результатам сцинтиграфии и биодозиметрической оценкой побочной дозы по частоте аберраций. При анализе данных фактов необходимо учитывать следующие обстоятельства. Во-первых, эффект побочного радиационного воздействия при РСЭ достаточно мал и сопоставим со спонтанным уровнем исследуемых повреждений, поэтому он сложно выделяется на фоне статистических погрешностей разного рода. Во-вторых, различия в оценке дозы могут быть следствием использования различных методов, в том числе и за счёт вариации таких факторов, как выбор показателя повреждений (разрывы ДНК, микроядра, аберрации хромосом и пр.), интенсивность утечки активности РФЛП в зависимости от качества иммобилизации сустава, время после введения РФЛП, условия культивирования, техника окрашивания, контроль клеточного цикла при анализе аберраций хромосом и др. [13]. Логично высказать предположение, что перечисленные причины вариации при биодозиметрической оценке могут быть сведены к минимуму путём стандартизации протокола приготовления препаратов и использования собственной лабораторной калибровочной зависимости частоты повреждений от дозы [7]. Кроме того, для повышения статистической точности рекомендуется использовать не только дицентрики, а сумму дицентриков и центрических колец, или сумму всех аберраций хромосомного типа (ace+rc+dic).
Анализ проведённых методом биологической дозиметрии исследований последствий РСЭ показывает, что прирост частоты дицентриков после однократного введения РФЛП варьирует в широких пределах от 0,080 до 1,23 диц./100 клеток. Согласно рекомендациям МАГАТЭ [7] для оценки дозы следует использовать оригинальную лабораторную калибровочную зависимость, получение которой для β-излучения 186-188Re и 90Y представляет сложную нетривиальную задачу. По литературным данным такая зависимость была получена в работе [21], что привело к линейному наклону α=2,29±0,28 диц./100 клеток/Гр. Используя это соотношение, характерные средние и максимальные персональные дозы побочного облучения от РСЭ в различных исследованиях можно оценить следующим образом: [13] – <78> максимум 572 мГр; [19] – <50> максимум 376 мГр; [14] – <35> максимум 253 мГр; [15] – <537> мГр; настоящая работа – 66-117 максимум 568 мГр.
Оценки побочной дозы после РСЭ расчётным методом на основе физической оценки активности в теле пациента в целом существенно ниже оценок по биологической дозиметрии и варьируют в пределах 2,8-26,7 мЗв [13, 19, 20]. Причина данного феномена в настоящее время не известна. Она должна быть предметом дальнейших исследований и не является задачей данной работы.
Проведённая в настоящей работе биодозиметрическая оценка общего облучения с учётом эффекта мощности дозы показала, что побочная доза у обследованных пациентов варьирует в пределах 104-182 мГр с верхней 95% доверительной границей в диапазоне 410-521 мГр. Побочная доза внутреннего облучения от РФЛП на основе 131I ранее была рассчитана авторами по аналогичной методике для больных дифференцированным раком щитовидной железы с радикальной тиреоидэктомией и последующей радиойодтерапией (РЙТ) [8]. При этом оценка побочной дозы варьировала в пределах 110-1220 мГр с верхней 95% доверительной границей в диапазоне 1000-1800 мГр. Таким образом, побочная доза от РСЭ на основе 188Re оказалась в среднем в 5 раз ниже по сравнению с РЙТ. Поскольку РЙТ считается в целом безопасным методом лечения [22], то и РСЭ следует классифицировать как процедуру, не имеющую сколь-нибудь значимого риска из-за побочного радиационного воздействия.
Для широкого распространения РСЭ на основе 188Re помимо оценки радиационной безопасности важное практическое значение имеют следующие обстоятельства. Для РСЭ суставов крупного и среднего размера наиболее подходящим является 188Re, который имеет максимальную энергию β-излучения 2,11 MэВ, что обеспечивает среднюю глубину проникновения 3,1 мм (максимально до 10,4 мм). Короткий период полураспада 188Re (17 ч) также обеспечивает безопасность его применения и вместе с этим он достаточен для эффективной реализации терапевтического эффекта. Кроме того, 188Re помимо β-излучения испускает γ-кванты (155 кэВ), что позволяет вместе с терапевтическим воздействием выполнять радионуклидную визуализацию при помощи гамма-камеры или совмещённого с рентгеновским аппаратом компьютерного томографа (ОФЭКТ/КТ).
Несомненным достоинством 188Re является возможность его получения из 188W/188Re радионуклидного генератора. Указанная генераторная система позволяет размещать её непосредственно в клинике, что делает метод более доступным. Одним из препятствий для более широкого применения 188Re является получение радионуклида 188W, который может быть наработан только в реакторах с высоким потоком нейтронов, которых существует всего три: HFIR в Ок-Ридже, США; SM3 в Димитровграде, Россия и BR2 в Моле, Бельгия.
Заключение
Результаты проведённого исследования показали, что при радиосиновэктомии коленного сустава с однократным внутрисуставным введением препарата «МСА 5-10 мкм, 188Re» побочное радиационное воздействие на пациента не представляет опасности, поскольку побочная доза не превышает воздействия от естественного радиационного фона.


