Оценка ранозаживляющего действия экстракта черных листьев бадана толстолистного при экспериментальном термическом ожоге
Автор: Тыхеев А.А., Жамсаранова С.Д., Путункеева Ю.С., Игнатьева М.В., Лебедева С.Н.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 9, 2019 года.
Бесплатный доступ
В работе изучались морфологические особенности заживления ожоговой раны при применении экстракта черных листьев бадана толстолистного. Эксперимент проводился на беспородных белых крысах массой 180-200 г на модели экспериментального термического ожога. Анализ репарации раневой поверхности проводили на 6-, 13- и 20-е сутки с момента травмы. Лабораторные животные, используемые в эксперименте, были разделены на три группы с учетом пола, возраста, массы и принципа рандомизации. В контрольной группе животных без лечения выявлена выраженная гиперемия с коагуляционным некрозом, проникновением гнойного экссудата в глубокиеслои кожи, характеризующаяся большей толщиной лейкоцитарно-некротического струпа и меньшей высотой грануляционной ткани. Установлено, что под влиянием экстракта черных листьев бадана толстолистного заживление протекало интенсивнее, чем в контрольной группе, что выражается меньшей толщиной лейкоцитарно-некротического струпа, ускорением эпителизации и полным закрытием кожного дефекта...
Термический ожог, морфометрические показатели, экстракт черных листьев бадана толстолистного
Короткий адрес: https://sciup.org/140245701
IDR: 140245701 | УДК: 591.
Текст научной статьи Оценка ранозаживляющего действия экстракта черных листьев бадана толстолистного при экспериментальном термическом ожоге
Введение. В связи с техногенными авариями, расширением производства, развитием транспортных средств, ростом урбанизации населения и увеличением природных катаклизмов ожоги стали представлять серьезную медицинскую, социальную и экономическую проблему мирного времени. Проблема восстановления обширных раневых дефектов в результате ожога была и остается одной из самых актуальных в современной медицине [1–3].
По данным Всемирной организации здравоохранения (ВОЗ), ожоги занимают третье место в структуре травматизма мирного времени, а в некоторых странах даже второе место по частоте среди прочих травм. В России в 2015 г. зарегистрировано около 300 тыс. случаев ожоговой травмы (Данные Росстата, 2015). Тяжесть ожога зависит не только от глубины, но и от его площади. Лечение в условиях стационара ежегодно проходят около 100 тыс. пациентов с термическими поражениями, из которых 60–80 % – поверхностные и пограничные ожоги [4–6]. При лечении ожогов II и III «а» степени тяжести в большинстве случаев используют местное лечение. На сегодняшний день широкое распространение в лечении ожоговых ран получили мази на водорастворимой основе: левомеколь, левомисин, левонорсин, диоксиколь и другие [7– 9]. Наряду с положительным эффектом данных мазей отдельные из них могут обладать аллергическими, тератогенными свойствами и оказывать мутагенное влияние. Широкое распространение устойчивых штаммов ко многим бактерицидным веществам и возможность их эпидемического распространения являются серьезной проблемой для построения эффективной антибактериальной терапии. Для решения этих задач перспективным является возможность использования лекарственных средств, которые содержат широкий набор биологически активных веществ различной природы. Эти проблемы вынуждают специалистов все чаще обра- щаться к естественным природным средствам, получаемым из растений, которые, воздействуя комплексно, стимулируют прежде всего защитные силы организма. А также являются более эффективными в комбинации с низкомолекулярными биоцидными веществами, традиционно используемыми стандартами лечения [10– 12]. Одним из таких средств является экстракт из черных листьев бадана толстолистного. В данной работе были использованы черные прошлогодние листья бадана толстолистного, которые могут быть собраны без ущерба (флоре) популяции и экологии.
Цель исследований . Изучение морфологических особенностей заживления ожоговой раны экспериментальных животных при применении экстракта черных листьев бадана толстолистного.
Материал и методы исследований. Из черных сухих листьев бадана толстолистного был приготовлен экстракт. Измельченные листья бадана заливали кипящей водой (1:10) и встряхивали в течение 10 минут, далее обрабатывали ультразвуком в течение 20 минут и фильтровали [13]. Эксперименты по моделированию термического ожога проводились на 40 беспородных белых крысах обоего пола массой 180–200 г в виварии университета. Содержание животных соответствовало «Правилам лабораторной практики (GLP)» и Приказу МЗРФ № 708 Н от 23. 08. 2010 г. «Об утверждении правил лабораторной практики». Лабораторные животные, используемые в эксперименте, были разделены на три группы с учетом пола, возраста, массы и принципа рандомизации: контрольная группа – ожог и самостоятельное заживление; I опытная группа – ожог и обработка раны экстрактом черных листьев бадана толстолистного; II опытная группа – ожог и обработка раны мазью левомеколь, которую использовали в качестве препарата сравнения. Экспериментальную работу проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР № 755 от 12. 08. 1977 г.), «Правилами, принятыми в Европейской конвенции по защите позвоночных животных» (Страсбург, 1986). Животным после удаления волосяного покрова в области туловища с правой стороны под эфирным наркозом вызывали термический ожог горячей жидкостью (вода) 100 °С в пробирке. Время экспозиции составляло 10 секунд с определенной глубиной ожога и охватом подкожного слоя.
Раневое покрытие не удаляли до полного заживления раневой поверхности. Ежедневно с помощью прозрачной пленки и миллиметровой бумаги определяли размеры кожного дефекта [14], оценивали внешний вид ран, наличие и характер отделяемого, вид струпа, отмечали сроки полного заживления ран. Анализ репарации и воздействия на раневую поверхность разных лекарственных форм проводили на 6-, 13- и 20-й день с момента травмы. Гистологические срезы толщиной 7 мкм для обзорного анализа окрашивали гематоксилином и эозином по Эрлиху, для выявления коллагеновых волокон пикрофуксином по Вейгерту – по методу Ван-Гизон.
Промеры толщины структуры кожного покрова и других клеточных включений – толщину эпидермиса, дермиса, эпителия волосяных фолликул, лейкоцитарного вала, грануляционной ткани – и количество клеток фибробласт измеряли с использованием микроскопа Axiostar plus, видеокамеры для микроскопа MICROCAM – по программе Micromed images 1,0. Корреляционный анализ данных проводили внутри экспериментальных групп по Пирсону. Полученные цифровые данные подвергали статистической обработке на персональном компьютере с помощью программы «Micromed Excel». Для подсчета клеточных структур фибробластов использовали микроскоп тринокулярный Axiostar plus в 8 полях зрения по общепринятой методике. Достоверность полученных результатов определяли с помощью критерия Стьюдента (Лакин Л.Ф., 1990) и считали достоверным при Р < 0,05.
Результаты исследований и их обсуждение. В результате экспериментального термического поражения формировался ожог III «а» степени площадью 4–5 % от полной поверхности тела. Площадь ожоговой раны составляла 3,0–4,0 см². День нанесения ран животным считали нулевым. Площади ожоговых ран в динамике заживления определяли методом планиметрии, данные представлены на рисунке 1.
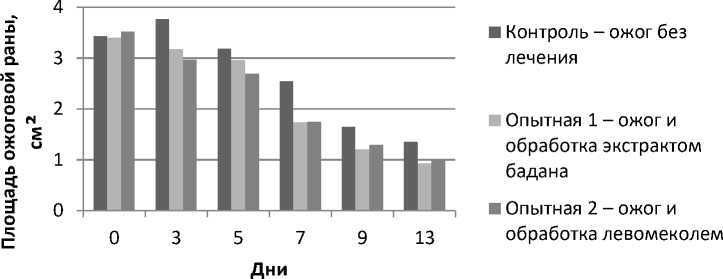
Рис. 1. Влияние экстракта черных листьев бадана и левомеколя на динамику изменения площади ожоговой раны у экспериментальных животных
Из данных, представленных на рисунке 1, следует, что площади ран животных I, II опытных групп, начиная с 3-го дня опыта, статистически значимо отличались от результатов контрольной группы. При этом уменьшение площади ран в наибольшей степени было выражено у животных I опытной группы. Это свидетельству- ет о выраженном репаративном действии растительного средства. Результаты гистологических исследований подтвердили более быструю регенерацию поврежденных участков кожи у животных, обработанных экстрактом черных листьев бадана толстолистного.
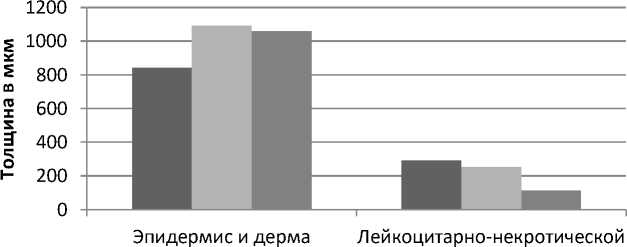
Контрольная
I опытная
II опытная струп
Рис. 2. Динамика изменений толщины эпидермиса и дермы, лейкоцитарно-некротического струпа ожога животных под влиянием экстракта черных листьев бадана и левомеколя на 6-е сутки эксперимента
В таблице 1 и на рисунке 2 представлены морфометрические данные ран животных после термического ожога на 6-е сутки заживления. Из данных, представленных на рисунке 2, следует, что высота эпидермиса и дермы, толщина лейкоцитарно-некротического струпа ран животных
I, II опытных групп на 6-е сутки эксперимента статистически значимо отличались от результатов контрольной группы. При этом уменьшение лейкоцитарно-некротического струпа в наибольшей степени выражено у животных II опытной группы, обработанных левомеколем.
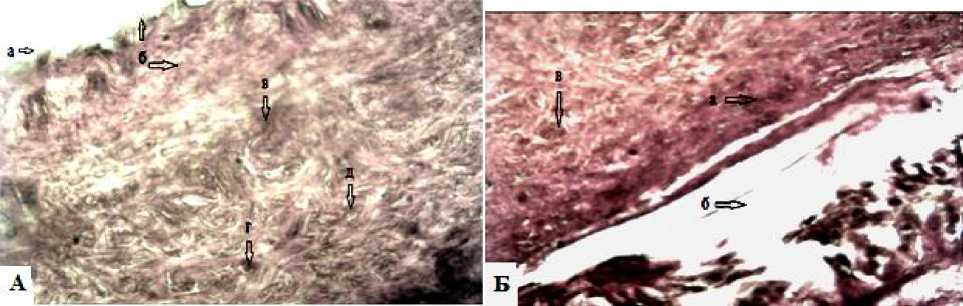
Рис. 3. Контрольная группа крыс без лечения с сильной гиперемией, коагуляционным некрозом эпидермиса и дермы с явлениями отека и инфильтрации, стертость границ между слоями на 6-е сутки: А: а – гнойный экссудат; б – лейкоцитарно-некротический пласт поверхностного слоя; в – коагуляционный некроз с отеком; г – остатки сальных желез. Окраска гематоксилин и эозин (ув.об.10х10); Б: а – струп; б – отслоение струпа от гиподермы; в – остатки сальных желез. Окраска по Ван-Гизону (ув.об.10х10)
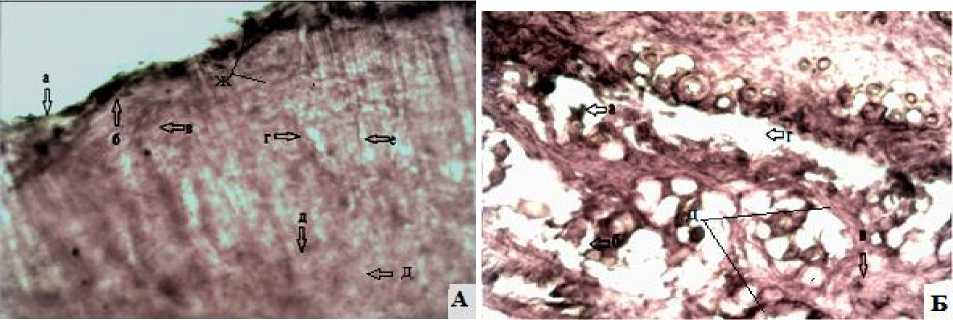
Рис. 4. Опытные группы животных с выраженной гиперемией, отеком с явлениями некротических поражений кожи на 6-е сутки: А – I опытная группа – обработка раны экстрактом бадана: а – гнойный экссудат; б – роговой; в – зернистый; г – шиповатый; д – базальный слой с выростами; е – сосочковый слой; ж – лейкоцитарно-некротический пласт поверхности кожи. Окраска гематоксилин и эозин (ув.об. 10х10); Б – II опытная группа – обработка раны левомеколем; а – остатки сальных желез; б – сосочковый слой; в – новая грануляционная ткань; г – отслоение дермы от гиподермы; д – отек с явлениями инфильтрации. Окраска по Ван-Гизону (ув.об.10х10)
В таблице 2 и на рисунке 5 представлены данные морфометрических исследований ран экспериментальных групп животных на 13-е сутки эксперимента.
Из данных, представленных на рисунке 5, следует, что высота эпидермиса и дермы, толщина лейкоцитарно-некротического струпа ожо- га животных I, II опытных групп на 13-е сутки эксперимента значимо отличались от результатов контрольной группы. При этом увеличение высоты эпидермиса и дермы, уменьшение лейкоцитарно-некротического струпа ожоговых ран животных в опытных группах I, II значимо не отличались.
Таблица 1
Морфометрические данные ран животных разных групп после термического ожога и воздействия экстракта черных листьев бадана толстолистного и левомеколя на 6-е сутки эксперимента (n=40)
|
Группа животных |
Толщина эпидермиса, мкм |
Толщина дермы, мкм |
Толщина эпидермиса и дермы, мкм |
Толщина грану-ляцион. ткани, мкм |
Фибробласты дермы, кол-во |
Лейкоцитарнонекротический струп, мкм |
Эпителий волосяных фолликул, мкм |
|
Интактная |
285,59±49,61 |
1140,4±24,65 |
1350,25±16,95 |
- |
37,67±1,09 |
- |
14,74±1,46 |
|
Контрольная |
- |
- |
840,78±45,25* |
- |
13,67±0,67* |
290,75±30,06 |
- |
|
I опытная |
210,16±25,04 |
772,48±23,12 |
1091,64±18,0** |
- |
15,00±0,52** |
253,75±30,22** |
- |
|
II опытная |
212,1±60,1 |
848,0±23,1 |
1060,1±67,0*** |
487,4±23,9 |
15,67±1,26*** |
112,20±10,24*** |
11,7±0,97 |
Примечание : достигнутый уровень значимости при сравнении средних показателей ожоговых ран после местного лечения: * – относительно интактной группы Р<0,05; ** – относительно контрольной группы I Р<0,05; *** – относительно контрольной группы II Р<0,05.
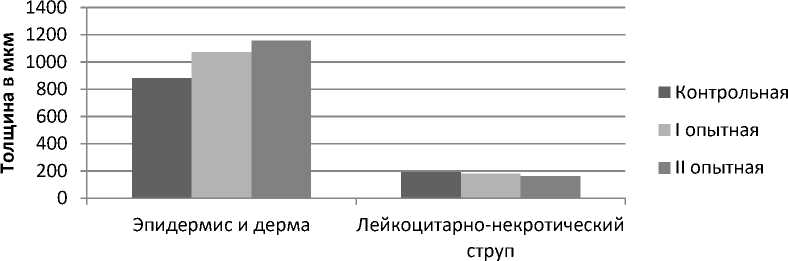
Рис. 5. Динамика изменений толщины эпидермиса и дермы, лейкоцитарно-некротического струпа при термическом ожоге животных под влиянием экстракта черных листьев бадана и левомеколя на 13-е сутки эксперимента
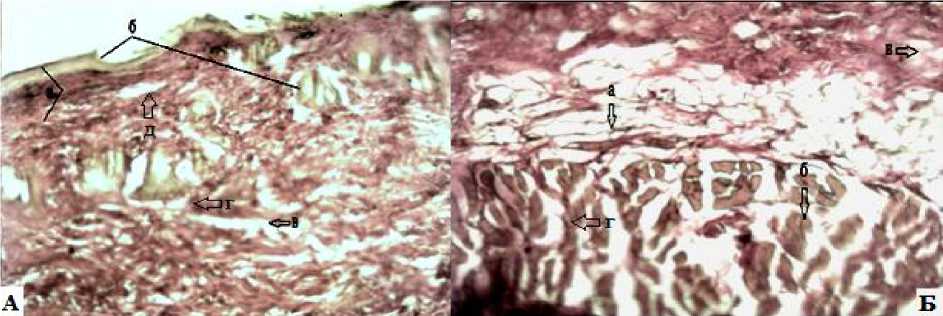
Рис. 6. Контрольная группа животных с выраженной гиперемией, отеком с явлениями деструкции волокон на 13-е сутки: А: а – толщина лейкоцитарно-некротического струпа; б – гнойный экссудат; в – признаки отслоения эпидермиса от дермы; г – сосочковый слой неправильной формы; Б: граница дермы и гиполермы: а – образование сетчатого слоя дермы; б – деструкция и разрыхление коллагеновых волокон; в – гиперемия и отек на дне ожога. Окраска по Ван-Гизону
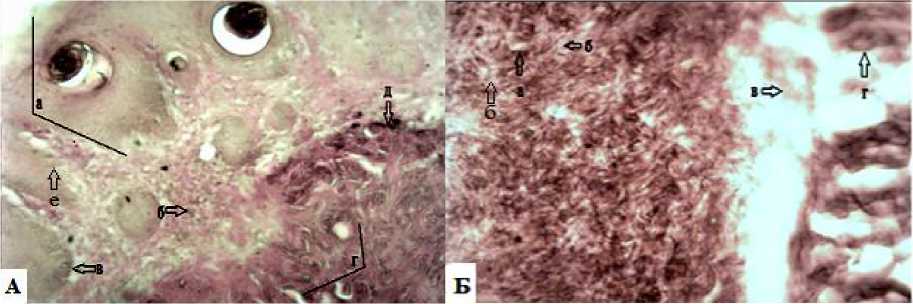
Рис. 7. Опытные группы животных на 13-е сутки: А – I опытная группа – применение экстракта бадана: гиперемия с гнойным экссудатом в эпидермисе и инфильтративными процессами в глубокие слои кожи: а – лейкоцитарно-некротический струп; б – клетки полибласты; в – многослойный плоский эпителий; г – горизонтальные сосудистые петли; д – клетки фибробласты; е – сосочковый слой; Б – II опытная группа – лечение ожоговой раны левомеколем: сохраняется небольшая гиперемия с признаками шелушения и отслоением дермы от гиподермы; а – фибробласты; б – полнокровие кровеносного сосуда; в – отслоение дермы от гиподермы; г – гиподерма.
Окраска по Ван-Гизону (ув.об.10х10)
Таблица 2
Морфометрические данные ран животных разных групп после термического ожога и воздействия экстракта черных листьев бадана толстолистного и левомеколя на 13-е сутки эксперимента (n=40)
|
Группа животных |
Толщина эпидермиса, мкм |
Толщина дермы, мкм |
Толщина эпидермиса и дермы, мкм |
Толщина грануля-цион. ткани, мкм |
Фибробласты дермы, кол-во |
Лейкоцитарнонекротический слой, мкм |
Эпителий волосяных фолликул, мкм |
|
Интактная |
285,5±24,92 |
1140,0±10,06 |
1350,25±16,95 |
- |
37,67±1,09 |
- |
14,74±1,46 |
|
Контрольная |
145,15±9,55* |
785,09±40,38* |
880,67±15,14* |
- |
13,83±0,65 |
191,78±29,68* |
- |
|
I опытная |
214,8±15,83** |
859,17±24,47** |
1073,1±18,12** |
976,19±30,57 |
14,67±0,67** |
181,54±9,48** |
5,58±0,66 |
|
II опытная |
211,0±15,4*** |
844,15±65,0*** |
1155,6±40,2*** |
988,40±39,57 |
21,17±1,14*** |
162,23±23,26*** |
10,6±0,61 |
Примечание : достигнутый уровень значимости при сравнении средних показателей ожоговых ран после местного лечения: * - относительно интактной группы Р<0,05; ** - относительно контрольной группы I Р<0,05; *** - относительно контрольной группы II Р<0,05.
В таблице 3 и на рисунке 8 представлены вого повреждения экспериментальных групп данные морфометрических исследований ране- животных на 20-е сутки заживления.
га
5 г
О
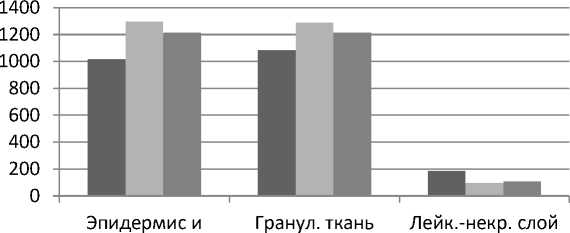
Контрольная
I опытная
II опытная дерма
Рис. 8. Динамика изменений толщины эпидермиса и дермы, грануляционной ткани, лейкоцитарно-некротического слоя при термическом ожоге животных под влиянием экстракта черных листьев бадана и левомеколя на 20-е сутки эксперимента
Из данных, представленных на рисунке 8, следует, что высота эпидермиса и дермы, грануляционной ткани, лейкоцитарнонекротического слоя раны животных I, II опытных групп на 20-е сутки эксперимента значимо отличались от результатов контрольной группы.
При этом увеличение высоты эпидермиса и дермы, грануляционной ткани и уменьшение толщины лейкоцитарно-некротического слоя в наибольшей степени выражены у животных I опытной группы, обработанных экстрактом черных листьев бадана толстолистного.
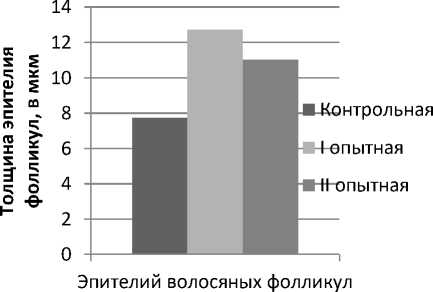
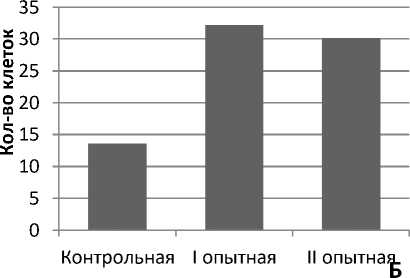
Рис. 9. Динамика изменений толщины эпителия фолликул и количества клеток при термическом ожоге животных под влиянием черных листьев бадана и левомеколя на 20-е сутки эксперимента: А – толщина эпителия волосяных фолликул; Б – количество клеток фибробластов дермы крыс
Из данных, представленных на рисунке 9 (А, Б), следует, что толщина эпителия волосяных фолликул, количество клеток фибробластов в I, II опытных групп животных значимо отличались от таковых в контрольной группе. При
этом увеличение толщины эпителия волосяных фолликул, количество клеток фибробластов дермы в наибольшей степени выражены у животных I опытной группы, обработанных экстрактом черных листьев бадана толстолистного.
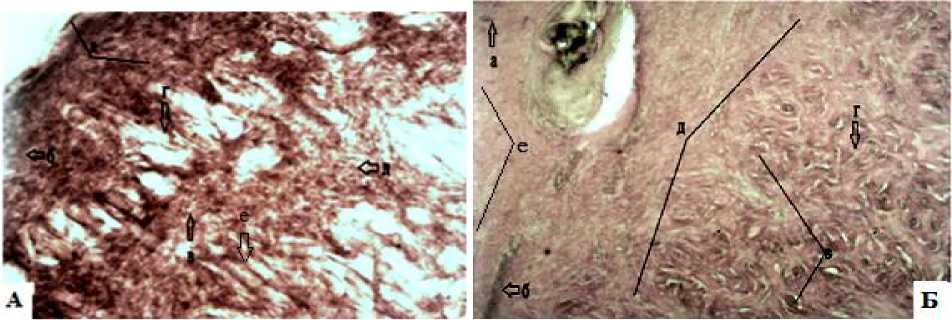
Рис. 10. В контрольной группе животных сохраняется небольшая гиперемия с гнойным экссудатом и локальное появление волосяных фолликул на 20-е сутки: А: а – лейкоцитарнонекротический струп; б – небольшой гнойный экссудат; в – клетки полибласты; г – сосочки из дермы; д – клетки фибробласты; е – фолликулы волос; Б: а – единичные фибробласты; б – волосяные фолликулы; в – остатки сальных желез; г – полибласты; д – грануляционная ткань; е – гнойный экссудат. Окраска по Ван-Гизону (ув.об.10х10)
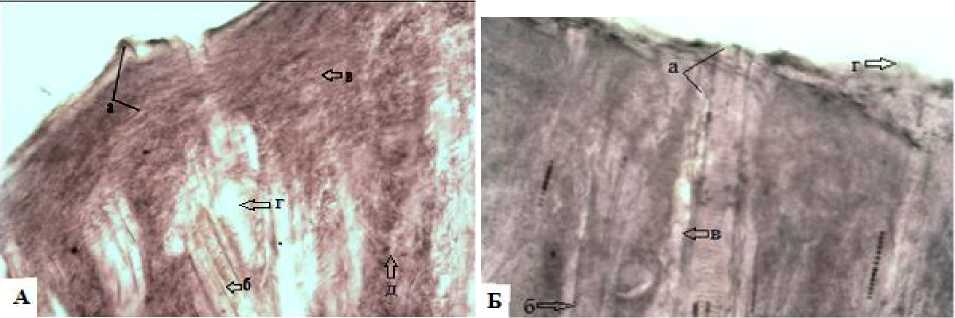
Рис. 11. Опытные группы животных, эпидермис и дерма на 20-е сутки: А – I опытная группа – обработка термического ожога экстрактом бадана: а – лейкоцитарно-некротический слой; б – волосяные фолликулы; в – грануляционная ткань; г – сосочковый слой; д – клетки фибробласты. Окраска по Ван-Гизону (ув.об.10х10); А – II опытная группа – состояние термического ожога при применении мази левомеколь (препарат сравнения); Б: а – лейкоцитарно-некротический струп; б – эпителий волосяных фолликул; в – сосочковый слой из дермиса; г – гнойный экссудат. Окраска гематоксилин и эозин (ув.об.10х10)
Таблица 3
Морфометрические данные ран животных разных групп после термического ожога и воздействия экстракта черных листьев бадана толстолистного и левомеколя на 20-е сутки эксперимента (n = 40)
|
Группа животных |
Толщина эпидермиса, мкм |
Толщина дермы, мкм |
Толщина эпидермиса и дермы, мкм |
Толщина грануляционной ткани, мкм |
Фибробласты дермы, кол-во |
Лейкоцитарнонекротический слой, мкм |
Эпителий волосяных фолликул, мкм |
|
Интактная |
285,59±24,92 |
1140,05±104,65 |
1350,25±16,95 |
- |
37,67±1,09 |
- |
14,77±1,46 |
|
Контрольная |
195,15±24,7* |
780,56±24,05* |
1015,7±35,16* |
1085,14±22,64 |
13,67±0,67* |
187,35±12,46 |
7,73±1,02* |
|
I опытная |
242,10±16,4** |
899,28±24,73** |
1294,14±94,1** |
1287,41±33,50** |
32,17±3,67** |
94,00±0,67** |
12,73±0,86** |
|
II опытная (сравнение) |
224,8±15,8*** |
968,61±65,0*** |
1213,6±40,7*** |
1215,11±30,4*** |
30,17±1,87*** |
106,25±11,58*** |
11,01±1,2*** |
Примечание : достигнутый уровень значимости при сравнении средних показателей ожоговых ран после местного лечения: * – относительно интактной группы Р<0,05; ** – относительно контрольной группы I Р<0,05; *** – относительно контрольной группы II Р<0,05.
Заключение. Гистоморфологический анализ результатов экспериментального исследования показал, что у всех подопытных крыс под влиянием термического воздействия развился однотипный термический ожог III «а» степени. Выявлены глубокие деструктивные и дистрофические процессы во всех слоях кожи с полной гибелью волосяных фолликул, потовых и сальных желез. На большинстве участков раневой поверхности наблюдали коагуляционный некроз всех слоев кожи, а также волокон подкожной мышцы.
В нашем исследовании на 20-е сутки эксперимента в контрольной группе животных без лечения при микроскопии наблюдали на поверхности кожи и в глубоких слоях эпидермиса выраженный гнойный экссудат, отмечалась локальная стертость границ . В области термического ожога наблюдалась гиперемия с отеком соединительной ткани и полнокровием сосудов. Отмечали очаговое появление волосяных фолликул с тонким эпителием толщиной 7,73± 1,02 мкм (р<0,05). По данным исследования, толщина грануляционной ткани в контрольной группе животных на 13-е сутки эксперимента не определялась. А на 20-е сутки в контрольной группе животных на всем протяжении раневого повреждения от дна раны и до поверхностного слоя эпидермиса наблюдался воспалительный струп с участками грануляции, размеры его составили в среднем 1085,40±33,50 мкм ( р<0,05). В контрольной ране на 20-е сутки наблюдали вал из полиморфных лейкоцитов, ограничивающих струп от раневой поверхности, высота которого составила в среднем 187,35±12,46 микрометров. Имели место инфильтрация раны и макрофагальная реакция иммунной системы организма крыс.
При морфологическом исследовании образцов тканей кожи после термического ожога животных I опытной группы, на раны которых наносили экстракт листьев бадана толстолистного, наблюдали иную гистологическую картину, чем при исследовании таковых у животных II опытной группы. В зоне термического ожога на 6-е; 13-е сутки отмечали признаки воспаления – локальный гнойный экссудат с проникновением в глубокие слои дермы. При лечении ожога экстрактом листьев бадана толстолистного в зоне воздействия явно преобладала развитая мак- рофагальная реакция. На 20-е сутки эксперимента в I опытной группе животных при лабораторном исследовании срезов наблюдали зрелый эпидермис без признаков гиперемии и отека. Эпителиальная ткань была зрелая, чистая и ровная, строение регенерата приближалось к строению здоровой кожи животных интактной группы. Наружная поверхность кожи была заполнена грануляционной тканью слабо-розового цвета с зернистой структурой и толщиной в среднем 1287,41±33,50 мкм (р<0,05). В дермисе отмечали многочисленные участки с произрастаниями волосяных фолликул с тонкими эпи-телиями толщиной в среднем 12,73±0,86 мкм (р<0,05).
При гистологическом исследовании срезов кожи животных II экспериментальной группы, на раны которых наносили мазь левомеколь – препарат сравнения, на 13-е сутки эксперимента отмечали тонкий слой струпа с признаками некроза. На поверхности эпидермиса на 13-е; 20-е сутки наблюдения имелся гнойный экссудат с явлениями локального шелушения кожи. На 20-е сутки эксперимента поверхность дна ожоговой раны была покрыта эпителиальным слоем, сохранялась небольшая гиперемия с отсутствием признаков отека. Края эпителия неровные, что указывало на продолжение патологических процессов. Вместе с тем отмечалось формирование волосяных фолликул с тонким эпителием, размеры которого составили в среднем 11,01±1,27 мкм, лейкоцитарнонекротический струп в зоне воспаления в поверхностном слое кожи имел толщину в среднем 106,25±11,58 мкм. В группе сравнения на 20-е сутки эксперимента при традиционном лечении термического ожога мазью левомеколь количество фибробластов в 8 полях зрения составило в среднем 30,00±0,52 клеток.
В работах, представленных И.Н. Большаковым и др. (2011), Н.С. Поповым и др. (2014), отмечалось, что быстрой смене фаз заживления ожоговой раны способствует меньшее значение толщины лейкоцитарно-некротического струпа. Значение толщины лейкоцитарно-некротического струпа, по данным И.Н. Большакова и др., в ранах без лечения составило 193,26±8,83 против 58,68±5,39 мкм при лечении коллагенхитозановым комплексом [15]. По данным Н.С. Попова и др. (2014), на 10-е сутки эксперимента у животных контрольной группы ожоговая поверхность была покрыта фрагментированным струпом толщиной 150,85±12,34 мкм, под которым наблюдали лейкоцитарный вал (88,48±10,68 мкм). Толщина грануляционной ткани составила 814,80±20,20 мкм, а ее верхний слой был пронизан сосудами [16].
Аналогичные результаты получены С.А. Бу-лоян (2015), в работе которого отмечается, что гистоструктура эпидермальной ткани полностью восстанавливалась на 21-й день после травмы при применении мази дермафен на фоне термического ожога крыс: происходило полное заживление ожоговой раны и восстановление волосяного покрова. Таким образом, можно заключить, что ожоговая травма представляет собой особо сложный процесс, в котором при заживлении раны реализуются различные механизмы, такие как, например: коагуляция, воспаление, формирование грануляционной ткани, накопление коллагена, эпителизация, сокращение раны и др. [17].
Выводы
-
1. Экспериментальный термический ожог в контрольной группе животных без лечения протекал с воспалительными осложнениями по типу неполной репаративной регенерации и формированием грануляционной ткани с очаговыми струпьями.
-
2. Применение при термическом ожоге экстракта черных листьев бадана способствовало более быстрому очищению раны от некротизированных тканей, ускорению репаративных процессов без побочных эффектов, это было более выражено на конечных этапах термического ожога.
-
3. Репаративные процессы при использовании экстракта черных листьев бадана, обусловленные ограничением деструкции волокон в эпидермисе и дерме, равномерным созреванием грануляционной ткани, отсутствием гнойнонекротических осложнений в процессе заживления дефекта кожи и ее эпителизацией на постоянную соединительную ткань, не уступали по эффективности фармакопейному препарату левомеколь.
Вестник КрасГАУ. 2019. № 9 Литература
-
1. Сидельников В.О., Парамонов С.Н., Татарин С.Н. О медицинской помощи обожженным военных конфликтах // Военномедицинский журнал. – 2002. – № 7. – С. 35–39.
-
2. Термические и радиационные поражения: руководство для врачей / под ред. Л.И. Герасимова, Г.И. Назаренко . – М., 2005. – 384 с.
-
3. Фисталь Э.Я., Козинец Г.П. К вопросу о
терминологии и классификации в комбус-тиологии // Съезд комбустиологов России: мат-лы съезда. – М., 2005. – С. 32–33.
-
4. Здравоохранение в России: стат. сб. – М.: Росстат, 2015. – 174 с.
-
5. Унижаева А.Ю., Мартынчик С.А. Медикоэкономическая оценка затрат и качества стационарной помощи при ожоговой травме // Социальные аспекты здоровья населения. – 2012. – № 28. – URL: http: //vestnik. mednet. ru (дата обращения: 06. 07. 2017).
-
6. Алексеев А.А., Тюрников Ю.И. Основные статистические показатели ожоговых стационаров Российской Федерации за 2015 год // Термические поражения и их последствия: мат-лы Всерос. науч.-практ. конф. с междунар. участием (28–29 сентября 2016, Ялта). – Ялта, 2016. – С. 17–20.
-
7. Муразян Р.И., Панченков Н.Р. Экстренная помощь при ожогах. – М.: Медицина, 2003. – 127 с.
-
8. Алексеев А.А., Бобровников А.Э., Хунафин С.Н. Лечение поверхностных и пограничных ожоговых ран с применением современных раневых повязок // Медицинский вестник Башкорстана. – 2013. – № 8 (3). – С. 25–30.
-
9. Крутиков М.Г., Рахаев А.М. Современные методы лечения пограничных ожогов III а степени и донорских ран // Камбустиология. – 2000. – № 3. – URL: http://Сombustiolog.ru (дата обращении: 09. 11. 2017).
-
10. Машковский М.Д. Лекарственные средства: в 2 т. – М.: Медицина, 2003. – Т. 2. – 576 с.
-
11. Малкандуев Ю.А., Хаширова С.Ю., Сарба-шева А.И. [и др.]. Структура гуанидинсодержащих (СО) полимеров и их биоцидные и токсические свойства // Известия вузов. Северо-Кавказский регион. Естественные науки. – 2012. – № 2. – С. 71–75.
-
12. Коваленко В.В., Корсун В.Ф . Современный русский травник. – М.: Рипол классик, 2007. – 382 с.
-
13. Гаврилова А.А., Жамсаранова С.Д., Лебедева С.Н. [и др.]. Сравнительная оценка ранозаживляющего действия комплексного средства на основе синтетических и природных компонентов // Биотехнология в интересах экологии и экономики Сибири и Дальнего Востока: мат-лы V Всерос. науч.-практ. конф. – Улан-Удэ, 2018. – С. 20–27.
-
14. Каркищенко Н.Н. Лабораторные животные положение и руководство. – М.: ВПК, 2003. – 138 с.
-
15. Большаков И.Н., Сапожников А.Н., Еремеев А.В . [и др.]. Биодеградируемые раневые покрытия на основе полисахаридных полимеров (экспериментальное исследование) // Экспериментальная хирургия. – 2011. – № 2 (37). – С. 53–65.
-
16. Попов Н.С., Демидова М.А., Шестакова В.Г. [и др.]. Морфологические изменения в коже крыс при наружном применении экстракта пиявки медицинской при термическом ожоге // Верхневолжский журнал. – 2014. – Т. 12, вып. 2. – С. 45–49.
-
17. Булоян С.А. Действие мази дермафен на регенераторные процессы кожи белых крыс после экспериментального термического ожога // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 10-2. – С. 268–272.
Список литературы Оценка ранозаживляющего действия экстракта черных листьев бадана толстолистного при экспериментальном термическом ожоге
- Сидельников В.О., Парамонов С.Н., Татарин С.Н. О медицинской помощи обожженным военных конфликтах // Военно-медицинский журнал. - 2002. - № 7. - С. 35-39.
- Термические и радиационные поражения: руководство для врачей / под ред. Л.И. Герасимова, Г.И. Назаренко. - М., 2005. - 384 с.
- Фисталь Э.Я., Козинец Г.П. К вопросу о терминологии и классификации в комбустиологии // Съезд комбустиологов России: мат-лы съезда. - М., 2005. - С. 32-33.
- Здравоохранение в России: стат. сб. - М.: Росстат, 2015. - 174 с.
- Унижаева А.Ю., Мартынчик С.А. Медико-экономическая оценка затрат и качества стационарной помощи при ожоговой травме // Социальные аспекты здоровья населения. - 2012. - № 28. - URL: http: //vestnik. mednet. ru (дата обращения: 06. 07. 2017).
- Алексеев А.А., Тюрников Ю.И. Основные статистические показатели ожоговых стационаров Российской Федерации за 2015 год // Термические поражения и их последствия: мат-лы Всерос. науч.-практ. конф. с междунар. участием (28-29 сентября 2016, Ялта). - Ялта, 2016. - С. 17-20.
- Муразян Р.И., Панченков Н.Р. Экстренная помощь при ожогах. - М.: Медицина, 2003. - 127 с.
- Алексеев А.А., Бобровников А.Э., Хунафин С.Н. Лечение поверхностных и пограничных ожоговых ран с применением современных раневых повязок // Медицинский вестник Башкорстана. - 2013. - № 8 (3). - С. 25-30.
- Крутиков М.Г., Рахаев А.М. Современные методы лечения пограничных ожогов III а степени и донорских ран // Камбустиология. - 2000. - № 3. - URL: http://Сombustiolog.ru (дата обращении: 09. 11. 2017).
- Машковский М.Д. Лекарственные средства: в 2 т. - М.: Медицина, 2003. - Т. 2. - 576 с.
- Малкандуев Ю.А., Хаширова С.Ю., Сарбашева А.И. [и др.]. Структура гуанидинсодержащих (СО) полимеров и их биоцидные и токсические свойства // Известия вузов. Северо-Кавказский регион. Естественные науки. - 2012. - № 2. - С. 71-75.
- Коваленко В.В., Корсун В.Ф. Современный русский травник. - М.: Рипол классик, 2007. - 382 с.
- Гаврилова А.А., Жамсаранова С.Д., Лебедева С.Н. [и др.]. Сравнительная оценка ранозаживляющего действия комплексного средства на основе синтетических и природных компонентов // Биотехнология в интересах экологии и экономики Сибири и Дальнего Востока: мат-лы V Всерос. науч.- практ. конф. - Улан-Удэ, 2018. - С. 20-27.
- Каркищенко Н.Н. Лабораторные животные положение и руководство. - М.: ВПК, 2003. - 138 с.
- Большаков И.Н., Сапожников А.Н., Еремеев А.В. [и др.]. Биодеградируемые раневые покрытия на основе полисахаридных полимеров (экспериментальное исследование) // Экспериментальная хирургия. - 2011. - № 2 (37). - С. 53-65.
- Попов Н.С., Демидова М.А., Шестакова В.Г. [и др.]. Морфологические изменения в коже крыс при наружном применении экстракта пиявки медицинской при термическом ожоге // Верхневолжский журнал. - 2014. - Т. 12, вып. 2. - С. 45-49.
- Булоян С.А. Действие мази дермафен на регенераторные процессы кожи белых крыс после экспериментального термического ожога // Международный журнал прикладных и фундаментальных исследований. - 2015. - № 10-2. - С. 268-272.


