Оценка распространенности опухолевого процесса с применением радиофармпрепарата на основе меченных технецием-99м таргетных молекул у больной раком молочной железы с гиперэкспрессией HER2/NEU (клиническое наблюдение)
Автор: Брагина Ольга Дмитриевна, Чернов Владимир Иванович, Зельчан Роман Владимирович, Медведева Анна Александровна, Фролова Ирина Георгиевна, Дудникова Екатерина Александровна, Гольдберг Виктор Евгеньевич, Толмачев Владимир Максимилианович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.20, 2021 года.
Бесплатный доступ
Актуальность. Гиперэкспрессия Her2/neu выявляется у 15-20 % больных раком молочной железы и ассоциируется с агрессивным течением заболевания, а также с низкими показателями общей и безрецидивной выживаемости. В настоящее время для оценки статуса Her2/neu применяются иммуно-гистохимическое исследование и методы гибридизации in situ, одним из существенных недостатков которых является невозможность одномоментной оценки рецепторного статуса первичной опухоли и метастатических очагов. Набирающие популярность радионуклидные методы с использованием в качестве нацеливающего модуля рекомбинантных протеинов уже на начальных этапах клинического исследования продемонстрировали свою эффективность в решении поставленного вопроса. Целью исследования является демонстрация клинического случая оценки распространенности опухолевого процесса у больной раком молочной железы с гиперэкспрессией Her2/neu с применением радиофармпрепарата на основе меченных технецием-99|Г1 таргетных белковых молекул. Описание клинического случая. Пациентке 52 лет с диагнозом рак правой молочной железы IIIA стадии (T2N2M0), мультицен-тричный рост, метастатическое поражение правых аксиллярных и подключичных лимфатических узлов на этапе диагностики внутривенно был введен радиофармацевтический препарат «99mTc-ADAPT6». Препарат готовился непосредственно перед введением в отделении радионуклидной диагностики НИИ онкологии Томского НИМЦ. При проведении планарной сцинтиграфии и однофотонной эмиссионной томографии органов грудной клетки через 2 ч после инъекции помимо описанных ранее опухолевых очагов дополнительно были выявлены 3 очага гиперфиксации радиоиндикатора в проекции 5-го ребра справа по средне-ключичной линии, а также в проекции Th VII, IX. По результатам компьютерной томографии органов грудной клетки и остеосцинтиграфии с препаратом «"^с-пирофосфат» данных за метастатическое поражение 5-го ребра справа и Th Viii, iX получено не было. Основываясь на результатах радиоизотопного исследования, пациентке дополнительно была выполнена МРТ грудного отдела позвоночника, по заключению которой было выявлено 2 метастатических очага в Th Viii, iX. Через 6 мес после введения препарата «99mTc-ADAPT6» при контрольном обследовании в условиях НИИ онкологии ТНИМЦ по данным планарной сцинтиграфии с «99тТс-пирофосфатом» и КТ ОГК были выявлены описанные ранее очаги в проекции грудного отдела позвоночника (Th Viii, iX) и 5-го ребра справа по срединно-ключичной линии. Заключение. Результаты, продемонстрированные в ходе исследования, позволяют рассматривать препарат «99mTc-ADAPT6» в качестве перспективного трейсера для молекулярной визуализации опухолевых очагов с гиперэкспрессией рецептора Her2/neu у больных раком молочной железы.
Рак молочной железы, рецептор эпидермального фактора роста her2/neu, молекулярная визуализация, альтернативные каркасные белки
Короткий адрес: https://sciup.org/140261334
IDR: 140261334 | УДК: 618.19-006.6-073.916 | DOI: 10.21294/1814-4861-2021-20-5-170-178
Текст научной статьи Оценка распространенности опухолевого процесса с применением радиофармпрепарата на основе меченных технецием-99м таргетных молекул у больной раком молочной железы с гиперэкспрессией HER2/NEU (клиническое наблюдение)
Актуальность
В настоящее время для оценки статуса Her2/neu применяются иммуногистохимическое исследование (ИГХ) для выявления экспрессии рецептора эпидермального роста и методы гибридизации in situ для определения амплификации гена Her2: флуоресцентная (FISH-анализ) и хромогенная (CISH-анализ) гибридизация in situ [5]. Существенными недостатками использования данных методик являются невозможность одномоментной оценки распространенности опухолевого процесса с анализом молекулярных характеристик первичного опухолевого узла и метастатических очагов, а также вероятность несоответствия рецепторного статуса первичной опухоли и регионарных и отдаленных метастазов. Так, по данным M. Raiсa et. al., при изучении статуса Her2 в основном опухолевом узле и лимфатических узлах практически в 20 % случаев опухоль в лимфатическом узле имела другой фенотип [6]. Несоответствие статуса Her2 в первичной опухоли и метастатических очагах составило 14,3 % [7], а по результатам N.H. Turner et al., этот показатель достигал 0–34 % [8]. Данный факт имеет особое значение для больных с метастатическим раком молочной железы, у которых заболевание может длиться годами и в большинстве случаев требует нескольких этапов системного лечения, выполнение биопсии метастатического очага при этом может сопровождаться техническими трудностями и развитием осложнений.
В последнее время для диагностики злокачественных образований все большее распространение получают таргетные радионуклидные методы, обладающие высокой специфичностью к различным молекулярным мишеням [9, 10]. В качестве «нацеливающего» модуля» при этом активно используется новый класс таргетных молекул, получивших название «альтернативные каркасные белки» (АКБ) и отвечающих всем требованиям для оптимальной доставки радионуклида к опухолевым клеткам [11–13]. Данные протеины имеют меньшие размеры по сравнению с полноразмерным антителом, стабильную структуру [14], хорошее проникновение в ткани, возможность дополнительной функционализации и экспрессии в бактериальной системе, что обеспечивает низкую стоимость производства [15–17]. Одним из представителей альтернативных каркасных белков являются молекулы ADAPT6, представляющие собой альбумин-связывающие домены стрептококкового протеина G и имеющие небольшие размеры (46–59 аминокислотных остатков, молекулярная масса 5–7 кДа) [18, 19].
Проведенная на базе отделения радионуклидной диагностики НИИ онкологии Томского НИМЦ I фаза клинических исследований молекул ADAPT6, меченных технецием-99m (99mTc-ADAPT6), для диагностики Her2-позитивного рака молочной железы показала хорошую визуализацию опухоли и всех пораженных лимфатических узлов уже через 2 ч после инъекции препарата, а также высокое соотношение в накоплении исследуемого вещества у больных с Her2-позитивными опухолями молочной железы по сравнению с подгруппой, имеющей отрицательный статус данного маркера (р˂0,05) [20, 21].
Целью исследования является демонстрация клинического случая оценки распространенности опухолевого процесса у больных раком молочной железы с гиперэкспрессией Her2/neu с применением радиофармпрепарата на основе меченных 99mTc таргетных белковых молекул.
Клинический случай
Пациентка П., 52 лет, поступила на амбулаторное обследование в отделение общей онкологии НИИ онкологии Томского НИМЦ в 2019 г. с диагнозом рак правой молочной железы IIIA стадии (T2N2M0), мультицентричный рост, метастатическое поражение правых аксиллярных и подключичных лимфатических узлов. Диагноз был подтвержден результатами гистологического и иммуногистохимического исследований основного опухолевого узла и метастатических лимфатических узлов.
При проведении планарной сцинтиграфии и однофотонной эмиссионной томографии (ОФЭКТ) органов грудной клетки с препаратом «99mTc-ADAPT6» через 2 ч после внутривенного введения все опухолевые очаги (основной опухолевый узел, аксиллярные и подключичные лимфатические узлы), описанные ранее стандартными диагностическими методами исследования, были визуализированы в указанных анатомических проекциях. Дополнительно были выявлены 3 очага гиперфиксации радиоиндикатора в проекции 5-го ребра справа по срединно-ключичной линии, а также в проекции Th XIII, IX (рис. 1, 2).
Препарат готовился непосредственно перед введением в отделении радионуклидной диагностики НИИ онкологии Томского НИМЦ по три-карбонильной методике с использованием набора «CRS Isolink» (Center for Radiopharmaceutical Sci-
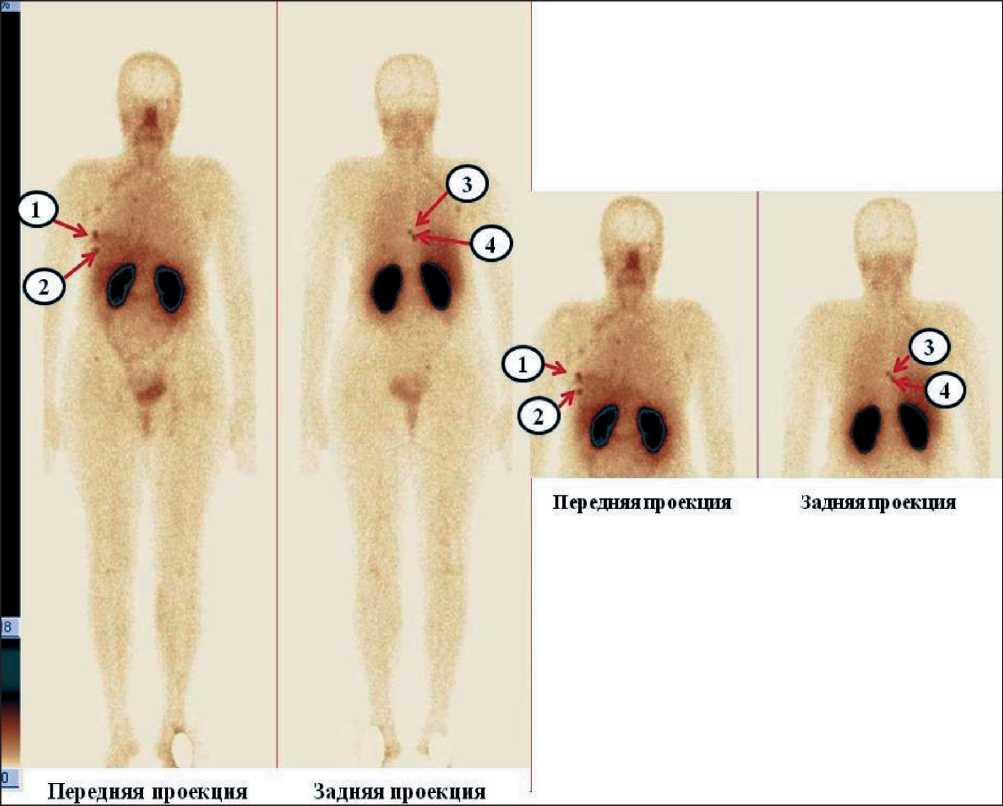
Рис. 1. Данные планарной сцинтиграфии скелета у больной Her2-позитивным раком молочной железы через 2 ч после введения препарата «99mTc-ADAPT6» (передняя и задняя проекции). По результатам исследования визуализировались несколько очагов патологической гиперфиксации радиоиндикатора в проекции: 1 – первичной опухоли в правой молочной железе;
2 – ребра справа по средне-ключичной линии; 3, 4 – грудного отдела позвоночника (указаны стрелками)
Fig. 1. Data of planar scintigraphy in a patient with Her2-positive breast cancer 2 hours after injection of «99mTc-ADAPT6» (anterior and posterior projections). According to the results, several pathological sites of radiopharmaceutical hyperfixation were visualized:
1 – primary tumor in the right breast; 2–5 – ribs on the right along the mid-clavicular line; 3, 4 – thoracic spine (indicated by arrows)
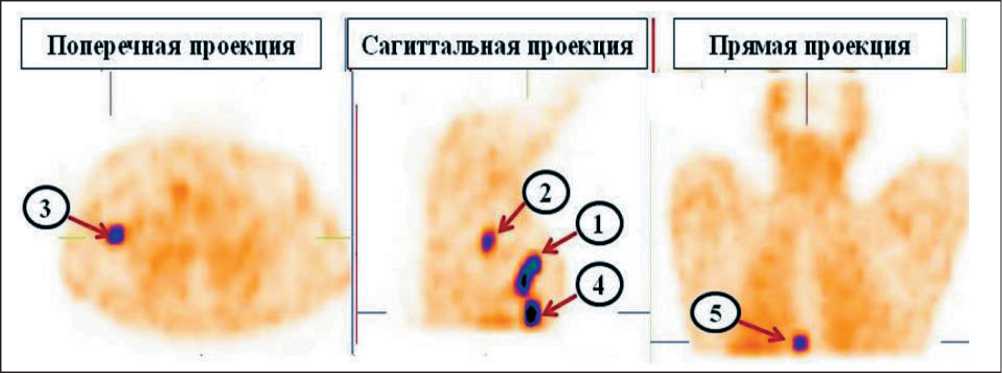
Рис. 2. Данные ОФЭКТ ОГК (поперечная, сагиттальная и прямая проекции) у больной Her2-позитивным раком молочной железы через 2 ч после введения препарата «99mTc-ADAPT6». По результатам исследования определялось несколько очагов гиперфиксации препарата в проекции: 1 – основного опухолевого узла в правой молочной железе; 2 – правых аксиллярных лимфатических узлов; 3 – подключичного лимфатического узла справа; 4–5 ребер справа; 5 – грудных позвонков (указаны стрелками) Fig. 2. SPECT of thoracic (transverse, sagittal and frontal projections) in a patient with Her2-positive breast cancer 2 hours after «99mTc-ADAPT6» ingection. According to the results, several sites of hyperfixation were determined: 1 – primary tumor in the right breast; 2 – right axillary lymph nodes; 3 – subclavian lymph node on the right; 4–5 edge to the right; 5 – thoracic vertebrae (indicated by arrows)
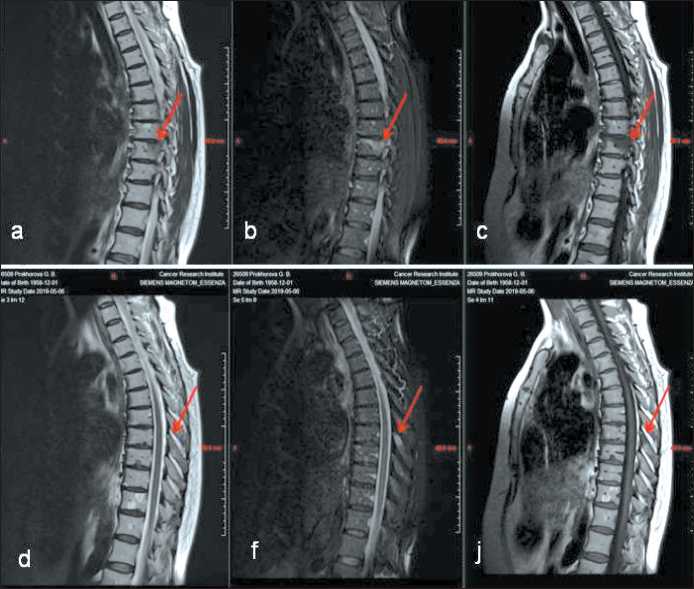
Рис. 3. Результаты МРТ грудного отдела позвоночника больной Her2-позитивным раком молочной железы. T1–VI – c, j;
T2–VI – a, d; T2–VI – c подавлением сигнала от жира – b, f. В центральных и задних отделах тела Th IХ с переходом на правую дужку определяется гипоинтенсивный участок с неровными и нечеткими контурами, признаками перифокального отека, диаметром 34×11×11,5 мм на T1–VI и Т2–VI, гиперинтенсивный на Т2–VI с подавлением жира (a, b, c). Подобный по сигнальной характеристике очаг диаметром 8,5×7 мм визуализируется в остистом отростке Th VIII (d, f, j) (указаны стрелками) Fig. 3. The results of MRI of the thoracic spine of the Her2-positive breast cancer patient. T1–VI – c, j; T2–VI – a, d;
T2–VI – with suppression of the signal from fat – b, f. In the central and posterior parts of the Th IХ body with the transition to the right arch, a hypointense area with indistinct contours is determined, signs of perifocal edema, 34×11×11.5 mm in diameter on T1–VI and T2–VI, hyperintensive on Т2–VI with fat suppression (a, b, c). A lesion similar in signal characteristics with a diameter of 8,5×7 mm is visualized in the spinous process Th VIII (d, f, j) (indicated by arrows)
ence, Paul Scherrer Institute, Villigen, Швейцария). Сцинтиграфия в режиме «Whole Body» и однофотонная эмиссионная компьютерная томография выполнялись на гамма-камере E.CAM 180 фирмы «Siemens» (Германия) в положении «лежа на спине» через 2 ч после введении. Планарная сцинтиграфия проводилась с использованием параллельных высокоразрешающих коллиматоров для энергии 140 КэВ со скоростью сканирования 12 см/мин. Запись при ОФЭКТ осуществлялась в 32 проекциях (каждая проекция по 30 сек) на матрицу 64×64 пикселя без аппаратного увеличения с полем зрения, в которое входили шея, аксиллярная область и грудная клетка до уровня бифуркации трахеи [20, 21].
По результатам компьютерной томографии органов грудной клетки и остеосцинтиграфии с препаратом «99mTc-пирофосфат» данных за метастатическое поражение 5-го ребра справа и Th VIII, IX получено не было. Основываясь на результатах радиоизотопного исследования, пациентке дополнительно была выполнена магнитно-резонансная томография (МРТ) грудного отдела позвоночника, по заключению которой было выявлено 2 метастатических очага в
Th VIII, IX (рис. 3). При анализе полученных данных стадия процесса была изменена на IV (T2N2M1), и для решения вопроса о тактике лечения пациентка была направлена на консультацию в отделение химиотерапии НИИ онкологии ТНИМЦ.
В настоящее время пациентка получает системное лечение, включающее таргетный препарат Трастузумаб в стандартной дозировке. Через 6 мес после введения препарата «99mTc-ADAPT6» при контрольном обследовании в условиях НИИ онкологии ТНИМЦ по данным планарной сцинтиграфии с «99mTc-пирофосфатом» и КТ ОГК были выявлены описанные ранее очаги в проекции грудного отдела позвоночника (Th VIII, IX) и 5-го ребра справа по срединно-ключичной линии (рис. 4, 5).
Обсуждение
Существующая на сегодняшний день проблема гетерогенности рецепторного статуса первичной опухоли и метастатических очагов у больных РМЖ до сих пор остается нерешенной. Ее важность обусловлена, прежде всего, необходимостью назначения правильного системного лечения у данной категории пациенток для достижения высоких показателей общей и безрецидивной выживаемости
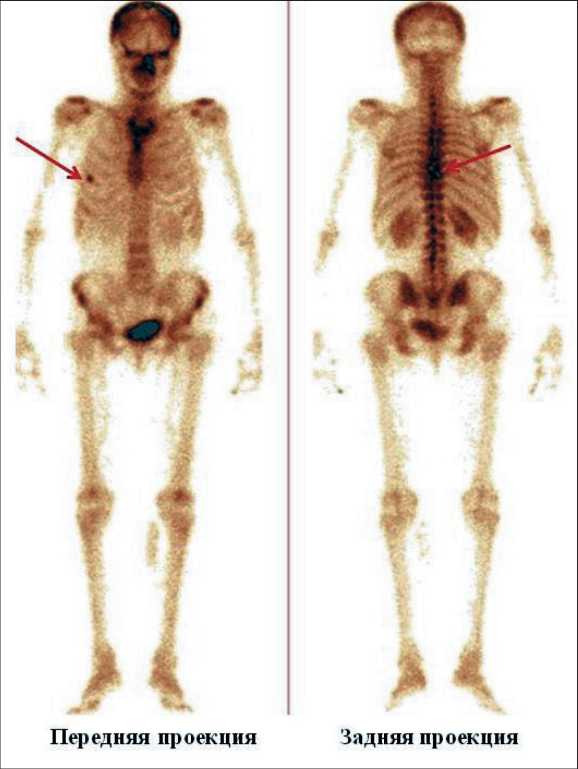
Рис. 4. Данные планарной сцинтиграфии скелета с 99mTc-пирофосфатом (передняя и задняя проекции) у больной Her2-позитивным раком молочной железы, выполненные через 6 мес после введения «99mTc-ADAPT6». По результатам проведенного исследования в проекции 5-го ребра справа по срединно-ключичной линии и в проекции грудных позвонков визуализируются участки локальной патологической гиперфиксации индикатора высокой интенсивности (указаны стрелками)
Fig. 4. Data of planar scintigraphy with «99mTc-pyrophosphate» (anterior and posterior projections) in a patient with Her2-positive breast cancer, performed 6 months after injection of «99mTc-ADAPT6». According to the results, areas of local pathological hyperfixation of the high-intensity tracer are visualized in the projection of the 5 rib on the right along the mid-clavicular line and in the projection of the thoracic vertebrae (indicated by arrows)
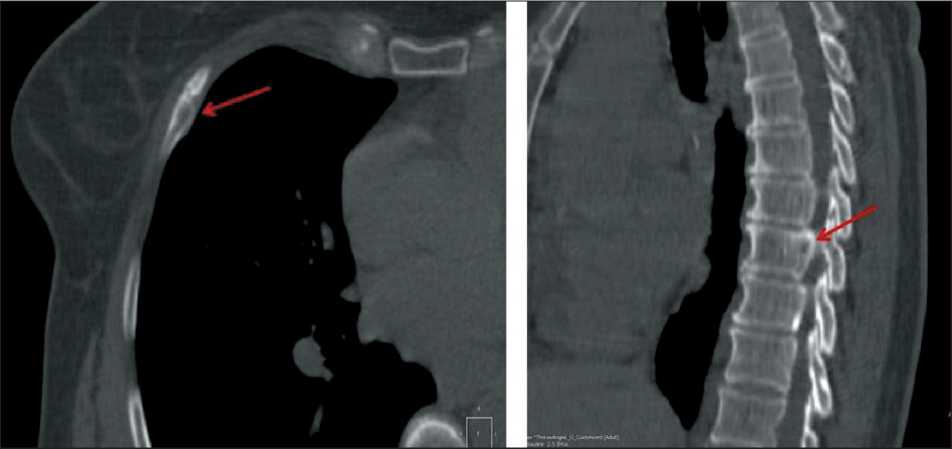
Рис. 5. Данные КТ ОГК больной Her2-позитивным раком молочной железы, выполненные через 6 мес после введения «99mTc-ADAPT6». В основании дужки Th IХ визуализируется участок повышенной плотности диаметром 10 мм, в правом заднем секторе тела Th VIII определяется участок деструкции диаметром 9×11 мм с разрушением кортикальной пластинки, зоной склероза; в переднем отрезке 5-го ребра справа выявлен участок литической деструкции со вздутием и склерозированными контурами диаметром 6×13 мм
Fig. 5. CT scan data of the patient with Her2-positive breast cancer, performed 6 months after the administration of «99mTc-ADAPT6». Аn area of increased density with a diameter of 10 mm is visualized at the base of the Th IХ arch; an area of destruction with a diameter of 9×11 mm with destruction of the cortical plate, a zone of sclerosis are determined in the right posterior sector of the Th VIII body; an area of lytic destruction with swelling and sclerosed contours with a diameter of 6×13 mm is revealed in the anterior segment of the 5th rib on the right
с учетом всех молекулярных особенностей злокачественного процесса. Проводимые в настоящее время радионуклидные исследования с применение адресных белковых молекул уже на начальном этапе продемонстрировали свою эффективность и преимущества в решении поставленной задачи.
Так, например, изучение молекулы аффибоди на базе Уппсальского университета (Швеция), меченной галлием-68 (68Ga-ABY-025) для ПЭТ/КТ и индием-111 (111In-ABY-025) для ОФЭКТ/КТ диагностики метастатического рака молочной железы, продемонстрировало высокое различие между на- коплением в опухолевой ткани с гиперэкспрессией Her2/neu и низкой экспрессией Her2/neu (р˂0,05) [22]. Кроме того, дальнейший анализ с использованием 68Ga-ABY-025 позволил визуализировать метастатические очаги и дифференцировать их по статусу Her2/neu (р˂0,05) [23, 24].
Заключение
Проведенные на базе отделения радионуклидной диагностики НИИ онкологии Томского НИМЦ клинические исследования препарата «99mTc-ADAPT6» для диагностики Her2-позитивного рака молочной железы уже на начальных этапах
Список литературы Оценка распространенности опухолевого процесса с применением радиофармпрепарата на основе меченных технецием-99м таргетных молекул у больной раком молочной железы с гиперэкспрессией HER2/NEU (клиническое наблюдение)
- Поляновский О.Л., Лебеденко Е.Н., Деев С.М. ERBB онкогены – мишени моноклональных антител. Биохимия. 2012; 77 (3): 289–311. [Polyanskii O.L., Lebedenko E.N., Deyev S.M. ERBB oncogenes as targets for monoclonal antibody. Biochemistry. 2012; 77(3): 289–311. (in Russian)].
- Zavyalova M., Vtorushin S.V., Telegina N., Krakhmal N., Savelieva O., Tashireva L., Bragina O., Denisov E.V., Kaigorodova E.V., Slonimskaya E., Choynzonov E.L., Perelmuter V.M. Clinicopathological features of nonspecific invasive breast cancer according to its molecular subtypes. Experimental Oncology. 2016: 38 (2): 122–127.
- Гервас П.А., Литвяков Н.В., Попова Н.О., Добродеев А.Ю., Тарасова А.С., Юмов Е.Л., Иванова Ф.Г., Черемисина О.В., Афанасьев С.Г., Гольдберг В.Е., Чердынцева Н.В. Проблемы и перспективы совершенствования молекулярно-генетической диагностики для назначения таргетных препаратов в онкологии. Сибирский онкологический журнал. 2014; 2: 46–55. [Gervas P.A., Litviakov N.V., Popova N.O., Dobrodeev A.Yu., Tarasova A.S., Yumov E.L., Ivanova F.G., Cheremisina O.V., Afanasyev S.G., Goldberg V.E., Cherdyntseva N.V. Problem and perspective to improve molecular testing to choose appropriate target therapy. Siberian Journal of Oncology. 2014; 2: 46–55. (in Russian)].
- Babyshkina N., Malinovskaya E., Patalyak S., Bragina O., Tarabanovskaya N., Doroshenko A., Slonimskaya E., Perelmuter V., Cherdyntseva N. Neoadjuvant chemotherapy for different molecular breast cancer subtypes: a retrospective study in Russian population. Med Oncol. 2014 Sep; 31(9): 165. doi: 10.1007/s12032-014-0165-7.
- Wolff A.C., Hammond M.E., Hicks D.G., Dowsett M., McShane L.M., Allison K.H., Allred D.C., Bartlett J.M., Bilous M., Fitzgibbons P., Hanna W., Jenkins R.B., Mangu P.B., Paik S., Perez E.A., Press M.F., Spears P.A., Vance G.H., Viale G., Hayes D.F.; American Society of Clinical Oncology; College of American Pathologists. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. J Clin Oncol. 2013 Nov 1; 31(31): 3997–4013. doi: 10.1200/JCO.2013.50.9984.
- Raica M., Cîmpean A.M., Ceausu R.A., Fulga V., Nica C., Rudico L., Saptefrati L. Hormone receptors and HER2 expression in primary breast carcinoma and corresponding lymph node metastasis: do we need both? Anticancer Res. 2014 Mar; 34(3): 1435–40.
- Lower E.E., Glass E., Blau R., Harman S. HER-2/neu expression in primary and metastatic breast cancer. Breast Cancer Res Treat. 2009 Jan; 113(2): 301–6. doi: 10.1007/s10549-008-9931-6.
- Turner N.H., Di Leo A. HER2 discordance between primary and metastatic breast cancer: assessing the clinical impact. Cancer Treat Rev. 2013 Dec; 39(8): 947–57. doi: 10.1016/j.ctrv.2013.05.003.
- Чернов В.И., Медведева А.А., Синилкин И.Г., Зельчан Р.В., Брагина О.Д., Чойнзонов Е.Л. Ядерная медицина в диагностике и адресной терапии злокачественных образований. Бюллетень сибирской медицины. 2018; 17(1): 220–231. [Chernov V.I., Medvedevа A.A., Sinilkin I.G., Zelchan R.V., Bragina O.D., Choynzonov E.L. Nuclear medicine as a tool for diagnosis and targeted cancer therapy. Bulletin of Siberian Medicine. 2018; 17(1): 220–231. (in Russian)]. doi: 10.20538/1682-0363-2018-1-220-231.
- Tolmachev V. Imaging of HER-2 overexpression in tumors for guiding therapy. Curr Pharm Des. 2008; 14(28): 2999–3019. doi: 10.2174/138161208786404290.
- Tolmachev V., Orlova A., Andersson K. Methods for radiolabeling of monoclonal antibodies. Methods Mol Biol. 2014; 1060: 309–30. doi: 10.1007/978-1-62703-586-6_16.
- Krasniqi A., D'Huyvetter M., Devoogdt N., Frejd F.Y., Sörensen J., Orlova A., Keyaerts M., Tolmachev V. Same-Day Imaging Using Small Proteins: Clinical Experience and Translational Prospects in Oncology. J тNucl Med. 2018 Jun; 59(6): 885–891. doi: 10.2967/jnumed.117.199901.
- Брагина О.Д., Чернов В.И., Зельчан Р.В., Синилкин И.Г., Медведева А.А., Ларкина М.С. Альтернативные каркасные белки в радионуклидной диагностике злокачественных образований. Бюллетень сибирской медицины. 2019; 18(3): 125–133. [Bragina O.D., Chernov V.I., Zelchan R.V., Sinilkin I.IG., Medvedeva A.A., Larkina M.S. Alternative scaffolds in radionuclide diagnosis of malignancies. Bulletin of Siberian Medicine. 2019; 18(3): 125–133. (in Russian)]. doi: 10.20538/1682-0363-2019-3-125-133.
- Azhar A., Ahmad E., Zia Q., Rauf M.A., Owais M., Ashraf G.M. Recent advances in the development of novel protein scaffolds based therapeutics. Int J Biol Macromol. 2017; 102: 630–641. doi: 10.1016/j.ijbiomac.2017.04.045.
- Брагина О.Д., Ларькина М.С., Стасюк Е.С., Чернов В.И., Юсубов М.С., Скуридин В.С., Деев С.М., Зельчан Р.В., Булдаков М.А., Подрезова Е.В., Белоусов М.В. Разработка высокоспецифического радиохимического соединения на основе меченных 99mTc рекомбинантных адресных молекул для визуализации клеток с гиперэкспрессией Her2/neu. Бюллетень сибирской медицины. 2017; т16(3): 25–33. [Bragina O.D., Larkina M.S., Stasyuk E.S., Chernov V.I., Yusubov M.S., Skuridin V.S., Deyev S.M., Zelchan R.V., Buldakov M.A., Podrezova E.V., Belousov M.V. Development of highly specific radiochemical compounds based on 99m Tc-labeled recombinant molecules for targeted imaging of cells overexpressing Her-2/neu. Bulletin of Siberian Medicine. 2017; 16(3): 25–33. (in Russian)]. doi: 10.20538/1682-0363-2017-3-25-33.
- Vorobyeva A., Schulga A., Konovalova E., Güler R., Löfblom J., тSandström M., Garousi J., Chernov V., Bragina O., Orlova A., Tolmachev V., Deyev S.M. Optimal composition and position of histidine-containing tags improves biodistribution of 99mTc-labeled DARPin G3. Sci Rep. 2019 Jun 28; 9(1): 9405. doi: 10.1038/s41598-019-45795-8.
- Nilvebrant J., Åstrand M., Georgieva-Kotseva M., Björnmalm M., Löfblom J., Hober S. Engineering of bispecific affinity proteins with high affinity for ERBB2 and adaptable binding to albumin. PLoS One. 2014 Aug 4; 9(8): e103094. doi: 10.1371/journal.pone.0103094.
- Garousi J., Lindbo S., Nilvebrant J., Åstrand M., Buijs J., Sandström M., Honarvar H., Orlova A., Tolmachev V., Hober S. ADAPT, a Novel Scaffold Protein-Based Probe for Radionuclide Imaging of Molecular Targets That Are Expressed in Disseminated Cancers. Cancer Res. 2015 Oct 15; 75(20): 4364–71. doi: 10.1158/0008-5472.CAN-14-3497.
- Lindbo S., Garousi J., Åstrand M., Honarvar H., Orlova A., Hober S., Tolmachev V. Influence of Histidine-Containing Tags on the Biodistribution of ADAPT Scaffold Proteins. Bioconjug Chem. 2016 Mar 16; 27(3): 716–26. doi: 10.1021/acs.bioconjchem.5b00677.
- Bragina O., von Witting E., Garousi J., Zelchan R., Sandström M., Orlova A., Medvedeva A., Doroshenko A., Vorobyeva A., Lindbo S., тBorin J., Tarabanovskaya N., Sörensen J., Hober S., Chernov V., Tolmachev V. Phase I Study of 99mTc-ADAPT6, a Scaffold Protein-Based Probe for Visualization of HER2 Expression in Breast Cancer. J Nucl Med. 2021 Apr; 62(4): 493–499. doi: 10.2967/jnumed.120.248799.
- Брагина О.Д., Чернов В.И., Гарбуков Е.Ю., Дорошенко А.В., Воробьева А.Г., Орлова А.М., Толмачев В.М. Возможности радионуклидной диагностики Her2-позитивного рака молочной железы с использованием меченных технецием-99m таргетных молекул: первый опыт клинического применения. Бюллетень сибирской медицины. 2021; 20(1): 23–30. [Bragina O.D., Chernov V.I., Garbukov E.Yu., Doroshenko A.V., Vorobyeva A.G., Orlova A.M., Tolmachev V.M. Possibilities of radionuclide diagnostics of Her2-positive breast cancer using technetium-99mlabeled target molecules: the first experience of clinical use. Bulletin of Siberian Medicine. 2021; 20(1): 23–30. (in Russian)]. doi: 10.20538/1682-0363-2021-1-23-30.
- Sandström M., Lindskog K., Velikyan I., Wennborg A., Feldwisch J., Sandberg D., Tolmachev V., Orlova A., Sörensen J., Carlsson J., Lindman H., Lubberink M. Biodistribution and Radiation Dosimetry of the Anti-HER2 Affibody Molecule 68Ga-ABY-025 in Breast Cancer Patients. J Nucl Med. 2016 Jun; 57(6): 867–71. doi: 10.2967/jnumed.115.169342.
- Sörensen J., Velikyan I., Sandberg D., Wennborg A., Feldwisch J., Tolmachev V., Orlova A., Sandström M., Lubberink M., Olofsson H., Carlsson J., Lindman H. Measuring HER2-Receptor Expression In Metastatic Breast Cancer Using [68Ga]ABY-025 Affibody PET/CT. Theranostics. 2016 Jan 1; 6(2): 262–71. doi: 10.7150/thno.13502.
- Keyaerts M., Xavier C., Heemskerk J., Devoogdt N., Everaert H., Ackaert C., Vanhoeij M., Duhoux F.P., Gevaert T., Simon P., Schallier D., Fontaine C., Vaneycken I., Vanhove C., De Greve J., Lamote J., Caveliers V., Lahoutte T. Phase I Study of 68Ga-HER2-Nanobody for PET/CT Assessment of HER2 Expression in Breast Carcinoma. J Nucl Med. 2016 Jan; 57(1): 27–33. doi: 10.2967/jnumed.115.162024.


