Оценка результатов хирургического лечения у больных сердечной недостаточностью ишемического генеза в сочетании с митральной недостаточностью
Автор: Шипулин Владимир Митрофанович, Андреев Сергей Леонидович, Айманов Руслан Васильевич, Александрова Екатерина Александровна, Гутор Сергей Сергеевич, Ваизов Валерий Харисович, Богунецкий Антон Александрович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая митральная недостаточность
Статья в выпуске: 1 т.19, 2015 года.
Бесплатный доступ
Введение. Необходимость хирургической коррекции митральной недостаточности ишемического генеза 3-4-й степеней не вызывает сомнений, но вмешательство при 1 -2-й степенях недостаточности спорно в отношении возможных преимуществ и осложнений. Отдельную проблему составляет необходимость выполнения одномоментной коррекции запирательной функции митрального клапана и хирургического ремоделирования левого желудочка. Цель исследования. Оценить смертность больных после оперативного лечения и влияние различных подходов в хирургическом лечении на функции сердца в раннем и среднесрочном послеоперационном периодах у больных сердечной недостаточностью ишемического генеза в сочетании с митральной недостаточностью. Материал и методы. В работе представлены результаты анализа оперативного лечения 95 больных с выраженной сердечной недостаточностью и митральной недостаточностью ишемического генеза за период 2009-2013 гг. Первым этапом выполнялось сравнение пациентов, умерших в периоперационном периоде, с больными, выписанными после хирургического лечения, с помощью инструментальных и постбиопсийных морфологических методов. Вторым этапом выжившие и выписанные пациенты были разделены на две группы по наличию или отсутствию реконструкции левого желудочка, в сроки через 1 и 12 мес. обе группы пациентов повторно обследовались с применением ЭхоКГ, МРТ, спировелоэргометрии. Результаты. Неблагоприятный прогноз в виде ранней летальности в послеоперационном периоде у больных с сердечной недостаточностью и митральной регургитацией ишемического генеза можно связать с продолжительностью искусственного кровообращения во время операции, функциональным классом хронической сердечной недостаточности до операции, возрастом пациента, со снижением паренхиматозно-стромального отношения миокарда боковой стенки левого желудочка ниже нормы, по результатам постбиопсийного морфологического исследования. Реконструкция левого желудочка, проводимая в сочетании с аортокоронарным шунтированием, и восстановление функции митрального клапана способствуют сохранению индекса сферичности левого желудочка и положительной динамике VO 2max при неизменных прочих характеристиках среднесрочного послеоперационного исхода, что говорит о возрастании энергетической мощности и эффективности работы сердца. Выводы. Показана связь риска смертности в раннем послеоперационном периоде с клиническими данными пациентов. Установлено улучшение энергетической эффективности сердца при выполнении реконструкции левого желудочка по сравнению с пациентами без таковой через год после операции.
Митральная недостаточность, реконструкция левого желудочка, сердечная недостаточность ишемического генеза
Короткий адрес: https://sciup.org/142140652
IDR: 142140652 | УДК: 616.12-008.46-089.16
Текст научной статьи Оценка результатов хирургического лечения у больных сердечной недостаточностью ишемического генеза в сочетании с митральной недостаточностью
Митральная недостаточность (МН) ишемического генеза встречается в 20–25% случаев после перенесенного инфаркта миокарда [1] и в 50% случаев сочетается с сердечной недостаточностью (СН) [2]. Ишемическая МН развивается в результате воздействия ишемии на подклапанный аппарат митрального клапана [3]. Постинфарктное ремоделирование левого желудочка (ЛЖ) приводит к расширению фиброзного кольца, увеличению аннуло-папиллярного расстояния и дистанции между папиллярными мышцами, что нарушает нормальную кооптацию створок митрального клапана [4]. Необходимость хирургической коррекции недостаточности митрального клапана третьей степени и выше не вызывает сомнения, но оправданность вмешательств на митральном клапана при 1–2-й ст. – отсутствует [5]. Calafiore A.M. и др. продемонстрировали, что наличие даже умеренной недостаточности митрального клапана снижает отдаленные показатели выживаемости пациентов с низкой фракцией выброса (ФВ) ЛЖ (до 40%) [6]. Нет данных, подтверждающих, что восстановление кровоснабжения всех сегментов миокарда при реваскуляризации и/или хирургическое ремоделирование способны излечить или остановить развитие МН в послеоперационном. И наличие минимальных степеней МН, 1–2-я ст., влияет на гемодинамику у группы пациентов со сниженной функцией ЛЖ [4].
Материал и методы
В исследование включено 95 пациентов (89 мужчин, 6 женщин) с ишемической кардиомиопатией (ИКМП) и МН ишемического генеза, прооперированных в отделе сердечно-сосудистой хирургии НИИ кардиологии в период с 2009 по 2013 гг. Средний возраст больных составил 56,2±6,9 года. При оценке типа постинфарктного ремоделирования ЛЖ по Di Donato у 43 отмечен 2-й тип, у 52 больных – 3-й тип.
Критерии включения пациентов в исследование: ФВ ЛЖ менее либо равная 45%, по данным эхокардиографии (ЭхоКГ); наличие в анамнезе инфаркта миокарда и/или стеноз более 75% ствола левой коронарной артерии либо проксимальный стеноз передней нисходящей артерии и/или стенозы более 75% двух и более коронарных артерий; митральная регургитация 2–4-й ст. (в покое либо при проведении фармакологической пробы с допмином); конечный систолический индекс (КСИ) ЛЖ более 60 мл/м2. Критерии исключения: наличие органических пороков сердца ревматической и инфекционной этиологии; острый инфаркт миокарда; правожелудочковая недостаточность; острое нарушение мозгового кровообращения; наличие абсолютных противопоказаний к оперативному лечению.
Всем пациентам перед операцией проводились инструментальные исследования, включающие спировелоэргомет-рию, комплексное ультразвуковое исследование сердца, ко- ронаровентрикулографию (КВГ), сцинтиграфию миокарда с технетрилом, магнитно-резонансную томографию (МРТ) сердца с контрастированием полостей сердца. Через 1 и 12 мес. после операции пациенты повторно обследовались с использованием ЭхоКГ, МРТ, спировелоэргометрией. Выполнялась оценка тяжести СН по NYHA.
Выполнялась ЭхоКГ с допплерографией в соответствии с рекомендациями Американского общества эхокардиографии (ASE), измерялись: ФВ ЛЖ, КСИ ЛЖ, конечный диастолический индекс (КДИ) ЛЖ, индекс сферичности (ИС) ЛЖ по его диастолическому наполнению. Степень ишемической МН определялась в соответствии с эффективной площадью отверстия регургитации (EROA): 0 – при отсутствии МР, 1 – менее 0,20 см2, 2 – от 0,20 до 0,29 см2, 3 – от 0,30 до 0,39 см2, 4 – 0,40 см2 и более. Наличие 2-й ст. недостаточности на митральном клапане в покое являлось показанием для проведения нагрузочной эхокардиографической пробы с допмином. Пациентов с увеличением степени МН во время проведения нагрузочной пробы до 3–4-й ст. также включали в исследование.
Контрастированная МРТ сердца с ЭКГ-синхронизацией выполнялась в Т1-взвешенном режиме, в положении пациента лежа, без дополнительных функциональных нагрузок. Выполнялась МРТ-оценка рубцовой ткани от общей массы миокарда (%), периметра поражения ЛЖ (см), минимальная толщина стенки ЛЖ (мм), ФВ ЛЖ (%). Кардиореспиратор-ное тестирование проводилось на эргоспирометрической системе SHILLER CARDIOVIT CS-200 Ergo-Spiro по ramp-протоколу с непрерывно возрастающей физической нагрузкой с начальным показателем 50 Вт с постепенным увеличением нагрузки на 8 Вт каждую минуту. Тест прекращался и считался информативным при достижении субмаксимальной частоты сердечных сокращений либо плато потребления кислорода. После чего подсчитывался стандартный показатель – объем потребления кислорода на кг массы тела в минуту (VO2max). Это интегральный показатель аэробной производительности организма. Однофотонная эмиссионная компьютерная томография миокарда с 99m Тс-технетрилом проводилась в дозе 740–920 МБк в условиях покоя и фармакологической пробы. В качестве стресс-агента использовали аденозинтрифосфат. Определялся процент акинетичного и гипокинетичного миокарда в покое и при нагрузке. Во время операций у пациентов взят биопсийный материал ушка правого предсердия и ЛЖ с границы эндокардиального рубца и с участка визуально неизмененного миокарда. Окраска гема-токсилин-эозином и по методу Маллори с дальнейшей морфометрией.
Целью исследования стало определение возможных клинических рисков и преимуществ при выполнении реконструктивных вмешательств и резекции, определение крите-
Таблица 1 Сопряженность смерти в раннем послеоперационном периоде с качественными оценками
|
Операция |
Смерть в раннем периоде, группы |
Всего |
|
|
1-я |
2-я |
||
|
Без реконструкции ЛЖ |
2 |
54* |
56 |
|
С реконструкцией ЛЖ |
10 |
29* |
39 |
|
Всего |
12 |
83 |
95 |
|
Проверка наличия статистической зависимости |
р |
||
|
χ 2 Пирсона |
9 472 |
0,003# |
|
|
ВАБК |
Смерть в |
раннем периоде, группы |
|
|
1-я |
2-я |
||
|
Использование ВАБК |
4 |
60* |
64 |
|
Без использования ВАБК |
8 |
23* |
31 |
|
Всего |
12 |
83 |
95 |
|
Проверка наличия статистической зависимости |
р |
||
|
χ 2 Пирсона |
7 237 |
0,011# |
|
|
ФК ХСН |
Смерть в |
раннем периоде, группы |
|
|
1-я |
2-я |
||
|
1 |
1 |
0* |
1 |
|
2 |
0 |
31* |
31 |
|
3 |
9 |
50 |
59 |
|
4 |
2 |
2* |
4 |
|
Всего |
12 |
83 |
95 |
|
Проверка наличия статистической зависимости |
p |
||
|
Точный критерий Фишера |
14 532 |
0,001 |
|
* статистически значимые отличия по сравнению с частотой встречаемости в 1-й группе на уровне p <0,05; # статистически достоверный результат при p <0,05
риев сопряженных с риском смерти в периоперационном периоде у больных ишемической кардиомиопатией в сочетании с МН. Согласно цели исследования, анализ полученных данных проводился двухэтапно. Первым этапом выполнялось сравнение пациентов, умерших в периоперационном периоде, с больными, выписанными после хирургического лечения. Вторым этапом выжившие и выписанные пациенты были разделены на две группы по наличию или отсутствию реконструкции ЛЖ. Пациентам выполнено аортокоронарное шунтирование (АКШ) и хирургическое вмешательство на митральном клапане, у 38 (40%) больных в сочетании с реконструкцией ЛЖ или линейной резекцией аневризмы. Из представленных пациентов 88 выполнена рестриктивная митральная аннулопластика с жесткими опорными кольцами размерами 28 и 30 мм, 7 больным – протезирование искусственным клапаном сердца «МедИнж-2».
Статистическая обработка результатов проводилась с помощью пакета программ SPSS 21.0 for Windows. Нормальность закона распределения количественных показателей проверялась с помощью критерия Shapiro – Wilks. Параметры, подчиняющиеся нормальному закону распределения, описывались с помощью среднего значения (M) и стандартного отклонения (StD); не подчиняющиеся нормальному закону распределения – с помощью медианы (Me) и интерквантильного интервала (Q25–Q75). Качественные данные описывались частотой встречаемости или ее процентом. В случае нормального закона распределения для проверки достоверности различий количественных показателей в сравниваемых группах использовался t-критерий Стьюдента; критерий Манна – Уитни в случае ненормального закона распределения. Для проверки достоверности различия качественных данных был использован критерий χ2 (или точный критерий Фишера в тех случаях, когда χ2 провести было невозможно). Все статистические показатели считали достоверными при p <0,05.
Результаты
Первый этап . На первом этапе проанализированы полученные данные пациентов, умерших в раннем послеоперационном периоде (1-я группа), и пациентов, выписанных после хирургического лечения (2-я группа). Из 95 пациентов, включенных в исследование, смерть в раннем послеоперационном периоде отмечена у 12 пациентов (12,6%). Среди причин смерти – 10 больных умерли от кардиальных причин (острый периоперационный инфаркт миокарда, острая СН), один пациент – от пневмонии легких, и один больной погиб от ост-
Таблица 2 Описательные характеристики и проверка достоверности отличия количественных характеристик, имеющих нормальный закон распределения
|
Показатели |
1 |
2 |
Проверка достоверности отличий |
|||||
|
n |
Результат |
Станд. отклонение |
n |
Результат |
Станд. отклонение |
t-критерий |
p |
|
|
Сцинтиграфия нагрузка, % |
6 |
29,17 |
9,261 |
37 |
28,38 |
13,933 |
0,133 |
0,895 |
|
Сцинтиграфия покой, % |
6 |
27,83 |
8,448 |
34 |
25,71 |
13,559 |
0,370 |
0,714 |
|
VO2 max, мл/(кг · мин) |
6 |
10,133 |
3,8034 |
46 |
12,242 |
5,5003 |
2,131 |
0,038 |
|
Возраст, лет |
12 |
60,08 |
8,107 |
83 |
55,61 |
6,572 |
2,137 |
0,035 |
|
ФВ ЛЖ по ЭхоКГ |
12 |
30,18 |
5,913 |
83 |
33,13 |
6,002 |
– 1,534 |
0,128 |
|
МРТ P поражения, см МРТ % рубца от |
6 |
14,900 |
1,2728 |
27 |
13,826 |
4,6271 |
0,322 |
0,750 |
|
массы ЛЖ |
6 |
32,00 |
11,314 |
27 |
32,93 |
10,122 |
–0,124 |
0,902 |
|
ФВ ЛЖ по МРТ |
6 |
25,50 |
0,707 |
27 |
27,67 |
8,580 |
–0,251 |
0,528 |
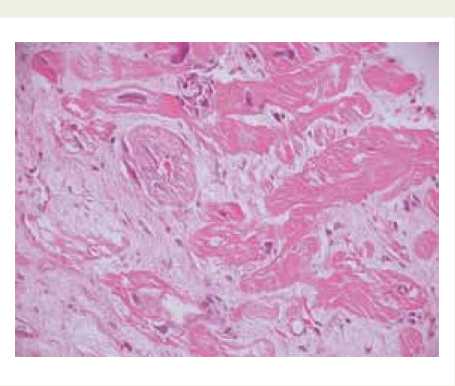
Рис. 1. Миокард задней стенки ЛЖ больного ИКМП: плексиморфный кардиофиброз, перинуклерный отек, уродливые ядра кардиомиоцитов, гиперплазия стенки артериолы. Окраска: гематоксилин-эозин. Увеличение: 400
рого кровотечения из желудочно-кишечного тракта. У всех умерших отмечены проявления выраженной СН.
Анализ групп проводился по качественным и количественным характеристикам. Среди качественных характеристик группы анализировались по сочетанию с хирургическим вмешательством на ЛЖ (с реконструкцией ЛЖ) либо без такового (без реконструкции ЛЖ), использованию баллонной внутриаортальной контрпульсации (ВАБК), функциональному классу СН (ФК ХСН NYHA). Статистическая взаимосвязь качественных показателей определялась критерием Хи-квадрат Пирсона или точным критерием Фишера с поправкой Бонферонни и считалась достоверной при p <0,05 (табл. 1).
При анализе выявлено, что такие факторы, как применение реконструкции ЛЖ, использование баллона, а также более клинически выраженная сердечная недостаточность статистически взаимосвязаны со смертью в раннем послеоперационном периоде больных ишемической сердечной недостаточностью, перенесших операцию на митральном клапане. В то же время риск смерти не зависел от такого качественного показателя, как тип ремоделирования ЛЖ. По количественным характеристикам группы проанализированы по показателям: дефект перфузии, по данным сцинтиграфии миокарда с технетриллом при нагрузке (сцинтиграфия нагрузка) и в покое (сцинтиграфия покой), возраст, по данным спи-ровелоэргометрии максимум объема потребления кислорода на кг массы тела в минуту (VO2max), ФВ ЛЖ, определенная по УЗИ (ФВ ЛЖ по ЭхоКГ), МРТ-оценка рубцовой ткани от общей массы миокарда (МРТ % рубца от массы ЛЖ), периметр поражения ЛЖ (МРТ P поражения, см), ФВ ЛЖ по МРТ (табл. 2).
Возраст (60,1±8,1 года), максимум объема потребления кислорода на кг массы тела в минуту (10,3±3,4) в группе умерших пациентов достоверно отличались от группы выживших – пациенты 1-й группы были соответственно старше и имели меньший показатель потребления кислорода. При оценке интраоперационного периода время искусственного кровообращения (ИК) в 1-й группе 258 (240–260) и 182,5 (170–210) мин во 2-й группе статистически достоверно различались, с увеличением в группе умерших пациентов. Время пережатия аорты достоверно не отличалось. Индекс сферичности ЛЖ, КДИ ЛЖ, КСИ ЛЖ, длинник левого предсердия (ЛП) между группами также достоверно не отличались.
Таким образом, неблагоприятный исход оперативного лечения зависел от исходной тяжести проявлений сердечной недостаточности, что инструментально проявляется в
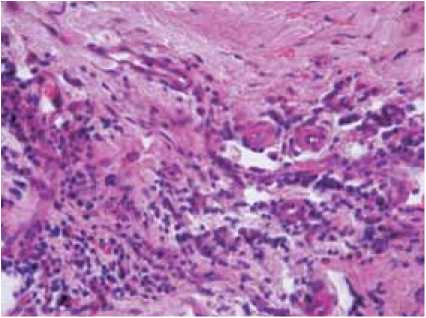
Рис. 2. Инфильтрация круглоядерными клетками миокарда передней стенки ЛЖ больных ИКМП: а – 1-я группа; б – 2-я группа. Окраска: гематоксилин-эозин. Увеличение: 400
сниженном потреблении кислорода тканями. Реконструкция ЛЖ увеличивает риск неблагоприятного исхода в послеоперационном периоде. Логична связь между увеличенным временем ИК и проведением ВАБК у больных, тяжело перенесших оперативное вмешательство, и погибших. При анализе полученных дооперационных данных также выявлено значимое расхождение показателей ФВ ЛЖ, по данных ЭхоКГ и МРТ. По данным МРТ, ФВ ЛЖ составила 27,52±8,29, в то время как у этих больных ФВ ЛЖ по ЭхоКГ – 32,78±6,04 (Z = –3,085; р = 0,001).
Как представлено, статистически достоверно показатели ФВ ЛЖ по данным МРТ меньше, чем по данным ЭхоКГ, при прямом сопоставлении в среднем на 5,26±7,3%. При этом, согласно литературным данным, расчет по МРТ более точен, в связи с чем при клинической оценке пациента относительно ФВ ЛЖ нам представляется необходимым ориентироваться в первую очередь на томографические данные.
В ходе исследования интраоперационных биопсий миокарда ЛЖ и ушка правого предсердия (УПП) повсеместно отмечали признаки сегментарных и субсегментарных контактур кардиомиоцитов (КМТ), перинуклеарную вакуолизацию, гипертрофию и нередко гиперхроматоз ядер кардиомиоцитов, диссоциацию и фрагментацию кардиомиоцитов, диффузный и периваскулярный кардиосклероз (рис. 1).
В миокарде ЛЖ больных ИКМП обеих групп в 100% случаев определялась в разной степени выраженная инфильтрация круглоядерными клетками. Однако в 1-й группе пациентов инфильтрация была более интенсивная и обнаруживалась во всех исследуемых участках стенки сердца, в том числе в ушке правого предсердия, тогда как во 2-й группе инфиль- трат был менее выражен и, как правило, определялся не во всех стенках (рис. 2).
Методом точечного счета в миокарде ЛЖ измерялись диаметры (Д) кардиомиоцитов и просвета капилляров, удельные объемы (УО) паренхимы, стромы, ядер КМЦ и клеток стромы, внутриклеточного и интерстициального отеков, капилляров. На основе полученных значений рассчитаны ядерно-цитоплазматическое отношение (ЯЦО = УО ядер паренхимы / УО паренхимы), паренхиматозно-стромальное отношение (ПСО = УО паренхимы / УО стромы), трофический индекс (ТИ = УО капилляров / УО паренхимы), зона перикапиллярной диффузии (ЗПкД = Д капилляров / УО капилляров). Распределение критерием Шапиро – Уилка показало, что достоверно не отличались от норы законы распределения Д кардиомиоцитов и капилляров, УО паренхимы, УО ядер паренхимы, УО стромы, УО капилляров, трофический индекс.
Статистически достоверные отличия с помощью t-критерия Стьюдента и U-критерия Манна – Уитни получены между УО паренхимы миокарда боковой стенки ЛЖ (0,523±0,014 в 1-й группе и 0,701±0,064 во 2-й группе), ТИ миокарда межжелудочковой перегородки со стороны ЛЖ (0,12±0,02 и 0,09±0,03 соответственно), интерстициального отека УПП в 1-й 0,067 (0,047–0,081) и 2-й группах 0,133 (0,122–0,151), ПСО миокарда боковой стенки ЛЖ 2,09 (1,80– 2,34) и 10,13 (8,79–10,32) соответственно, ЯЦО передней стенки ЛЖ в 1-й 0,039 (0,031–0,050) и 0,028 (0,014–0,028) во 2-й группах. Таким образом, снижение паренхиматозно-стромального отношения миокарда боковой стенки ЛЖ служит маркером неблагоприятного прогноза.
Таблица 3 Описательные характеристики и достоверность отличия количественных характеристик, имеющих нормальный закон распределения
|
Показатели |
1-я |
группа |
2-я группа |
Проверка достоверности отличий |
||||
|
n |
Результат |
Станд. отклонение |
n |
Результат |
Станд. отклонение |
t-критерий |
p |
|
|
Сцинт. нагрузка |
18 |
19,67 |
8,677 |
17 |
39,53 |
10,260 |
0,000 |
|
|
Сцинт. покой |
16 |
15,44 |
7,014 |
17 |
36,29 |
9,649 |
–7,064 |
0,000 |
|
VO2max до операции |
29 |
11,162 |
3,4722 |
15 |
11,027 |
4,2412 |
0,114 |
0,910 |
|
VO2max 1 мес. |
25 |
12,704 |
3,5228 |
13 |
11,562 |
2,8280 |
1,010 |
0,319 |
|
VO2max 12 мес. |
21 |
13,205 |
3,6993 |
11 |
15,167 |
3,1373 |
–0,256 |
0,038 |
|
Возраст, лет |
51 |
57,16 |
6,323 |
32 |
53,10 |
6,488 |
2,731 |
0,008 |
|
ФВ ЭхоКГ до операции |
51 |
33,80 |
6,151 |
32 |
32,14 |
5,256 |
1,219 |
0,227 |
|
ФВ ЛЖ 1 мес. |
51 |
37,50 |
9,676 |
32 |
36,52 |
7,985 |
0,457 |
0,649 |
|
ФВ ЛЖ 12 мес. |
30 |
40,61 |
12,895 |
14 |
39,82 |
8,352 |
0,257 |
0,743 |
|
P поражения (см) |
13 |
13,731 |
5,5861 |
14 |
13,914 |
3,7416 |
–0,101 |
0,920 |
|
% рубца от m (ЛЖ) |
13 |
31,54 |
11,723 |
14 |
34,21 |
8,622 |
–0,679 |
0,503 |
|
ФВ МРТ |
13 |
26,62 |
6,899 |
14 |
28,64 |
10,058 |
–0,606 |
0,550 |
Второй этап . Выжившие и выписанные пациенты разделены на две группы: без реконструкции ЛЖ (1-я группа – 51 человек, 61,5%), с реконструкцией (2-я группа – 32 человека, 38,5%). Через 1 и 12 мес. обе группы пациентов повторно обследовались с использованием ЭхоКГ, МРТ, спировело-эргометрии. Анализ данных представлен в табл. 3. Исходно обе группы были сопоставимы по VO2max, ФВ по данным ЭхоКГ и МРТ, проценту рубцовой ткани от массы миокарда ЛЖ, периметру поражения рубцовой тканью ЛЖ. В то же время данные сцинтиграфии миокарда с технетриллом продемонстрировали достоверно больший дефект перфузии во 2-й группе как при нагрузке (39,53± 10,26), так и в покое (36,29±9,65), по сравнению с 1-й группой (19,67±8,68 и 15,44±7,01).
При оценке VO2max отмечено, что в обеих группах через 1 мес. после операции данный показатель достоверно не изменился, через 12 мес. в обеих группах показатель достоверно увеличился: в группе с реконструкцией ЛЖ показатель составил выше, чем в группе без таковой (рис. 3).
Статистически достоверно отличались время пережатия аорты в 1-й группе 129,5 (117,5–137) и 155 (126–180) мин во 2-й группе, время ИК – 177,5 (160–194,5) и 199 (178–256) мин соответсвенно, КДИ ЛЖ – 107,3 (96,9–122,9) и 119, 2 (109,3– 133,3), КСИ ЛЖ – 69,8 (60,2–86,6) в 1-й группе и 85,2 (69,6– 99) во второй, ИС после операции без реконструкции ЛЖ 0,6 (0,58–0,65), с реконструкцией – 0,77(0,67–0,84), ИС через год после операции без реконструкции 0,61 (0,57–0,65), с реконструкцией – 0,7 (0,64–0,79).
Обсуждение
У пациентов с ишемическим поражением миокарда и выраженной МН продемонстрировано преимущество ану-лопластики митрального клапана по сравнению как с медикаментозной терапией [7], так и с протезированием клапана [8]. Однако хирургическая тактика в отношении пациентов с МН, не превышающей третью степень, дискутабельна. Существует точка зрения, что резидуальная МН после АКШ не влияет на функциональный статус пациентов и отдаленную
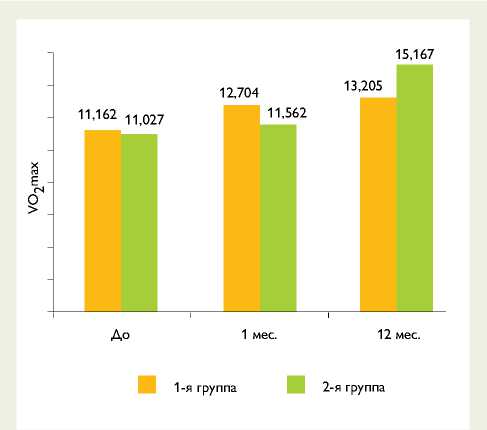
Рис. 3. Анализ изменения объема потребления кислорода на кг массы тела в минуту: до и контрольные сроки после операции выживаемость [9], а сочетанные вмешательства имеют более высокий показатели летальности [10], при этом анулопласти-ка демонстрирует нестабильный результат с возвратом МН в отдаленном периоде независимо от удовлетворительных результатов непосредственно сразу после вмешательства [11]. Однако известно что, пациенты с нарушениями сократимости, вызванными необратимыми причинами – рубцовым изменением миокарда и дилатированным желудочком, после изолированного АКШ имеют достоверно выше степень резидуальной недостаточности на митральном клапане [12, 13]. И вмешательство на митральном клапане преимущественно может быть выполнено с хирургическим риском менее 3–4% [12].
Отдельную проблему составляет необходимость выполнения одномоментной коррекции запирательной функции митрального клапана и хирургического ремоделирования ЛЖ. Непосредственно вмешательство, направленное на восстановление геометрии ЛЖ, способно восстановить нормальную архитектуру митрального клапана: уменьшить анну-ло-папиллярное расстояние и межпапилярную дистанцию [4, 14]. Снижение миокардиального стресса в результате уменьшения размеров желудока способно улучшить функцию миокарда и папилярных мышц. Так, Di Donato предлагает оставлять вторую и выше степень МН без хирургического лечения и демонстрирует положительные результаты отдаленной выживаемости, несмотря на то что около 29% пациентов к концу наблюдения все же имели как минимум умеренную степень МН [14]. Prucz в своем исследовании также продемонстрировал значительное сокращение степени митральной регургитации после изолированной реконструкции ЛЖ, однако 76% пациентов, включенных в данное исследование, к концу периода наблюдения имели МН второй степени и выше [4]. Но, по данным различных авторов, частота возврата МН составляет от 25 до 35% в первые полгода после аннуло-пластики [11]. Среди предикторов возврата МН – повышенное натяжение створок митрального клапана и продолжающееся ремоделирование ЛЖ [13]. Консервативная тактика в отношении пациентов с МН приводит к тому, что значительная часть пациентов остаются в зоне риска развития возможных негативных последствий МН: трепетания предсердий, прогрессивного ремоделирования ЛЖ, повышенной смертности и сниженного качества жизни, нарастания легочной гипертензии [5, 15].
В исследовании мы проанализировали данные оперативного лечения у рассматриваемой группы больных за последние 5 лет. Пациенты относились к одной из сложных и тяжелых когорт. Анализу подверглись смертность больных после операции, влияние различных подходов в хирургическом лечении на функции сердца в раннем и среднесрочном послеоперационном периодах. Выявлено, что пациенты, умершие в раннем послеоперационном периоде, были старше пациентов, перенесших операцию, имели более выраженную СН и меньший VO2max, что, таким образом, отразилось в данных морфологического исследования участков ЛЖ в виде снижения паренхиматозно-стромального отношения миокарда. В то же время данные ЭхоКГ- и МРТ-показателей достоверно не отличались. Мы считаем, что это говорит о нарушении функции на клеточном уровне, что приводит к повышенному риску во время оперативного вмешательства. Возможно, что в дальнейшем данная группа пациентов имела более высокий темп прогрессирования патологии, связанный с поражением стромы и кардиомиоцитов, с переходом в разряд неоперабельных и скорой смертью. Логична связь между увеличенным временем ИК и установкой ВАБК у больных, тяжело перенесших оперативное вмешательство и впоследствии погибших. Анализ влияния реконструкции ЛЖ на послеоперационное течение заболевания у больных ИБС с недостаточностью митрального клапана ишемического генеза показал, что перед операцией обе группы были сопоставимы по всем показателям, за исключением дефектов перфузии по данным сцинтиграфии миокарда ЛЖ, – у больных, впоследствии перенесших реконструкцию ЛЖ, они были выше. В послеоперационном периоде в сроки до года в обеих группах отмечалась положительная клиническая и лабораторная динамика, но в группе с реконструкцией ЛЖ изменения VO2max в контрольные сроки после операции были достоверно выше, при этом форма ЛЖ не подверглась ремоделированию. Восстановление формы ЛЖ положительно влияет на течение патологии после операции. При сравнении данных измерения ФВ ЛЖ по МРТ и ЭхоКГ в среднем по ультразвуковым параметрам отмечено превышение МРТ-показателей на более 5%. С учетом большего субъективизма ЭхоКГ-исследований [14] можно сделать вывод о необходимости ориентации в первую очередь на показатели ФВ ЛЖ по МРТ.
Заключение
Неблагоприятный прогноз в виде ранней летальности в послеоперационном периоде у больных с сердечной недостаточностью и митральной регургитацией ишемического генеза можно связать с продолжительностью ИК во время операции, ФК ХСН до операции, возрастом пациента. Реконструкция ЛЖ, проводимая в сочетании с АКШ, и восстановление функции митрального клапана способствуют сохранению ИС и положительной динамике VO2max при неизменных прочих характеристиках среднесрочного послеоперационного исхода, что говорит о возросшей энергетической мощности и эффективности работы сердца. При оценке ФВ ЛЖ прежде всего необходимо ориентироваться на данные МРТ ЛЖ как более точные, чем ультразвуковые.
Список литературы Оценка результатов хирургического лечения у больных сердечной недостаточностью ишемического генеза в сочетании с митральной недостаточностью
- Lamas G.A., Mitchell G.F., Flaker G.C. et al.//Circulation. 1997. Vol. 96 (3). P. 827-33.
- Trichon B.H., Felker G.M., Shaw L.K.//Am. J. Cardiol. 2003. Vol. 91 (5). P. 538-43.
- Trichon B.H., Glower D.D., Shaw L.K. et al.//Circulation. 2003. Vol. 108 (Suppl 1). P. 103-10.
- Prucz R.B., Weiss E.S., Patel N.D. et al.//Ann. Thorac. Surg. 2008. Vol. 86 (3). P. 726-34.
- Klein P., Braun J., Holman E.R.//Eur. J. Cardiothorac. Surg. 2012. Vol. 41 (1). P. 74-80.
- Calafiore A.M., Ia^ A.L., Contini M. et al.//Angiology. 2008. Vol. 59 (2 Suppl). P. 89S-92S.
- Wu A.H., Aaronson K.D., Bolling S.F. et al.//J. Am. Coll. Cardiol. 2005. Vol. 45 (3). P. 381-7.
- Carpentier A.//J. Thoracic. Cardiovascular. Surg. 1983. Vol. 86. P. 326-37.
- Duarte I.G., Shen Y., MacDonald M.J.//Ann. Thorac. Surg. 1999. Vol. 68 (2). P. 426-30.
- Braun J., van de Veire N.R., Klautz R.J. et al.//Ann. Thorac. Surg. 2008. Vol. 85 (2). P. 430-6.
- McGee E.C., Gillinov A.M., Blackstone E.H.//J. Thorac. Cardiovasc. Surg. 2004. Vol. 128 (6). P. 916-24.
- Aklog L., Filsoufi F., Flores K.Q.//Circulation. 2001. Vol. 104 (12 Suppl 1). P. 168-75.
- Bax J.J., Braun J., Somer S.T. et al.//Circulation. 2004. Vol. 110 (11 Suppl 1). P. II-103-II-8.
- Di Donato M., Castelvecchio S., Brankovic J.//J. Thorac. Cardiovasc. Surg. 2007. Vol. 134 (6). P. 1548-53.
- Чернявский А.М., Рузматов Т.М., Эфендиев В.У. и др. Влияние коронарного шунтирования и реконструкции левого желудочка на умеренную митральную недостаточность при хирургическом лечении ишемической болезни сердца с низкой фракцией выброса//Патология кровообращения и кардиохирургия. 2013. № 3. С. 15-19.


