Оценка результатов эпикардиальной электрокардиостимуляции левого желудочка у детей
Автор: Якимова Е.В., Джаффарова О.Ю., Свинцова Л.И., Сморгон А.В., Связов Е.А., Картофелева Е.О.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.40, 2025 года.
Бесплатный доступ
Актуальность работы обусловлена высокой частотой развития пейсмекер-индуцированной кардиомиопатии (ПИКМП) при хронической стимуляции правого желудочка, достигающей 30% в педиатрической популяции. Современные данные свидетельствуют о преимуществах стимуляции левого желудочка (ЛЖ) в отношении сохранения сократительной функции и внутрижелудочковой синхронности. В настоящем исследовании представлены непосредственные и отдаленные результаты эпикардиальной имплантации электрода электрокардиостимулятора (ЭКС) на ЛЖ у детей. Целью данного исследования является ретроспективная оценка результатов ЭКС ЛЖ у детей с атриовентрикулярными блокадами (АВБ). Материал и методы. В одноцентровое ретроспективное исследование включены пациенты с клинически значимой АВБ, которым была выполнена имплантация эпикардиальной системы кардиостимуляции с локализацией желудочкового электрода в проекцию верхушки ЛЖ. В раннем и отдаленном послеоперационных периодах всем пациентам проводилось комплексное обследование, включающее: 12-канальную электрокардиографию (ЭКГ) с оценкой ширины комплекса QRS, контроль функции ЭКС, суточное мониторирование ЭКГ, эхокардиографию (ЭхоКГ) по стандартному протоколу с определением показателей сократительной функции ЛЖ, рентгенографию органов грудной клетки в прямой и боковой проекциях. Для минимизации влияния антропометрической вариабельности в детском возрасте конечно-диастолический объем ЛЖ, размеры левого и правого предсердий были выражены в процентах от нормативных значений с учетом массо-ростовых характеристик. Дополнительно оценивались внутрижелудочковая диссинхрония (ВД) методом тканевой допплерографии и глобальная продольная деформация (ГПД) ЛЖ с использованием Speckle-tracking ЭхоКГ. Результаты. В период с 2013 по 2024 гг. 36 пациентам выполнена первичная имплантация эпикардиальной системы ЭКС с локализацией желудочкового электрода на верхушке ЛЖ (33 двухкамерные системы в режиме DDD, 3 однокамерные – в режиме VVI). Медиана возраста пациентов на момент операции составила 4 [1;7] года, от 14 дней до 14 лет. У всей группы в раннем послеоперационном периоде и в ходе длительного наблюдения (до 9 лет) отсутствовали клинические признаки сердечной недостаточности и эхокардиографические маркеры ПИКМП. Выводы. Эпикардиальная ЭКС ЛЖ у детей с АВБ демонстрирует благоприятные отдаленные результаты, включая сохранение систолической функции, внутрижелудочковой синхронности и отсутствие признаков ПИКМП. Полученные данные подтверждают целесообразность выбора верхушки ЛЖ в качестве оптимальной точки имплантации у данной категории пациентов.
Эпикардиальная стимуляция левого желудочка, пейсмейкер-индуцированная кардиомиопатия, детская кардиология
Короткий адрес: https://sciup.org/149149301
IDR: 149149301 | УДК: 616.124.2-053.2-073.7 | DOI: 10.29001/2073-8552-2025-2665
Текст научной статьи Оценка результатов эпикардиальной электрокардиостимуляции левого желудочка у детей
Постоянная электрокардиостимуляция (ЭКС) является единственным методом лечения у пациентов с клинически или гемодинамически значимыми атриовентрикулярными блокадами (АВБ). Перспектива длительной, исчисляемой десятилетиями, ЭКС в совокупности с активным антропометрическим ростом в педиатрической когорте создает предпосылки для неоднократной смены систем ЭКС. Выбор способа реализации ЭКС с оптимальным позиционированием электродов на этапе первичной имплантации у детей определяет долгосрочную терапев- тическую стратегию, уменьшая риск развития острых и хронических осложнений в течение жизни.
В нашем центре с 2007 г. проведена 291 имплантация систем ЭКС детям в возрасте от 14 дней до 14 лет: при АВБ (n = 230), синдроме слабости синусового узла (n = 41) и бинодальной болезни (n = 20). В 147 случаях (47%) вторичная брадикардия развилась после хирургической коррекции врожденного порока сердца (ВПС), тогда как у 165 пациентов (53%) наблюдался первичный характер нарушения ритма сердца. К последней группе относятся врожденные (в том числе ассоциированные с аутоиммунными заболеваниями матери или внутриутробными инфекциями), а также приобретённые (на фоне миокардитов, нейромышечных заболеваний, генетически детерминированных кардиомиопатий) формы, вагус-ассоциированные и идиопатические варианты. До 2013 г. при имплантации эпикардиальной ЭКС электроды фиксировались на правом желудочке, что соответствовало общепринятой хирургической практике.
Отмечено, что такой подход приводит к формированию патологического паттерна возбуждения миокарда, характерного для блокады левой ножки пучка Гиса. Это может способствовать развитию внутрижелудочковой диссинхронии (ВД), так как скорость возбуждения по проводящей системе сердца превышает скорость распространения импульса между кардиомиоцитами («от клетки к клетке»). Хроническая диссинхрония, вызванная задержкой активации базального отдела и боковой стенки ЛЖ, запускает каскад патологических гемодинамических, а впоследствии гистологических изменений, приводящих к структурному ремоделированию сердца и прогрессированию сердечной недостаточности (СН) [1].
По результатам различных исследований, желудочковая диссинхрония, вызванная стимуляций, приводит к снижению сократительной способности миокарда ЛЖ у 5–30% пациентов. Данное состояние при отсутствии других причин СН носит название пейсмейкер-индуцирован-нной кардиомиопатии (ПИКМП). Согласно современному метаанализу австралийских специалистов, распространенность ПИКМП у взрослых пациентов составляет около 12% [2]. Однако между исследованиями наблюдается значительная гетерогенность в методах оценки функции ЛЖ и определения понятия ПИКМП. В настоящий момент не существует четких критериев данного диагноза. По мнению одних авторов, необходимо учитывать снижение ФВ на 10% от исходного и более, другие предлагают учитывать абсолютные значения (снижение до 45–55%), независимо от исходных данных, поэтому распространённость ПИКМП по разным источникам значительно варьирует [3].
В соответствии с результатами исследований, высокий процент стимуляции в совокупности с большой продолжительностью имеют ключевое значение для развития ПИКМП. Перспектива пожизненной ЭКС с высокой частотой сердечных сокращений в детской популяции создает предпосылки для повышения клинической значимости ПИКМП у детей. Однако актуальные представления о данной проблеме основаны преимущественно на исследованиях, проведенных среди взрослых пациентов. В доступной литературе отсутствуют публикации с длительным (более 5 лет) сроком наблюдения за детьми и подростками с ЭКС.
У взрослых бивентрикулярная стимуляция является одним из методов лечения систолической СН на фоне ЭКС. Но в педиатрической практике данный метод не получил широкого распространения ввиду необходимости повторного стернотомического доступа, кратно повышающего хирургические риски при эпикардиальной ЭКС, и антропометрическим ограничениям венозного доступа к коронарному синусу при эндокардиальном способе имплантации.
Для предотвращения развития ПИКМ или отсрочки «перехода» на бивентрикулярную стимуляцию актуальна реализация наиболее физиологичных методов, особенно важных на этапе первичной имплантации ЭКС у детей. Основное внимание специалистов в области детской кардиостимуляции сосредоточено на двух технологиях: имплантации эпикардиального электрода на ЛЖ и эндокардиальной стимуляции проводящей системы сердца. Следует отметить, что последняя методика применима только у детей старшего возраста, достигших определенных антропометрических параметров. Низкие массо-ростовые характеристики ребенка увеличивают непосредственные и отсроченные риски в связи с узким диаметром венозного русла, тонкостенностью сердечных камер и малым размером фиброзного кольца трикуспидального клапана.
Для детей раннего возраста, не достигших целевых массо-ростовых показателей, оптимальным решением является имплантация эпикардиальной системы ЭКС с размещением электрода на верхушке ЛЖ. Первичная имплантация ЭКС с эпикардиальными электродами на ЛЖ в детском возрасте представляет собой стратегически важный подход, направленный на сохранение анатомически важных структур сердечно-сосудистой системы и систолической функции для обеспечения больших возможностей для последующих вмешательств в течение жизни.
Цель данного исследования – оценить клинико-гемодинамические аспекты систолической функции ЛЖ в долгосрочном периоде у детей с первичной АВБ на фоне хронической ЭКС с локализацией электрода на ЛЖ.
Материал и методы
В одноцентровое ретроспективное исследование были включены все дети ( n = 36), которым проведена первичная имплантация ЭКС с эпикардиальным электродом на верхушку ЛЖ в период с 2013 по 2024 гг. (дизайн исследования изображен на рис. 1).
В группу включены 19 детей с врождёнными АВБ, у матери одного из них лабораторно подтвержден дебют аутоиммунного заболевания; 17 пациентов с изолированными АВБ, возникшими в детском возрасте вследствие различных причин (у троих подтвержден перенесенный миокардит, у 14 – идиопатические изолированные АВБ). Вторичные АВБ, возникшие после хирургической коррекции ВПС, а также лабораторно подтвержденные признаки острого миокардита являлись критериями исключения из исследования.
Оценивались следующие данные: возраст, вес пациента, клинический статус и функциональный класс СН (по классификации Ross или NYHA), 12-канальная электрокардиография (ЭКГ), суточное мониторирование ЭКГ (СМЭКГ), эхокардиографические структурные и гемодинамические параметры до имплантации ЭКС.
Всем пациентам проведена первичная имплантация эпикардиальной системы ЭКС с позиционированием желудочкового электрода на проекцию ЛЖ. После осуществления хирургического доступа к ЛЖ посредством нижней срединной стернотомии и перикардиотомии первым имплантировался электрод (анод) для стимуляции верхушки ЛЖ. Далее оперирующий хирург прикладывал и удерживал электрод (катод) на поверхности ЛЖ, в этот момент проводилась запись ЭКГ с целью определения вектора направления комплексов QRS. Катод смещался вдоль поверхности ЛЖ до момента появления на ЭКГ оптимального вектора и ширины QRS, свидетельствующих о наиболее физиологичной стимуляции. После осуществления фиксации желудочкового электрода пациентам с двухкамерными ЭКС к ПП подшивался эпикардиальный
Пациенты с клинически и/или гемодинамически значимой первичной АВБ (л = 36)
QRS, КДО%, ЛП%, ПП%, ФВ% (л = 36)
До операции
Имплантация ЭКС с эпикардиальным электродом на ЛЖ(л = 36)
I Ранний п/о I период
QRS, КДО%, ЛП%, ПП%, ФВ% (л =36)
Из них
GLS, ВД (л = 7)
Отдаленный период
QRS, КДО%, ЛП%, GLS, ВД GLS, ВД
ПП%,ФВ% Из них (л = 16) (л =7) (л = 36) первично повторно

п=23
Рис. 1 Дизайн исследования
Fig 1. Study design биполярный электрод. Затем электроды подключались к корпусу ЭКС. Ложе ЭКС формировалось в эпигастральной области под апоневроз прямой мышцы живота сле-ва1.
Двухкамерные системы ЭКС в режиме DDD были имплантированы 33 пациентам. Трем младенцам (вес до 3 кг, возраст 14-30 дней) были установлены однокамерные системы в VVI-режиме. В раннем и отдаленном послеоперационных периодах пациентам были проведены:
-
• контроль ЭКС для оптимизации параметров стимуляции и выявления дисфункций;
-
• ЭКГ с определением ширины комплекса QRS;
-
• СМЭКГ для выявления нарушений ритмовожде-ния;
-
• рентгенография органов грудной клетки в прямой и боковой проекции для визуализации точки фиксации электрода и исключения признаков нарушения целостности, натяжения электродов или сдавления ими сердца (рис. 2);
-
• ЭхоКГ с оценкой размеров и объемов камер сердца, сократительной функции ЛЖ.
Определение ФВ имеет свои ограничения на фоне ЭКС, поэтому сохранная ФВ ЛЖ не может в полной мере отражать начальную стадию дисфункции ЛЖ [6]. В качестве дополнительного метода выявления предикторов дисфункции ЛЖ с 2020 года в нашем центре начали определять внутрижелудочковую диссинхронию (ВД) ЛЖ и глобальную продольную деформацию (ГПД) ЛЖ. Эти параметры были изучены у 7 пациентов в раннем послеоперационном периоде и в динамическом контроле, а у 16 пациентов определены однократно на отдаленном этапе.
В настоящее время определение ГПД посредством Spekle tracking ЭхоКГ является относительно новым методом диагностики. Показатели ГПД неоднородны у детей разного возраста и зависят от способа расчета. В данном исследовании использовалась компьютерная программа QLab 12 (Philips), с помощью которой алгоритм обработки изображений отслеживает пространственное смещение
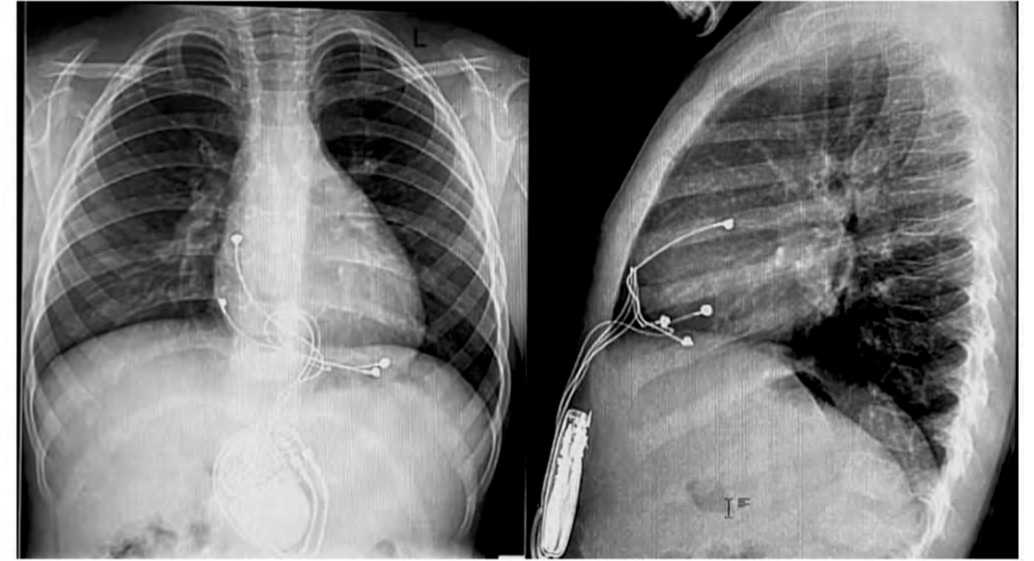
Рис. 2. Пациент Б, 2 года. Рентгенография органов грудной клетки в прямой и боковой проекции на 2-е сутки после имплантации эпикардиальной системы ЭКС с локализацией электрода на верхушке ЛЖ
Fig. 2. Patient B, 2 years old. Chest X-ray in frontal and lateral views on the 2nd day after implantation of an epicardial pacemaker system with the lead localized at the apex of the LV
акустических меток («спеклов») — устойчивых ультразвуковых отпечатков миокарда. Это позволило количественно оценить деформацию миокарда в продольном направлении [7].
Статистический анализ
Статистическая обработка выполнена с помощью программы STATISTICA 10. Непрерывные показатели представлены медианой и межквартильным интервалом, Me [Q1; Q3] . Распределения количественных данных не соответствует нормальному (критерий Шапиро – Уилка), поэтому использованы непараметрические методы проверки гипотез. Сравнение двух зависимых выборок проводили с помощью критерия Уилкоксона. Критический уровень значимости при проверке статистических гипотез составлял 0,05.
Результаты
С 2013 г. в нашем центре выполнены первичные имплантации ЭКС с фиксацией электрода на верхушку ЛЖ 36 пациентам (20 мальчиков и 16 девочек). Медианный возраст детей на момент операции составил 4 [1;7] года, вес – 16,5 [10,1;27,5] кг. Показаниями для имплантации ЭКС у 22 пациентов являлась дилатация ЛЖ; у 12 пациентов – симптомы брадикардии; в 11 случаях выявлено снижение среднесуточной ЧСС ниже 55 ударов в минуту; у 8 пациентов регистрировались паузы ритма, превышающие базовый ритм более чем в 3 раза; у 1 ребенка выявлена желудочковая эктопическая активность на фоне брадикардии [8]. Клинические признаки СН до имплантации ЭКС определялись у 6 детей, из которых у 5 имелась одышка и плохая переносимость физической нагрузки. Лишь у одного пациента отмечались симптомы, соответствующие III функциональному классу СН по классификации Ross (чрезмерная потливость, одышка в покое, недостаточные прибавки массы тела). У остальных 30 пациентов симптомы отсутствовали.
Новорожденным первого месяца жизни ( n = 3) с массой тела менее 3 кг установлена однокамерная система ЭКС (в режиме VVI). В остальных случаях ( n = 33) имплантированы двухкамерные стимуляторы (в режиме DDD). Срок дальнейшего наблюдения за детьми составил 4,4 [1,8; 5,5] года, от 2 до 9 лет. У большинства детей ( n = 32) навязывалась постоянная предсердно-синхронизированная желудочковая ЭКС, что компенсировало хронотропную несостоятельность на фоне АВБ. У 4 пациентов доля стимуляции составляла до 3,9%, так как АВБ носила непостоянный характер, но приводила к значимым паузам ритма до 4 секунд.
Результаты исследования на трех этапах наблюдения приведены в таблице 1.
В послеоперационном и отдаленном периодах медиана ширины комплекса QRS статистически значимо увеличилась до 120 [100; 140] мс, однако этот параметр отражает общее время электрической систолы, а не последовательность активации миокарда. Имеются исследования, что для нормального синхронного сокращения важна последовательность возбуждения, а не его длительность [9]. Объемы ЛЖ и предсердий до имплантации ЭКС были увеличены, как следствие атриовентрикулярной диссинхронии на фоне АВБ и компенсаторного механизма поддержания сердечного выброса (увеличение преднагрузки, активация нейрогуморальных систем, нарушение энергетического метаболизма). Непосредственно после операции наблюдалась нормализация данных показателей, причем достигнутые результаты оставались стабильными в течение всех этапов наблюдения. ФВ по результатам ЭхоКГ претерпевала статистически значимые изменения на дооперационном и послеоперационном этапах. В отдаленном периоде различия стали
Таблица 4 . Отдаленные эхокардиографические показатели пациентов
Table 4 . Long-term echocardiographic parameters of patients
|
Этап наблюдения Параметры |
до операции |
в раннем п/о периоде |
в отдаленном периоде |
р |
|
ЧСС, уд в мин |
53 [50;58] |
103 [84;115] |
83 [74;91] |
р 1–2 < 0,00001 р 1–3 = 0,000018 р 2–3 = 0,000086 |
|
QRS, с |
0,06 [0,05;0,07] |
0,1 [0,08;0,12] |
0,12 [0,1;0,14] |
р 1–2 < 0,00001 р 1–3 = 0,000002 р 2–3 = 0,005960 |
|
ФВ, % |
68,0 [65;72] |
66 [64;68] |
65 [64;67] |
р 1–2 = 0,005349 р 1–3 = 0,080856 р 2–3 = 0,813664 |
|
КДО, % |
143 [121;163] |
105 [94;120] |
96 [93;106] |
р 1–2 = 0,000002 р 1–3 = 0,000105 р 2–3 = 0,423711 |
|
ЛП, % |
161 [133;185] |
119 [108;134] |
108 [99;117] |
р 1–2 = 0,00020 р 1–3 = 0,000018 р 2–3 = 0,000200 |
|
ПП, % |
147 [130;163] |
123 [112;135] |
107 [104;120] |
р 1–2 = 0,000499 р 1–3 = 0,002200 р 2–3 = 0,000499 |
Примечание: ЧСС – среднесуточная частота сердечных сокращений в минуту по результатам суточного мониторирования электрокардиографии; ФВ – фракция выброса левого желудочка по Симпсону; КДО – конечный диастолический объем, выраженный в процентах от долженствующего в соответствии с массо-ростовыми характеристиками ребенка; ЛП – объем левого предсердия, выраженный в процентах от долженствующего в соответствии с массо-ростовыми характеристиками ребенка; ПП – объем правого предсердия, выраженный в процентах от долженствующего в соответствии с массо-ростовыми характеристиками ребенка; р 1–2 – уровень статистической значимости различий до имплантации ЭКС и в раннем послеоперационном периоде; р 1–3 – уровень статистической значимости различий до имплантации ЭКС и в отдаленный период; р 2–3 – уровень статистической значимости различий в ранний послеоперационный и отдаленный периоды.
статистически незначимы и оставались в пределах референтных значений возраста.
С 2020 г. для детализованной оценки функции левого желудочка при сохраненной ФВ в нашем центре используются дополнительные параметры, включающие показатели механической диссинхронии на основании тканевой допплерографии и Speckle-tracking ЭхоКГ. Часть пациентов, прооперированная в этот период, составила группу из 7 человек, которым были проведены данные исследования в раннем послеоперационном периоде. В этой выборке показатели ГПД находились в пределах референтных значений –23 [–24; –19]%, признаки ВД отсутствовали. В динамическом наблюдении у этих пациентов статистически значимых изменений не наблюдалось (р = 0,371093). Сохранялись нормальные показатели ГПД (–24 [–25; –23] %) без диссинхронии (94 [88; 95] мс), что свидетельствует об отсутствии субклинических нарушений сократительной способности миокарда с течением времени. В отдаленном послеоперационном периоде ГПД и ВД были определены первично у 16 пациентов, общая численность исследуемой группы составила 23 человека. У всех обследованных значения ГПД соответствовали возрастной норме –22 [–24; –18] %, а признаки ВД отсутствовали (92,5 [88; 95] мс), что указывает на отсутствие признаков развития ПИКМП на заключительной контрольной точке.
Обсуждение
В настоящее время в детской кардиологии активно внедряются новые подходы к терапии клинически значимых АВБ, предотвращающие развитие ПИКМП. Вместо традиционной имплантации эпикардиального электрода на правый желудочек применяются альтернативные методы, включающие эндокардиальную стимуляцию системы пучка Гиса у пациентов, достигших определенных массо-ростовых параметров. Для детей раннего возраста, у которых эндокардиальная ЭКС нежелательна в силу антропометрических особенностей сердечно-сосудистой системы, современными исследованиями доказана эффективность эпикардиальной стимуляции ЛЖ. Данная методика значительно снижает риск развития электрической диссинхронии и связанных с ней гемодинамических нарушений [9–11].
Наше исследование подтверждает, что ЭКС с фиксацией эпикардиального электрода на верхушку ЛЖ позволяет эффективно сохранять сократительную функцию и синхронность сердечных сокращений на протяжении длительного периода наблюдения. На послеоперационных этапах отсутствовали признаки ремоделирования, отмечались стабильные показатели систолической функции по результатам определения традиционной ФВ ЛЖ и по данным оценки ГПД и ВД.
Особое значение в нашей работе имеет определение показателя ГПД, который свидетельствует о субклиническом нарушении контрактильности и является предиктором развития ПИКМП. В исследовании J. Romanowicz и соавт. [12], включавшем 1 032 пациента в возрасте до 21 года со структурно нормальным сердцем определены нормы ГПД: у новорожденных -22% ± 3; до 1-го года -23% ± 1; 1–5 лет -23% ± 2; 5–10 лет -23% ± 3; 10–14 лет -22% ± 3; 14–18 лет -21% ± 3, что согласуется с полученными нами результатами.
В исследовании M.S. Silvetti и соавт., аналогично нашим наблюдениям, продемонстрировано, что стимуляция ЛЖ эффективна для сохранения сократительной способности и синхронности ЛЖ в большей когорте новорожденных и младенцев ( n = 20), в том числе при длительном мониторинге. Все пациенты показали хорошее клиническое состояние в течение 5 лет без каких-либо симптомов сердечной недостаточности или признаков ПИКМП [13].
Стимуляция с локализацией электрода в области верхушки ЛЖ создает последовательность активации миокарда, максимально приближенную к физиологической. Такой подход обеспечивает естественное распространение возбуждения от верхушки к основанию сердца без задержки активации между перегородкой и свободной стенкой ЛЖ [14]. Эти данные позволяют прогнозировать положительный функциональный эффект у детей с исходно нарушенной сократительной функцией на фоне АВБ.
Важно отметить, что благоприятное влияние левожелудочковой стимуляции на функцию ЛЖ не зависит от выбранного режима стимуляции. С целью снижения стимуляционной нагрузки на сердечно-сосудистую систему у новорожденных предпочтительнее использование VVI-режима [15]. Как продемонстрировали исследования, VVIR-режим эффективен для поддержания достаточной частоты сердечных сокращений (ЧСС) в младенческом возрасте, при этом необходимо отметить, что синдром кардиостимулятора чрезвычайно редко встречается у маленьких детей на протяжении постоянной однокамерной кардиостимуляции (в среднем 11 лет) [16]. Малая частота развития ПИКМП на фоне VVI стимуляции у детей младшего возраста объясняется минимальным предсердным вкладом в сердечный выброс. У трех наших пациентов с однокамерным режимом стимуляции мы не наблюдали снижение ФВ и показателей деформации ЛЖ.
Принципиально, что высокий процент стимуляции с высокой ЧСС при локализации электрода на ЛЖ на фоне DDD-стимуляции не оказывает отрицательного влияния на сократительную способность миокарда, в отличие от стимуляции свободной стенки правого желудочка [17].
Полученные сведения подчеркивают важность тщательного выбора места имплантации электрода при проведении ЭКС у детей с АВБ и структурно нормальным сердцем, поскольку именно это является определяющим фактором долгосрочного сохранения функции ЛЖ [18, 19]. Отсутствие негативной динамики у наших пациентов по всем исследуемым параметрам свидетельствует о клинической эффективности данного подхода в профилактике дисфункции миокарда и перспективности его применения.
Ограничения
Настоящая работа имеет ряд методологических ограничений, которые необходимо учитывать при интерпретации результатов. Исследование проводилось на базе одного центра с относительно небольшим размером выборки пациентов, что характерно для исследований в педиатрической популяции. Еще одной особенностью детского возраста является не только соматическая неоднородность пациентов, но и постоянный процесс роста и развития, что неизбежно влияет на динамические результаты функциональных методов исследования. Для минимизации погрешностей мы использовали соотношение исследованных параметров относительно массо-ростовых характеристик и нормативные значения для конкретного возраста.
Использованная методика оценки сократительной функции ЛЖ основывалась на эхокардиографических измерениях, которые могут демонстрировать определенную степень субъективности и вариабельности между исследованиями. Учитывая эти ограничения, в ходе последующего наблюдения мы дополнили протокол определением ВД и анализом ГПД, что позволило точнее оценить контрактильную функцию миокарда. Этот подход особенно важен для долгосрочного наблюдения пациентов, позволяя уменьшить влияние межиндивидуальной вариабельности.
Несмотря на эти ограничения, полученные результаты имеют достаточную практическую ценность. Для их подтверждения и разработки стандартизированных протоколов в дальнейшем требуется проведение многоцентровых исследований с бóльшим числом пациентов. Мы планируем продолжить работу по накоплению клинического и научного опыта в данном направлении, в том числе дополнить этап первичного обследования до имплантации ЭКС определением показателей ВД и ГПД.
Выводы
В ходе многолетнего наблюдения за когортой детей с изолированной АВБ, которым проводилась левожелудочковая ЭКС, были получены результаты, подтверждающие безопасность и эффективность данного подхода. Несмотря на значительный процент стимуляции с высокой ЧСС у детей, имплантация эпикардиального электрода ЭКС на ЛЖ позволила избежать негативного влияния ЭКС на систолическую функцию ЛЖ и физиологическую синхронность его сокращений. Отсутствие признаков ПИКМП у наших пациентов подтверждено как стандартными эхокардиографическими параметрами, так и показателями Speckle-tracking ЭхоКГ с оценкой деформации миокарда ЛЖ и тканевой допплерографии с оценкой ВД. У всех детей на протяжении длительного периода наблюдения (до 9 лет) поддерживался стабильно хороший клинический статус, отсутствовали жалобы и признаки СН.
Полученные результаты вносят вклад в представление о физиологии влияния хронической ЭКС у пациентов с изолированной АВБ в детском возрасте, подтверждая и дополняя существующие знания в этой области. Данные исследования особенно актуальны в педиатрической практике, учитывая перспективу осуществления пожизненной ЭКС.


