Оценка риска появления резистентности к антибиотикам условно-патогенной и патогенной микрофлоры, выделяемой из продуктов животного происхождения
Автор: Мендыбаева Анара Муратовна, Рузаускас Модестас, Алешина Юлия Евгеньевна, Алиева Гульнур Казыевна, Муканов Габит Бактиярович, Рыщанова Раушан Миранбаевна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 2, 2022 года.
Бесплатный доступ
В статье представлены результаты исследований антибиотикорезистентности условно-патогенной и патогенной микрофлоры Escherichia coli, Salmonellas pp., S. aureus, выделяемой из сырья и продуктов животного происхождения. Дан анализ по содержанию патогенных и условно-патогенных микроорганизмов в мясных продуктах с целью обеспечения их безопасности для человека. Бактериологические и молекулярно-генетические исследования проводились в Научно-исследовательском институте прикладной биотехнологии Костанайского регионального университета имени А. Байтурсынова в 2020-2021 гг. Материалом для исследований являлись образцы сырых и готовых к употреблению пищевых продуктов, отобранных в фермерских хозяйствах (молоко), в торговой сети и на предприятиях общественного питания Костанайской области. Всего исследованию подвергнуто 409 проб пищевых продуктов, из них выделено и идентифицировано 76 микроорганизмов, среди них 28 штаммов - E. coli, 2 штамма - Salmonella spp., 46 - S. aureus. Все исследуемые микроорганизмы проявляли резистентность как минимум к одному антибактериальному препарату, большинство исследуемых штаммов обладали полирезистентностью. Результаты исследований показали, что мясное сырье менее всего обсеменено патогенной микрофлорой, нежели полуфабрикаты, приготовленные из него. Есть предположение, что патогенная микрофлора может проникать в готовые продукты и полуфабрикаты экзогенным путем (через объекты внешней среды, биологических агентов), контактным путем заражения по схемам «животное-человек» и «человек-человек», при нарушении санитарно-гигиенического режима при производстве и хранении мясных продуктов. Полученные результаты свидетельствуют, что на территории Костанайской области Республики Казахстан циркулируют возбудители энтеропатогенных заболеваний, обладающие не только фенотипической, но и генотипической резистентностью к антибактериальным препаратам.
Антибиотикочувствительность, гены резистентности
Короткий адрес: https://sciup.org/140293571
IDR: 140293571 | УДК: 579.62
Текст научной статьи Оценка риска появления резистентности к антибиотикам условно-патогенной и патогенной микрофлоры, выделяемой из продуктов животного происхождения
Acknowledgments : Scientific research has been conducted within the framework of the scientific and technical program BR10764944 "Development of methods for analytical control and monitoring of food safety" for 2021–2023, under the task "Risk analysis of the emergence of resistance to antibiotics in pathogenic microflora isolated from animals and from raw materials and products of animal origin”.
Введение. В 1940-х годах революцию в медицине произвело применение антибактериальных препаратов для лечения инфекционных заболеваний. Впоследствии как неправильное, так и правильное применение антибактериаль- ных средств привело к распространению и формированию устойчивости к данным препаратам. С резистентностью связано снижение эффекта от лечения, более тяжелое и длительное течение болезни, увеличение частоты за- болеваемости, рост количества смертей и увеличение экономического ущерба [1]. В настоящее время международной проблемой, которая требует пристального внимания, для общественного здравоохранения является устойчивость к антибактериальным препаратам. Масштабность этой проблемы демонстрируют ежегодные смерти: в странах Европейского союза 25 тысяч человек умирают от инфекций, вызванных антибиотикорезистентными бактериями [1, 2]. Любое применение антибактериальных средств людям, животным или на растениях может сказаться на формировании и распространении устойчивости к этим препаратам. Помимо этого, резистентность к антибиотикам не признает ни географических, ни биологических границ. Так, если применять антибиотики в одних отраслях, условиях или странах, то это повлияет на распространение устойчивости к ним в других отраслях, условиях или странах [1, 3]. Резистентность к антибиотикам возникает при условии адаптации микроорганизмов к присутствию этих средств и дальнейшему их размножению. Устойчивость к одному определенному антибиотику впоследствии приведет к устойчивости к целому классу. Резистентные к антибактериальным препаратам микроорганизмы сохраняются и передаются через пищу, воду и окружающую среду, при этом на передачу бактерий влияют такие факторы, как торговля, поездки и миграция людей и животных [4].
По данным ВОЗ, ежегодно 600 миллионов человек заболевают из-за последствий употребления пищевых продуктов, которые загрязнены микроорганизмами или химическими веществами, т.е. почти каждый 10-й житель планеты, и умирают 420 000 человек, что приводит к потере 33 миллионов лет здоровой жизни (DALY). Хранение при комнатной или более высокой температуре продуктов питания, таких как ветчина, мясо птицы и картофельно-яичный салат, создает идеальные условия для размножения S. aureus и выделения токсинов. Потребление продуктов питания, содержащих токсины S. aureus , может привести к пищевому отравлению, вызванному энтеротоксином, уже через несколько часов.
Устойчивость к антибактериальным препаратам является проблемой безопасности пищевых продуктов: применение антибиотиков у сельскохозяйственных животных позволяет устойчивым бактериям и генам резистентности передаваться через пищевую цепь от сельскохозяйственных животных людям [5]. Во многих странах мира отмечен рост количества устойчивых штаммов бактерий, выделенных от животных и из продуктов животного происхождения [5, 6]. Как правило, это возможно при употреблении пищевых продуктов, но также, имеет место и при непосредственном контакте с животными или через объекты окружающей среды [6]. Несмотря на принимаемые рядом государств меры, использование антибиотиков продолжает расти в глобальных масштабах в животноводстве и сельском хозяйстве. Прогнозируемый рост спроса на продукты питания животного происхождения может также способствовать более широкому использованию антибиотиков [7, 8].
Проблема антибиотикорезистентности (АБР) существует более 60 лет, однако системные мероприятия по ее профилактике начаты лишь в 80-х годах XX в. Международный союз за разумное применение антибиотиков (Alliance for the Prudent Use of Antibiotics), целью которого является улучшение здоровья людей с помощью образовательных программ и поддержки научных исследований, имеет представительства более чем в 90 странах мира [9–11]. С 2000 г. борьба с антибиотикорезистентностью вышла на мировой уровень и ознаменовалась принятием на Всемирном Дне Резистентности в городе Торонто (Канада) Декларации по борьбе с антимикробной резистентностью [12]. В документе содержатся предложения, которые были приняты многими государствами как руководство к действиям.
Цель исследования – определить резистентность к антибиотикам условно-патогенной и патогенной микрофлоры Escherichia coli , Salmonella spp ., S. aureus , выделяемой из продуктов животного происхождения.
Материал и методы. Материалом для исследований являлись образцы сырых и готовых к употреблению пищевых продуктов, отобранных в фермерских хозяйствах (молоко), в торговой сети и в предприятиях общественного питания Костанайской области. Всего исследовано 409 проб пищевых продуктов, из них: сборное сырое коровье молоко –159 проб; продукты птицеводства: яйца – 50 штук, сырые, свежие, замороженные, охлажденные тушки, полутушки, фарш, субпродукты кур, уток, гусей, индеек – 75
проб; полуфабрикаты (котлеты, пельмени, манты, биточки, шницели, филе, бедро, набор для бульона, суповой набор и т.д.) – 25; блюда общественного питания из мяса или с добавлением мяса птицы (салаты) – 50 проб.
Отбор образцов и подготовку проб к посевам проводили стандартизованными и общепринятыми в пищевой микробиологии методами по ГОСТ 31904-2012 «Продукты пищевые. Методы отбора проб для микробиологических испытаний».
Бактериологические и молекулярно-генетические исследования проводились в Научноисследовательском институте прикладной биотехнологии Костанайского регионального университета имени А.Байтурсынова в 2020–2021 гг.
Выделение и идентификация микроорганизмов. Микроорганизмы выделяли с использованием классических микробиологических методик. Идентификацию бактерий проводили общепринятыми методами на основании морфологических, тинкториальных и биохимических свойств.
Для выделения бактерий рода Escherichia coli использовали жидкие и плотные питательные среды. Для дальнейшего подтверждения принадлежности выросших колоний к E. coli определяли отсутствие оксидазы.
У оксидазоотрицательных грамотрицатель-ных культур определяли возможность образования индола, ацетоина, сероводорода, утилизации цитрата, интенсивности ферментации углеводов с образованием кислоты, ферментации сорбита, глюкозы и лактозы. У каждой отобранной колонии бактерий с целью дифференциации Escherichia от бактерий Citrobacter и Enterobacter проводили температурный тест (Эйкмана), который вместе с цитратным тестом позволяет дифференцировать бактерии группы кишечных палочек фекального происхождения от бактерий группы кишечных палочек, обитающих во внешней среде.
Исследование проб на наличие штаммов рода Salmonella spp. проводили в соответствии с методическими указаниями МУ 4.2.2723-10. Идентификация изолятов проводилась с использованием классического биохимического тестирования, включающего ферментацию углеводов, производство сероводорода, индола, лизиндекарбоксилазы, уреазы, оксидазы, каталазы, MR-VP, а также других обычных тестов. Серотипирование проводили с использованием теста на агглютинацию слайдов с сыворотками к антигенам O и H (Petsal, Россия) в соответствии с инструкцией производителя.
Для выделения S. aureus исследуемый материал микробиологической петлей засевали на поверхность элективных сред, в качестве которых использовали желточно-солевой агар. Посевы бактерий инкубировали при 37 °С в течение 18–24 часов. При обнаружении в мазках по Граму грамположительных кокков делали высевы в жидкую селективную питательную среду – солевой бульон и по помутнению среды определяли присутствие коагулазо-положительных стафилококков. Для получения изолированных колоний культуры пересевали в одну из плотных селективно-диагностических сред: молочносолевой агар, яично-желточно-солевой агар или кровяной агар. Для определения патогенности стафилококков ставили реакцию плазмокоагу-ляции. Наличие дезоксирибонуклеазной активности исследовали посевом на ДНКазную среду с толуидиновым синим.
При наличии патогенного стафилококка в пробе через 18–24 часа наблюдается рост колоний желтого цвета с изменением среды с красного на желтый цвет.
Тестирование изолятов на резистентность к антибиотикам. Профили антибиотико-резистентности культур определяли дискодиффузионным методом в чашках Петри на агаре Мюллера-Хинтона с дефибринированной кровью с использованием дисков с антибиотиками в соответствии с методикой МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» и Е-теста. Для тестирования использовали следующие диски с антибиотиками: ампициллин, амоксициллин, бензилпенициллин, цефоперазон, цефокситин, стрептомицин, канамицин, неомицин, гентамицин, тетрациклин, доксициклин, сульфаметокзол с триметопримом, эритромицин, тилозин. Чувствительность оценивали по диаметрам зон задержки роста в соответствии с рекомендациями, затем изоляты были классифицированы как устойчивые, среднеустойчивые или чувствительные к определенному антибиотику согласно рекомендациям EUCAST (версия 11.0), CLSI и МУК 4.2.1890-04.
Определение генов резистентности. ДНК-материал для молекулярного исследования получали путем бактериального лизиса по реко- мендациям Референтной лаборатории по резистентности к антибактериальным препаратам Европейского союза (Community Reference Laboratory for Antimicrobial Resistance) с небольшими изменениями. Выявление генов, кодирующих устойчивость к противомикробным препаратам, проводили методом ПЦР.
Результаты и их обсуждение. Результаты исследований представлены за период с января по июль 2021 г. В таблице 1 отражены результаты выделения из пищевой продукции условно-патогенных и патогенных микроорганизмов.
Морфологические, тинкториальные и культуральные свойства выделенных изолятов бактерий были характерны для своего семейства и рода.
Таблица 1
животного происхождения
|
Продукция |
Всего проб |
Escherichia coli |
Salmonella spp. |
S. aureus |
|
Сырое коровье молоко |
159 |
– |
– |
43 |
|
Яйца |
50 |
Не выделено |
Не выделено |
Не выделено |
|
Тушки, полутушки птиц: замороженные охлажденные свежие |
||||
|
25 |
1 |
Не выделено |
Не выделено |
|
|
25 |
2 |
Не выделено |
Не выделено |
|
|
25 |
25 |
2 |
3 |
|
|
Фарш мясной |
25 |
Не выделено |
Не выделено |
Не выделено |
|
Полуфабрикаты |
25 |
Не выделено |
Не выделено |
Не выделено |
|
Мясные блюда |
25 |
Не выделено |
Не выделено |
Не выделено |
|
Салаты с добавлением мяса птицы |
25 |
Не выделено |
Не выделено |
Не выделено |
|
Салаты без мяса |
25 |
Не выделено |
Не выделено |
Не выделено |
|
Итого |
384 |
28 |
2 |
46 |
Результаты микробиологического исследования пищевой продукции
Всего исследовано 384 пробы пищевых продуктов животного происхождения на содержание бактерий Escherichia coli , Salmonella spp . и S. aureus , из них 76 проб (19,8 %) не соответствовали требованиям санитарных правил и норм. Так, из 159 исследованных проб сырого коровьего молока всего в 43 пробах (27 %) выявлено содержание микроорганизмов S. aureus . В 75 исследованных тушках/полутушках птиц обнаружено: Escherichia coli в замороженных полу-тушках – 1 (4 %), в охлажденных – 2 (8 %), и во всех 25 свежих тушках обнаружены бактерии, что составляет 100 % обсемененности продукции. Бактерии рода Salmonella spp. выявлены в 2 свежих тушках (8 %). Оценка видового состава изолятов Salmonella spp . показала, что две выделенные культуры принадлежат серотипу S. еnteritidis .
В соответствии с задачей у всех выявленных бактерий дискодиффузионным методом была определена чувствительность/резистентность к 25 антибактериальным препаратам следующих фармакологических групп: бета-лактамы (пенициллины: ампициллин, амоксициллин, бензилпенициллин; цефалоспорины: цефоперазон, цефокситин, цефподоксим), аминогликозиды (стрептомицин, канамицин, неомицин, гентамицин), амфениколы (левомицетин), тетрациклины (тетрациклин, доксициклин), хинолоны и фтор-хинолоны (налидиксовая кислота, ципрофлоксацин, энрофлоксацин, норфлоксацин, офлоксацин), сульфаниламиды (сульфаметоксазол с триметопримом), нитрофураны (фурадонин, фуразолидон).
Интерпретацию полученных данных проводили согласно инструкции к «Набору дисков для определения чувствительности к противомик-робным препаратам – 1» [13], в соответствии с действующими рекомендациями European Committee on Antimicrobial Susceptibility Testing
(EUCAST) [14] и стандартом CLSI [15] (в случае отсутствия клинических контрольных точек), а также в соответствии с МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» [16].
Тестирование бактерий на антибиотикорези-стентность показало, что все исследуемые бактерии были резистентными как минимум к одному антибактериальному препарату. Причем большинство исследуемых штаммов бактерий обладали полирезистентностью, то есть были устойчивы к двум и более группам антибактериальных препаратов.
Из 28 штаммов Escherichia coli – 4 (14,3 %) проявили резистентность к антибактериальным препаратам группы аминогликозидов (стрептомицин и канамицин), тетрациклинов (тетрациклин), фторхинолонов и нитрофуранов. Наи- меньшее число изолятов (3,6 %) показали невосприимчивость к цефоспоринам и сульфаниламидам (рис.).
Штаммы Salmonella spp . показали 100 % устойчивость к тетрациклину, помимо этого 1 штамм был устойчив сразу к 2 антибиотикам, относящимся к группе аминогликозидов (стрептомицину и канамицину), в целом к данной группе антибиотиков резистентость была также 100 %. К антибактериальным препаратам группы бета-лактамов, цефалоспоринов, сульфаниламидов и нитрофуранов у выделенных изолятов Salmonella spp . обнаружена чувствительность.
Следует отметить, что бактерии S. aureus , выделенные из молока коров, были почти на 11 % (5 изолятов) устойчивы к антибиотикам группы аминогликозидов и тетрациклинов.
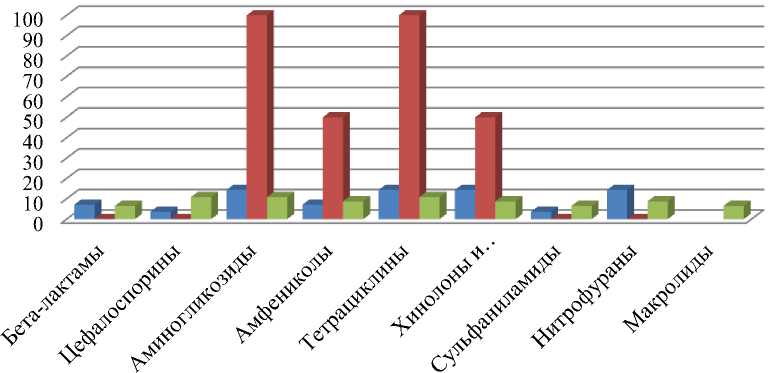
■ Escherichia coli ■ Salmonella spp. ■ S.aureus
Резистентность штаммов к антибактериальным препаратам
В целом из всех 76 микроорганизмов наибольшее количество изолятов проявили устойчивость к антибактериальным препаратам группы аминогликозидов и тетрациклинов – 12 штаммов, что составило 16 % от общего числа микроорганизмов. Наименьшее количество микроорганизмов проявили резистентность к сульфаниламидам (5 %) и цефалоспоринам (3 %). Среди исследованных штаммов и S. aureus не обнаружена чувствительность ни к одной из взятых групп антибактериальных препаратов.
Для определения генетических профилей резистентности грамотрицательных бактерий были использованы праймеры, которые подбирались нами с учетом использования классов антибиотиков и антимикробных препаратов в ветеринарной практике.
В результате проведенных исследований 76 проб, проявлявших фенотипическую резистентность к антибактериальным препаратам, были протестированы методом ПЦР на наличие генов, кодирующих резистентность. Результаты представлены в таблицах 2, 3 и 4.
Гены резистентности эшерихий
Таблица 2
|
Группа антибиотиков |
TEM |
SHV |
OXAI |
OXAIII |
ctxM |
ctxM2 |
cmy |
PER |
PER2 |
|
Бета-лактамы |
3 |
3 |
|||||||
|
Аминогликозиды |
rmtB |
armA |
aacA4 |
aac(3)II |
aphA1 |
aadB |
aadA |
strA |
strB |
|
1 |
3 |
1 |
|||||||
|
Тетрациклины |
tetA |
tetB |
– |
– |
– |
– |
– |
– |
– |
|
4 |
3 |
||||||||
|
Сульфаниламиды |
SUL1 |
SUL2 |
SUL3 |
dfr1 |
dfr5 |
dfrA7 |
– |
– |
– |
|
1 |
|||||||||
|
Амфениколы |
cmlA |
catII |
– |
– |
– |
– |
– |
– |
– |
|
Хинолоны |
qnrA |
qnrB |
qnrS |
qepA |
– |
– |
– |
– |
– |
По результатам тестирования 26 проб ДНК E. coli выявлены гены резистентности к бета-лактамам TEM и OXAI в 3 пробах каждый, к аминогликозидам aadB – 1 проба, aadA – 3 пробы и strA – 1 проба, тетрациклинам: tetA – 4 пробы, tetB – 3 пробы, сульфаниламидам (SUL3) – 1 проба. Генов, кодирующих резистентность к антибактериальным препаратам группы амфениколов и хинолонов, обнаружено не было.
Результаты тестирования 46 проб ДНК S. aureus на наличие генов резистентности представлены в таблице 3.
В процессе исследования ДНК S. aureus были обнаружены гены, кодирующие резистентность микроорганизмов к антибактериальным препаратам:
– группы бета-лактамов – ген blaZ, тетрациклинов – tetK и tetM – в 4 исследованных образцах;
– группы аминогликозидов и макролидов, гены aph(3) и ermC – в 2 ДНК каждый.
В результате тестирования ДНК S. aureus гены, кодирующие резистентность к антибиотикам группы сульфаниламидов и амфениколов, не выявлены.
Таблица 3
|
Группа антибиотиков |
blaZ |
mecA |
mecC |
– |
|
Бета-лактамы |
4 |
– |
– |
– |
|
Макролиды |
ermC |
ermB |
ermA |
msrA |
|
2 |
– |
– |
– |
|
|
Аминогликозиды |
aac(6)-aph2 |
aph(3) |
ant(6) |
– |
|
– |
2 |
– |
– |
|
|
Тетрациклины |
tetK |
tetM |
– |
– |
|
3 |
1 |
– |
– |
|
|
Сульфаниламиды |
dfrG |
dfrK |
– |
– |
|
– |
– |
– |
– |
|
|
Амфениколы |
catA9 |
fex |
cfr |
– |
|
– |
– |
– |
– |
Таблица 4
|
Группа антибиотиков |
TEM |
SHV |
OXAI |
OXAIII |
ctxM |
ctxM2 |
cmy |
PER |
PER2 |
|
Бета-лактамы |
1 |
||||||||
|
Аминогликозиды |
rmtB |
armA |
aacA4 |
aac(3)II |
aphA1 |
aadB |
aadA |
strA |
strB |
|
1 |
1 |
1 |
|||||||
|
Тетрациклины |
tetA |
tetB |
– |
– |
– |
– |
– |
– |
– |
|
1 |
|||||||||
|
Сульфаниламиды |
SUL1 |
SUL2 |
SUL3 |
dfr1 |
dfr5 |
dfrA7 |
– |
– |
– |
|
1 |
2 |
||||||||
|
Амфениколы |
cmlA |
catII |
– |
– |
– |
– |
– |
– |
– |
|
Хинолоны |
qnrA |
qnrB |
qnrS |
qepA |
– |
– |
– |
– |
– |
Гены резистентности стафилококков
Гены резистентности сальмонелл
Из представленных данных в таблице 4 видно, что гены резистентности сальмонелл были выявлены в 4 из 6 исследуемых групп антибиотиков. Наиболее часто были выделены гены, кодирующие резистентность к аминогликозидам (гены aadA, strA, strB) и сульфаниламидам (гены SUL2 и dfr1). Гены, кодирующие резистентность к амфениколам и хинолонам, обнаружены не были.
Заключение. По результатам проведенных нами исследований можно сделать вывод, что мясо, мясные и молочные продукты могут представлять серьезную опасность для здоровья человека, если они получены с нарушением санитарно-гигиенического режима при заготовке и на этапах обращения пищевой продукции (хранение, транспортирование и реализация). Усугубляет ситуацию и значительная распространенность резистентности микроорганизмов в продукции животноводства.
Таким образом, проведенные исследования позволяют сделать следующие выводы:
– из 384 исследованных проб выделено и идентифицировано 76 микроорганизмов, из них 28 штаммов – E. coli , 2 штамма – Salmonella spp ., 46 – S. aureus ;
– все исследуемые микроорганизмы проявили резистентность как минимум к одному антибактериальному препарату, большинство исследуемых штаммов обладали полирезистентностью;
– наибольшее количество изолятов проявили фенотипическую устойчивость к антибактериальным препаратам группы аминогликозидов и тетрациклинов – 12 штаммов, что составило 16 % от общего числа микроорганизмов;
– наименьшее количество микроорганизмов проявили резистентность к сульфаниламидам (5 %) и цефалоспоринам (3 %);
– у 14,5 % микроорганизмов обнаружены гены кодирующие резистентность к бета-лактамным антибиотикам, у 12 % – к аминогли-козидным препаратам. Гены резистентности к амфениколам и хинолонам выявлены не были.
Полученные результаты свидетельствуют, что на территории Костанайской области Республики Казахстан циркулируют возбудители энтеропато-генных заболеваний, обладающие не только фенотипической, но и генотипической резистентностью к антибактериальным препаратам.
Список литературы Оценка риска появления резистентности к антибиотикам условно-патогенной и патогенной микрофлоры, выделяемой из продуктов животного происхождения
- Всемирная организация здравоохранения. Борьба с устойчивостью к антибиотикам с позиций безопасности пищевых продуктов в Европе. 2016. Scherfigsvej 8, DK-2100 Copenhagen 0, Denmark // СПС Консультант Плюс.
- EFSA (European Food Safety Authority) and ECDC (European Centre for Disease Prevention and Control), 2017.The European Union summary report on antimicrobial resistance in zoonotic and indicator bacteria from humans, animals and food in 2015 // EFSA Journal. 2017. № 15(2):4694, 212 pp. DOI: 10.2903/j. efsa.2017.4694.
- Pal C., Bengtsson-Palme J., Kristiansson E, Larsson DGJ: The structure and diversity of human, animal and environmental resisto-mes // Microbiome, 4, 54 (2016). DOI: 10.1186/s40168-016-0199-5.
- Глобальный план действий по борьбе с устойчивостью к противомикробным препаратам, ВОЗ 2016 // СПС Консультант Плюс.
- Maron D.F., Smith T.J, Nachman K.E. (2013). Restrictions on antimicrobial use in food animal production: An international regulatory and economic survey // Global Health 9:48. DOI:10.1186/1744-8603-9-48.
- Alanis A.J. 2005. Resistance to antibiotics: are we in the post antibiotic era. Arch. Med. Res., 36:697-705.
- Lammie S.L., Hughes J.M. Antimicrobial Resistance, Food Safety, and One Health: The Need for Convergence // Annual Review of Food Science and Technology № 7 (2016) P. 287-312. DOI: 10.1146/annurev-food-041715-033251.
- Забровская А.В. Чувствительность к антимикробным препаратам микроорганизмов, выделенных от сельскохозяйственных животных и из продукции животноводства // Journal Vetpharma. 2012. № 5.
- Wageningen university and research. Healthy animals without antibiotics. Access: 17-09-2017. URL: http://www.wur.nl/en/article/Healthy-animals-without-antibiotics.htm.
- Кулмагамбетов И.Р., Сарсенбаева С.С., Рамазанова Ш.Х. и др. Современные подходы к контролю и сдерживанию антибио-тикорезистентности в мире // Международный журнал прикладных и фундаментальных исследований. 2015. 9 (Ч. 1) С. 54-59.
- Европейский стратегический план действий по проблеме устойчивости к антибиотикам. ВОЗ. Европейский региональный комитет. Шестьдесят первая сессия. 10 июня 2011 г. Scherfigsvej 8, DK-2100 Copenhagen 0, Denmark // СПС Консультант Плюс.
- Декларация по борьбе с антимикробной резистентностью. 16 сентября 2000 года, Торонто, Онтарио, Канада // СПС Консультант Плюс.
- НД-ПМП-1 - Набор дисков для определения чувствительности к противомикробным препаратам - 1. ТУ 9398-006-01967164-2009. Регистрационное удостоверение № ФСР 2009/06290 от 10.12.2009 г. / ФБУН НИИ эпидемиологии и микробиологии им. Пасте-ра, Россия, Санкт-Петербург.
- European Committee on Antimicrobial Susceptibility Testing Breakpoint tables for interpretation of MICs and zone diameters Version 9.0, valid from 2019-01-01, Р. 96.
- CLSI M100-ED29:2019 Performance Standards for Antimicrobial Susceptibility Testing, 29th Edition. Wayne, PA: Clinical and Laboratory Standards Institute; 2019.
- МУК 4.2.1890-04. Определение чувствительности микроорганизмов к антибактериальным препаратам: метод. указания. М.: ФЦГиЭРоспотребнадзора, 2004. Введ. с 04.03.2004.


