Оценка сцепления гена PLARG, контролирующего устойчивость к ложной мучнистой росе у подсолнечника, и микросателлитных локусов ДНК
Автор: Рамазанова С.А., Бадьянов Е.В., Савиченко В.Г., Гучетль С.З., Стрельников Е.А.
Рубрика: Селекция, семеноводство и биотехнология
Статья в выпуске: 3 (191), 2022 года.
Бесплатный доступ
Ложная мучнистая роса, вызываемая оомицетом Plasmopara halstedii (Farl.) Berl. et de Toni, - одна из наиболее вредоносных болезней подсолнечника. В настоящее время перспективным для использования в селекции является локус Plarg, обеспечивающий устойчивость ко всем известным расам P. halstedii. Этот ген интрогрессирован из дикорастущего вида Helianthus argophyllus. Микросателлитные маркеры (SSR) позволяют управлять переносом генов, контролирующих устойчивость в селекционном материале. Однако необходима валидация маркера для доказательства его надежности при выявлении генов. Для идентификации гена Plarg подобраны SSR-маркеры ORS 662, ORS 509 и ORS 822. Их валидацию проводили на гибридных комбинациях линий подсолнечника селекции ВНИИМК ВК 776 и ВК 925 с линией подсолнечника RHA 419, являющейся донором гена Plarg. Предварительно было установлено, что эти линии отличаются друг от друга аллельным состоянием этих локусов. Исследование поколения F1 показало, что все три микросателлитных локуса наследуются кодоминантно. Полученное путем самоопыления поколение F2 было проанализировано фитопатологическими методами на устойчивость к P. halstedii. Анализ расщепления по фенотипу в обеих комбинациях скрещиваний показал, что фактически наблюдаемое расщепление соответствовало теоретически ожидаемой модели 3 : 1 при моногенном наследовании признака. Анализ сцепления гена и микро-сателлитных локусов показал, что частоты рекомбинации в скрещивании RHA 419 х ВК 776 составили для локуса ORS 662 - 0,11, ORS 509 - O, 23 и ORS 822 - 0,31. А для комбинации RHA 419 х ВК 925 этот показатель составил: для ORS 509 - 0,28, для ORS 662 - 0,34. На основании полученных данных сделан вывод, что для применения в маркер-ассоциированной селекции (МАС) подсолнечника на устойчивость к возбудителю ложной мучнистой росы необходимо использовать три изученных микросателлитных локуса.
Подсолнечник, plasmopara halstedii, гены устойчивости, микросателлитные маркеры, маркер-ассоциированная селекция (мас)
Короткий адрес: https://sciup.org/142236118
IDR: 142236118 | УДК: 631.523:633.854.78 | DOI: 10.25230/2412-608X-2022-3-191-14-23
Текст научной статьи Оценка сцепления гена PLARG, контролирующего устойчивость к ложной мучнистой росе у подсолнечника, и микросателлитных локусов ДНК
Введение. Одна из наиболее вредоносных болезней подсолнечника – ложная мучнистая роса, вызываемая оомицетом Plasmopara halstedii (Farl.) Berl. et de Toni . Потери урожая в благоприятные для развития болезни годы достигают 90 % [1; 2]. Для борьбы с этой болезнью применяют различные приемы. Это агротехнические методы, такие как севооборот, оптимальная густота посева, фитосани-тарные прополки, удаление пораженных корзинок, уборка послеуборочных остатков, зяблевая вспашка [3]. Однако агротехнические приемы являются больше вспомогательной мерой, не давая 100 % гарантии защиты.
Применяют также химические методы защиты от болезни: это обработка семян перед посевом препаратами на основе мефеноксама и опрыскивание в период вегетации фунгицидами группы триазолов и стробилуринов. В последнее время сообщается о том, что оомицет приобрел устойчивость к фунгицидам. Это ограничивает эффективность химических веществ и поднимает вопрос об экономи- ческой целесообразности их использования [4; 5; 6].
Наиболее экологичная стратегия предотвращения потерь урожая подсолнечника, вызванных патогеном, заключается в поиске новых генов устойчивости и введении их в селекционный материал.
Существуют две категории устойчивости подсолнечника к P . hal stedii . Это качественная устойчивость, вызванная основными генами Pl, и количественная, которая контролируется несколькими генами ( QTL) [7]. На сегодняшний день у подсолнечника идентифицировано 36 основных генов Pl, расположенных в пяти группах сцепления ( LG 1, 2, 4, 8 и 13) [8 ; 9; 10] и трех QTL , расположенных в LG7, LG 10 и LG8 [7; 11]. Один или несколько основных генов Pl 1 , Pl 2 , Pl 5 , Pl 6 , Pl 7 и Pl 8 обеспечивали устойчивость ко всем расам P. halstedii и до начала 2000 - х годов широко использовались в селекции на устойчивость. К сожалению, из - за возникновения новых рас устойчивость многих из этих генов была преодолена в полевых условиях [6].
Перспективным является введение в селекционный материал гена P l arg , контролирующего устойчивость ко всем известным на сегодняшний день расам. В литературных источниках сообщается , что ген Pl arg был интрогрессирован в культурный подсолнечник из дикорастущего вида H. argophyllus в 1989 г . американским исследователем Seifer G.J. [13]. Он путем скрещивания линии культурного подсолнечника HA 89 и H. argophyilus получил линию ARG-1575- 2, несущую ген P l arg . Затем были получены четыре инбредные линии RHA 419, RHA 420, RHA 443 и RHA 464, несущие этот ген и используемые во многих селекционных программах в течение двух десятилетий. При этом RHA 419 и RHA 420 были получены непосредственно из линии ARG -1575-2, тогда как линии RHA 443 и RHA 464 – из линии RHA 419 [14 ; 15].
Ген Pl arg был картирован в группе сцепления LG 1. Классический генетический анализ, основанный на фенотипировании сегрегирующих популяций, показал, что он не сцеплен с другими генами Pl 14 , Pl 13 и Pl 16 , находящимися в этой же группе сцепления [18]. Pl arg является основным локусом Pl, по - прежнему эффективен против всех известных рас P. halstedii и способен контролировать ложную мучнистую росу в течение длительного периода времени [16 ; 17]. Введение этого гена в селекционный материал позволит создать линии и гибриды подсолнечника с комплексной устойчивостью к расам патогена. Для значительного сокращения времени и затрат на их создание необходимо использовать методы ранней и точной диагностики носителей гена Pl arg в гибридной популяции, а именно молекулярное маркирование данного гена.
В литературе опубликован ряд молекулярных маркеров, сцепленных с локусом Pl arg [19; 20; 21]. При разработке молекулярного маркера, как правило, используется ограниченное число генотипов, а степень сцепления с маркируемым геном определяется на основе анализа одной - двух расщепляющихся популяций. Поэтому всегда необходима валидация молекулярных маркеров на широком наборе генотипов перед практическим использованием маркера в селекции.
Цель данной работы - исследовать микросателлитные молекулярные маркеры из литературных источников, сцепленные с геном Pl arg , для подтверждения их связи с геном в генотипах селекции ВНИИМК и определить их диагностическую ценность для практического использования в селекции на устойчивость к возбудителю ложной мучнистой росы.
Материалы и методы. Валидацию молекулярных маркеров ORS 662, ORS 509 и ORS 822 проводили на гибридных комбинациях линий подсолнечника RHA 419 х ВК 776 и RHA 419 х ВК 925.
Скрещивания проводили в условиях теплицы по следующей схеме: ♀ RHA 419 16
х ^ ВК 776 и $ RHA 419 х ^ ВК 925. Корзинку накрывали изолятором из нетканого материала. В течение последующих 4-5 дней кастрировали цветки в фазе выхода тычиночных нитей из венчика в пределах каждого вновь зацветающего пояса. Отцовские растения также изолировали перед цветением. Пыльцу для опыления собирали и наносили на рыльца пестиков материнских растений [22]. Гибриды F 1 выращивали в поле. Затем было проведено самоопыление растений F 1 и получено потомство F 2 . Растения поколения F 2 тестировали в лабораторных условиях методом искусственного заражения на устойчивость и восприимчивость к ложной мучнистой росе [23].
Для выделения ДНК использовали фрагменты зеленых листьев подсолнечника. Экстракцию ДНК проводили с использованием набора для выделения DiamondDNA Plant kit (Россия). Концентрацию ДНК в полученных препаратах определяли визуально по интенсивности свечения пробы объемом 10 мкл в ультрафиолетовом свете в 1% - ном агарозном геле с добавлением 2 мкл бромистого этидия. Для ПЦР - анализа применили по три пары праймеров, разработанных для маркирования локуса Pl arg : ORS 662 (F:
CGGGTTGGATATGGAGTCAA, R: CCTTTACAAACGAAGCACAATTC), ORS 509 (F: CAACGAAAAGACAGAATCGAAA, R: CCGGGAATTTTACAAGGTGA) и ORS 822 (F: CAATGCCATC TGTCATCAGCTAC, R: AAACAAACCTTTGGACGA AACTC) [24].
Полимеразную цепную реакцию выполняли в реакционной смеси объемом 25 мкл следующего состава: 67 mM трис - HCl, рН 8,8; 16,6 mM сульфата аммония; 1,5
3,0 mM MgCl2; 0,01 % Tween 20; 200 μM dNTP; по 0,5 μM каждого праймера; 10 нг геномной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (НПО «Сибэнзим», РФ). Амплификацию ДНК проводили в термоциклере MiniAmp Plus (Thermo Fisher Scientific, США). Темпера- турно-временные режимы амплификации описаны ранее [25].
Электрофорез продуктов амплификации проводили в 2% - ном агарозном и 8%- ном полиакриламидном гелях. Использовали камеры SE- 20 и VE - 20 для горизонтального и вертикального электрофореза соответственно (Хеликон, Россия). Результаты электрофореза документировали при помощи гель - документирующей видеосистемы BIO PRINT (Vilber Lourmat, Франция). Размер фрагментов ДНК определяли с использованием программного обеспечения BioCapture (Vilber Lourmat, Франция) относительно маркера длины фрагментов ДНК GeneRuler 100 bp DNA Ladder Thermo Scientific (Сибэнзим, Россия).
Математическую обработку результатов расщепления проводили с использованием χ 2 - критерия соответствия фактических расщеплений, теоретически ожидаемым в моно - и дигибридных скрещиваниях. Расчет частоты рекомбинации r и ошибку рекомбинации s p по результатам расщепления в F 2 рассчитывали по методу максимального правдоподобия [26].
Результаты и обсуждение. Для валидации молекулярных маркеров ORS 662, ORS 509 и ORS 822 и определения их диагностической ценности были отобраны устойчивая ко всем расам линия RHA 419 и восприимчивые линии ВК 776 и ВК 925. Эти линии также отличаются по мик-росателлитным профилям от линии RHA 419 [25].
Как правило, SSR-маркеры имеют кодоминантное наследование, у гибридов F1 в микросателлитном профиле присутствуют фрагменты обоих родителей, однако бывают и исключения. Imerovski с соавторами сообщали, что локус ORS 509 имеет доминантное наследование [20]. Однако результаты нашего исследования поколения F1 показали, что он наследуется кодоминантно так же, как локусы ORS 662 и ORS 822. Так как техника искусст- венного скрещивания сводится к выполнению двух операций: кастрации цветков материнских линий и опылению их пыльцой, собранной с отцовских особей, не всегда достигается 100%-ная гибридность растений. Анализ ДНК позволяет достоверно определить негибридные растения и исключить их из дальнейшей работы. У полученных нами образцов поколения F1 по изучаемым локусам выявлены фрагменты обеих родительских линий. На рисунке 1 для примера представлена электрофореграмма продуктов амплификации ДНК с праймером ORS 662. У образцов на дорожках 1-20 выявлены фрагменты обеих родительских линий, представленных на дорожках 21-24 и 2528. Аналогичный результат получен и с праймерами ORS 509 и ORS 822.
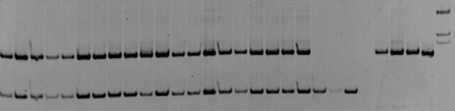
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 М
Рисунок 1 – Электрофореграмма продуктов амплификации ДНК образцов подсолнечника поколения F 1
по локусу ORS 662:
дорожки 1-5, 11-15 - RHA 419 х ВК 776;
6-10, 16-20 - RHA 419 х ВК 925, 21-22 - ВК 925,23 - ВК 776, 25-28 RHA 419, М - маркер молекулярного веса 100 bp (ориг.)
На основании полученных результатов из поколения F 1 было отобрано и само-опылено по пять растений для получения поколения F 2 . Анализ расщепления по устойчивости подсолнечника к ложной мучнистой росе для комбинаций скрещиваний RHA 419 х ВК 776 и RHA 419 х ВК 925, выполненный по результатам фитопатологической оценки, показал, что фактически наблюдаемое расщепление по фенотипу соответствовало теоретически ожидаемой модели 3 : 1 при моногенном наследовании признака. Для комбинации
RHA 419 x ВК 776 из 144 растений потомства F 2 пораженных растений было 38. А для комбинации RHA 419 x ВК 925 из 102 проанализированных растений пораженных было 18.
Критерий χ 2 , характеризующий соответствие фактических расщеплений теоретически ожидаемым, подтвердил доминантное моногенное наследование устойчивости для обеих комбинаций (табл. 1).
Таблица 1
Наследование признака устойчивости к ложной мучнистой росе в поколении F 2 при скрещивании линий подсолнечника
|
Ген Pl arg |
Всего растений, шт. |
Теоретически ожидаемое соотношение |
χ 2 |
d f |
P |
|
RHA 419 x ВК 776 |
144 |
3 : 1 |
0,15 6 |
1 |
0 , 2 1 |
|
RHA 41 x ВК 925 |
102 |
3 : 1 |
3,794 |
1 |
0 , 3 4 |
Эти результаты согласуются с данными Wieckhorst с соавторами (2010), которые определили, что локус Pl arg контролируется одним геном и наследуется доминантно [18]. Это является как преимуществом, так и недостатком, поскольку устойчивость, обусловленная такими генами, быстро преодолевается.
Далее был проведен гибридологический анализ поколения F 2 для трех SSR- локусов. Результаты по оценке наследования SSR- локусов для комбинации скрещива ния RHA 419 x ВК 776 представлены в таблице 2.
Таблица 2
Наследование SSR-локусов ДНК ORS 509, ORS 662 и ORS 822 в F 2 при скрещивании линий RHA 419 и ВК 776
|
Локус |
Всего растений, шт. |
Теоретически ожидаемое соотношение |
χ 2 |
d f |
P |
|
ORS 509 |
106 |
1 : 2 : 1 |
38,2 |
2 |
<0 ,05 |
|
ORS 6 62 |
1 13 |
1 : 2 : 1 |
14,9 |
2 |
<0 ,05 |
|
ORS 8 2 2 |
141 |
1 : 2 : 1 |
15,6 |
2 |
<0 ,05 |
Как видно из таблицы 2, все локусы показали несоответствие фактического 18
расщепления ожидаемому соотношению 1 : 2 : 1. В литературе описаны многочисленные примеры такого искажения расщепления. Такое явление наблюдается в 7 -13 % случаев при внутривидовых скрещиваниях. А в скрещиваниях культурных форм с дикорастущими видами встречается значительно чаще - от 23 до 90 % . Например, Imerovski с соавторами (2016) сообщали об искажении расщепления при скрещивании линий с другими генами устойчивости подсолнечника, происходящими из диких видов, например, гена устойчивости к заразихе or ab-vl-8 . В скрещиваниях восприимчивых линий подсолнечника с линией АВ -VL-8, происходящей из многолетнего дикорастущего вида H. divaricatus , несоответствие расщепления было в пользу аллелей от восприимчивой родительской линии либо наблюдался избыток гетерозигот. Согласно предположениям авторов, это происходит из - за того, что ген устойчивости лежит в области искажения сегрегации [27]. При картировании гена Pl arg в скрещиваниях восприимчивой линии с другим донором гена, интрогрессированным из H. argophyl l us , - линией Arg 1575-2, Du^le (2004) с соавторами отмечали похожее искажение расщепления. Из 126 растений поколения F 2 было получено 16 гомозиготных устойчивых, 82 гетерозиготных и 28 гомозиготных восприимчивых , и χ 2 был равен 13,6 [19].
Линия RHA 419, использованная в нашем исследовании, получена в результате скрещивания RHA 373 x Arg 1575- 2. И , несмотря на отсутствие соответствия фактических расщеплений теоретически ожидаемым в поколении F 2 , мы сделали тест на совместное наследование гена Pl arg с изучаемыми SSR- локусами. На рисунке 2 показаны электрофореграммы продуктов амплификации ДНК образцов подсолнечника поколения F2 (RHA 419 x ВК 776), полученные с праймерами ORS 509 и ORS 662. По локусу ORS 509 изученные образцы распределились в пять классов. Это устойчивые и восприимчивые растения, имеющие фракцию размером 195 п.н. такую же , как у линии RHA
419 (рис. 2 a , дорожки 7, 12-15 и 17), восприимчивые растения с фракцией 189 п.н. , как у линии ВК 7 76 (рис. 2 a , дорожки 3, 5, 6, 8 -10, 16 и 18). Растения, имеющие фракции обоих родителей, были как среди устойчивых, так и восприимчивых (рис. 2 a, дорожки 4, 11). Не было выявлено устойчивых растений с фрагментом ДНК, как у восприимчивой линии ВК 776 . По локусу ORS 662 были выявлены четыре класса. В отличие от локуса ORS 50 9 не обнаружено восприимчивых растений с генотипом, как у линии RHA 419. Но среди устойчивых и восприимчивых также были растения, имеющие фракции обоих родителей. По локусу ORS 822 мы наблюдали шесть классов. Это устойчивые и восприимчивые растения, имеющие такую же фракцию, как у линии RHA 419 , восприимчивые растения с фракцией , как у линии ВК 7 76 . Растения , имеющие фракции обоих родителей, были как среди устойчивых, так и восприимчивых. Были выявлены устойчивые растения с фрагментом, как у восприимчивой линии ВК 776. Для отбора устойчивых гетерозиготных растений данные маркеры не применимы. Но их можно использовать для отбора гомозиготных устойчивых растений из расщепляющейся популяции.
(а) (b)
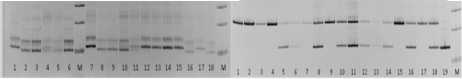
Рисунок 2 - Электрофореграмма продуктов амплификации ДНК образцов подсолнечника поколения F 2 (RHA 4 1 9 х ВК 776) в полиакриламидном геле: ( a ) по локусу ORS 509, дорожки : 1 - RHA 419,
2 - ВК 776, 3 - 1 8 - образцы подсолнечника поколения F 2 ; (b ) по локусу ORS 662 , дорожки 1 - 18 - образцы подсолнечника поколения F 2 , 19 - ВК 776, М - маркер молекулярного веса 100 bp (ориг.)
В таблице 3 представлены данные по оценке совместного наследования гена
Pl arg с SSR- локусами в потомстве F 2 (RHA 419 х ВК 776). Показаны значения % 2 , а также вероятность нулевой гипотезы о независимом наследовании (P) между анализируемыми генами. Тест на совместное наследование показал сцепленное наследование гена Pl arg c локусами ДНК ORS 662, ORS 509 и ORS 822.
Таблица 3
Значения χ 2 между геном Pl arg и SSR-локусами в потомстве F 2 (RHA 419 × ВК 776)
|
Пара локусов |
Всего растений, шт. |
Фактически наблюдаемое соотношение, шт. |
Теоретически ожидаемое соотношение |
χ 2 |
df |
P |
|
Pl arg - ORS 6 6 2 |
113 |
46 : 3 3 : 0 : 0 : 12 : 22 |
3 : 6 : 3 : 1 : 2 : 1 |
89 |
5 |
<0,01 |
|
Pl ag - ORS 509 |
106 |
16 : 31 : 24 : 0 : 5 : 30 |
3 : 6 : 3 : 1 : 2 : 1 |
98 |
5 |
<0,01 |
|
Pl ag - ORS 82 2 |
141 |
35 : 68 : 1 : 13 : 9 : 15 |
3 : 6 : 3 : 1 : 2 : 1 |
42 |
5 |
<0,05 |
Была выполнена оценка частоты рекомбинации между парами локусов Pl arg - ORS 662, Pl arg - ORS 509 и Pl arg - ORS 822. Значения частот рекомбинации, представленные в таблице 4, подтвердили сцепление этих локусов. Частота рекомбинации между парами локусов Pl arg - ORS 662 составила 0,11 ± 0,03, Pl arg - ORS 509 - 0,23 ± 0,04 и Pl arg - ORS 8 2 2 - 0,31 ± 0,05 (табл. 4).
Таблица 4
Значения частот рекомбинации между геном Pl arg и локусами ORS 509, ORS 662 и ORS 822 в F 2 (RHA 419 × ВК 776)
|
Пара локусов |
r |
s p |
|
Pl arg - ORS 509 |
0,23 |
0 ,04 |
|
Pl arg - ORS 662 |
0,11 |
0 ,03 |
|
Pl arg – ORS 8 2 2 |
0,31 |
0 ,05 |
На следующем этапе работы выполнили тест на совместное наследование гена Pl arg с SSR - локусами в потомстве F 2 (RHA 419 х ВК 925). Анализ расщепления ДНК - локусов в поколении F 2 для гибридной комбинации проводили только по двум локусам: ORS 509 и ORS 662. Искажения расщепления в данной комбинации не наблюдалось. Критерий χ 2 по этим локусам составил 3,7 и 4,6 соответственно при Р равном 0,25 (табл. 5).
Таблица 5
Наследование SSR-локусов ДНК ORS 509 и ORS 662 в потомстве F 2 при скрещивании линий RHA 419 и ВК 925
|
Локус |
Всего растений, шт. |
Теоретически ожидаемое соотношение |
χ 2 |
df |
P |
|
ORS 509 |
106 |
1 : 2 : 1 |
3,7 |
2 |
0,25 |
|
ORS 662 |
102 |
1 : 2 : 1 |
4,6 |
2 |
0,10 |
Значения χ 2 между геном Pl arg и SSR - локусами в поколении F 2 для гибридной комбинации RHA 419 х ВК 925 показаны в таблице 6.
Таблица 6
Значения χ 2 между геном Pl arg и SSR-локусами в потомстве F 2 (RHA 419 × ВК 925)
|
Пара локусов |
Всего растений, шт. |
Фактически наблюдаемое соотношение, шт. |
Теоретически ожидаемое соотношение |
χ2 |
df |
P |
|
Pl arg – ORS 509 |
106 |
18 : 45 : 20 : 0 : 5 : 12 |
3 : 6 : 3 : 1 : 2 : 1 |
14,7 |
5 |
<0,01 |
|
Pl arg – ORS 662 |
102 |
17 : 45 : 22 : 0 : 8 : 10 |
3 : 6 : 3 : 1 : 2 : 1 |
12,1 |
5 |
<0,02 |
Тест на совместное наследование показал сцепленное наследование гена устойчивости c локусами ORS 509 и ORS 662. Частота рекомбинации составила 0,28 ± 0,05 для пары Pl arg - ORS 509 и 0,34 ± 0,05 для пары Plarg - ORS 662 (табл. 7)
Таблица 7
Значения частот рекомбинации между геном Pl arg и локусами ORS 509 и ORS 662 в потомстве F 2 (RHA 419 × ВК 925)
|
Пара локусов |
r |
s p |
|
Pl arg - ORS 509 |
0,28 |
0,05 |
|
Pl arg - ORS 6 62 |
0,34 |
0,05 |
Результаты нашего исследования показали, что частоты рекомбинации между геном Pl arg и изученными локусами в обеих комбинациях скрещиваний отличались. Причем, если по локусу ORS 509 различия небольшие (0,23 и 0,28), то по ORS 662 они значительнее (0,11 и 0,34). А в исследовании Dußle с соавторами частота рекомбинации по локусу ORS 662
составила 1,9 [19]. В связи с этим мы считаем, что в практической селекции на устойчивость к P. halstedii необходимо применение нескольких молекулярных маркеров.
Многие авторы отмечают, что на оценку расстояния между локусами могут оказать влияние ошибки фенотипирования, потому что идентификация восприимчивого фенотипа как устойчивого при классификации приводит к увеличению класса рекомбинантных генотипов и искажает дистанции на генетической карте [18; 19]. А также на оценку расстояния между генами оказывает влияние еще и искажение расщепления в поколении F 2 у SSR- локусов. Такие данные показывают, что диагностическую ценность молекулярных маркеров необходимо проводить на большем количестве гибридных комбинаций.
Заключение. Таким образом, апробация молекулярных маркеров ORS 509, ORS 662 и ORS 822 гена Pl arg с использованием гибридных комбинаций линий подсолнечника RHA 419 х ВК 776 и RHA 419 х ВК 925 показала, что маркерные аллели в реципиентных линиях ВК 776 и ВК 925 отличались от аллелей линии RHA 419. Изученные микросателлитные локусы наследуются кодоминантно. Ген устойчивости и SSR- локусы наследуются сцеплено. С точки зрения практического их использования в маркерной селекции предпочтительно применять все три локуса ORS 509, ORS 662 и ORS 822, чтобы минимизировать ошибки при отборе устойчивых растений.
Список литературы Оценка сцепления гена PLARG, контролирующего устойчивость к ложной мучнистой росе у подсолнечника, и микросателлитных локусов ДНК
- Markell S.G., Humann R.H., Gilley M., Gulya T.J. [et al.]. Downy mildew pathogen // Compendium of sunfower diseases and pests. American Phytopathology Press, 2016. - P. 115-117.
- Molinero-Ruiz M.L., Melero-Vara J.M., Dominguez J. Inheritance of resistance to two races of sunflower downy mildew (Plasmopara halstedii) in 0wo Helianthus annuus L. linus // Eupkytica. o^003. - Vol. 131. - P. 47-51. DOI: 10.1023/A:1023023722185.
- Пересыпкин В. Ф. Болезни сельскохозяйственных культур. Том 2: Болезни техничеких культур и картофеля. - Киев: Урожай, 1990. -248 с.
- Ивебор М.В., Антонова Т.С., Саукова С.Л., Арасланова Н.М. Ложная мучнистая рота подсолнечника на юге России // Защита и карантин растений. -o0-9.-№ 10.- С. 229-33.
- TthbourieJ.M., Tourvieille J., Tourvieille de Labrouhe D. Rusistance to metaloxyl in isolates of the Plinflower pathogen Plasmopara halstedii V European Journal of Piad Pathology. - 1998 a -Vol 104. - P. 2335-2342. DOI: 10.1023/A: 1008291123239.
- Gulya T.Jl Draper M., Hanbour J., Holen C., Knodel Js, Lamey T.., Myson P. Metalaxyl resistance in sunflower downy mildlw in North Ameruw // In: Procuedings of Df sunfl owur ru -search workshop. Fargo, North Dakota. - 1998. -P.118-123.
- Tourvieille de Labrouhe D., Sierre F., Waaser P., Roche S., Veccr F. Qua^T^^e ru-histancs to downy mildew (Pysmopara halstedii) in sunflower (Helianth4s annuus L.) . huphytica. - 2008: - Vol. 1164. - P. 433444. DO I: 10.1007/sl02C1-008-9298-1.
- Qi L.L., Ma G., Talukder Z.L, Seiler Gig Hulks B.S., Jan C.C. [ut al.]. Moluclüar mapp ing of tkc disease resistance guns and its impact on sunflower brisling // In Poocssdings of tku L9tk Ints-national S шЙ!!.! Confuruncu. ISA, Edir-nu. - 201 6(b). - P. 20-30.
- Qi L.L., Talukder Z.I., Hulke B.S.. Foley M.h. Development and disss ciiccn o\ diagnoitic SNP maTkuag for tku downy milduw resistance gunus PlTgg and Pl\ and makur-assisfud guns pyr/ amiding in sunflower (Helianthus ccnnuus L.) // Mol. Gunst. Genomics. - 2017. - Vol. 292 (3). -P. 551-563. DOI. 10.1007/s00438-017-1290-8.
- Pecrix y.- Penouilh-Suzette C., Munos S., Vear Fs, Godiard L. Tun broad spectrum ru-cisrancus do downy milduw pkysrcally mSppud 20 ttiu sunflower gunomu // Front: Plrnt Sci. -9018. - Vol. 9. - P. 1780. DOI: 10.8889/fpls.201i.01780.
- Vincourt P.z Tssadi F.o Bordat T., Languide N.B., Gouzy J.. Pouilly ad., Viar F. Consunsus mapping of major rusisSancu gunus and indupundunc QTL for quantitative resistance to sunflower downy mildew // Theoretical and Applied Genetics. - 2012. - No 125 (5). - P. 909-920 . DOI: 10. 1 007/s00 1 22-012-1882-y .
- Viranyi F., Gulya T.J., Tou8vieille de Labrouhe D. Recent changes in the pathogenie variability of Plasmopara halstedii (sunflower downy mildew) populations frone different continents // Helia. - 2015. - Vol. 38. d p. 149-162. DOI: 1 0.1515/he lia-201 5 -0009 .
- Seifer G.J. Registration of 13 downy mildew tolerant interspecific sunflower germplasm lines derived from wild annual species // Crop Science. - 19 91. - No 3 1 (6). - P. 171 4- 1716. DOI: 10 .2 135/cropscü991 .0011 1 83x0031000 60093x.
- Mille J.F., Gulya T.J., Seiler G.J. Registration of Five Fertility Restorer Sunflower Germp lasms // Crop science. - 2002. u No 422 (3). - P. 9)83-989. DOI: 10.2135/cropsci 2002.9890.
- Hulke B.S., Miller J.F., Gulya T.J., Vick B.A. Registration of the oilseed sunflower genetic stocks HA 45 8, HA 459, and HA 416 0 posse ssing genes for resiAAance to downy mildew // soumal of Plant Registrations . -2010.-No 4. - P. 93-97.
- Brahm L, Röcher T, Friedt W. PCR-based markers facilitating marker assisted selection in sunflower for resistance to downy mildew // Crop Science. - 2000. - No 40 (3). - P. 149w 158. DOI: 10.2135 / cropsci2000.403676x.
- Gascuel Q., Martinez Y., Boniface M.C., Vear F., Pichon M., Godiard L. The sunflower downy mildew p athogen PlasmopTra halstedii // Molecular Plant Pathology. - 2015. - No 16. -P.^-m . do/ : 10.11n/mpp.12164.
- WieckOorst S., Bachlava 16., Duble C., Tang S., Gao W., Saski C., Knapp SS., Schön C.C., Hahn V., Bauer E. Fine mapping of the sunflower re sistakce Ioces PlARG mrrodsce d from she wiM species Helianthus argophyllus /1 Theor. Appl. Genet. - 2010). -Vul. 121.-P. 1633-1644.
- Dußle C.M., Hahn V., Knapp S.J., Bauer E. P9arg from Helianthus argophyllus is unlinked to other known downy mildew resistance genes in sunflower // Theor. Appl. Genest - 2004. -Vol 109. - I1. 1083-1086 . DOI: 10.1007/s00122-004-1722-9.
- Im4rovski I., Dimitrijevic D., Miladinovic A., Jocim S., Dkdic B. [et al.]. Identification and validation of breeder-friendly DNA markers for Pl^d gene in sunflower // Mol eculAr Breeding. -0014. - Vol. 34 (3). - P. 779-788. DOI: 10.1007/s11o32-014-0074-7.
- Solodenko A. Validation of microsatellite markers of Pl resistance genes to downy mildew of sunflower // Helia. - 2018. - Vol. 41 (68). - P. 73-82. DOI: 10.1515/helia-2017-0026.
- Волгин В.В., Обыдало А.Д. Сравнительная эффективность способов стерилизации пыльцы цветков подсолнечника // Масличные культуры. - 2014. - Вып. 1 (157158). - С. 10-15.
- Iwebor M., Antonova T., Saukova S. Occurrence and distribution of races 713, 733 and 734 of sunflower downy mildew pathogen in the Russian Federation // Helia. - 2018. - Vol. 41 (69). - P. 141-151. DOI: 10.1515/ helia-2018-0015.
- Tang S., Yu J.K., Slabaugh M.B., Shinta-ni K., Knapp J. Simple sequence repeat map of the sunflower genome // Theoretical and Applied Genetics. - 2002. - Vol. 105. - P. 1124-1136. DOI: 10.1007/s00122-002-0989-y.
- Рамазанова С.А., Бадьянов Е.В., Гу-четль С.З. Молекулярные маркеры генов Pl6: Pl13 и Plarg для использования в селекции подсолнечника на устойчивость к ложной мучнистой росе // Масличные культуры. - 2020. -Вып. 3 (183). - С. 20-26.
- Гершензон С.М. Основы современной генетики. - Киев: Наукова думка, 1979. - 508 с.
- Imerovski I., Dimitrijevic A., Miladinovic D., Dedic B., Jocic S., Kocis Tubic N., Cvejic S. Mapping of a new gene for resistance to broom-rape races higher than F // Euphytica. - 2016. -Vol. 209. - P. 281-289. DOI: 10.1007/s10681-015-1597-7.


