Оценка степени заполнения координационной сферы атома металла в Дикарбоксилатах триарилсурьмы и 2-оксо-бис[(карбоксилато)триарилсурьме]
Автор: Ефремов А.Н., Шарутин В.В., Шарутина О.К.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.17, 2025 года.
Бесплатный доступ
На основании данных рентгеноструктурного анализа сорока дикарбоксилатов триарилсурьмы и семи μ2-оксо-бис[(карбоксилато)триарилсурьмы] впервые была проведена количественная оценка степени заполнения координационной сферы атома металла в модели телесных углов лигандов для выявления взаимосвязи степени заполнения координационного пространства (G-параметр) с наличием внутримолекулярных взаимодействий, приводящих к искажению геометрических характеристик молекул. G-параметр (%) для молекул дикарбоксилатов триарилсурьмы варьирует в пределах 80,19-94,90 %. Наиболее характерны значения G-параметра от 86 до 88,5 %. Максимально насыщенные координационные сферы центрального атома (более 90 %) обнаружены для соединений, содержащих метоксигруппы в арильных лигандах, которые координируют на атом сурьмы атомами кислорода. Высокие значения G-параметра (89,41-91,34 %) имеют структуры в которых насыщение координационной сферы обусловлено сильными невалентными взаимодействиями Sb⋅⋅⋅O(=С) (2,543(1)-2,856(6) Å). Стерическая перегруженность приводит к искажению геометрических характеристик молекул, в частности к увеличению одного из экваториальных углов CSbC до 159,3(1)º. В соединениях общей формулы [Ar3SbOC(O)R]2О параметр G варьирует в пределах 86,95-91,05 %, что на 2-4 % больше, чем в дикарбоксилатах триарилсурьмы с аналогичными карбоксилатными лигандами. Параметр G для молекул с линейным строением центрального фрагмента Sb-O-Sb в среднем меньше, чем с угловым. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1821409 (1), 1979844 (2), 1980334 (3), 2121388 (4), 850119 (5), 2089436 (6), 2127828 (7), 1573780 (8), 1573014 (9), 1573486 (10),1883064 (11),1883072 (12), 2055551 (13), 1883065 (14), 1883074 (15), 1573983 (16), 1031560 (17), 2055594 (18), 1015668 (19), 1010868 (20), 1919919 (21), 1880056 (22), 1884115 (23), 1462857 (24), 1576023 (25), 1478437 (26), 1576022 (27), 1457885 (28), 1457894 (29), 1576967 (30), 2178731 (31), 1462849 (32), 2045964 (33), 2060290 (34), 2074511 (35), 2048157 (36), 2041587 (37), 2055804 (38), 2051941 (39), 2077192 (40), 1840588 (41), 2217059 (42), 2225642 (43), 2233180 (44), 2233088 (45), 1841803 (46), 1840585 (47); deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Карбоксилаты триарилсурьмы, молекулярная структура, рентгеноструктурный анализ, координационная сфера, стерический фактор, g-параметр
Короткий адрес: https://sciup.org/147248073
IDR: 147248073 | УДК: 546.865+547.53.024+547.581+548.312.5+548.73 | DOI: 10.14529/chem250202
Текст научной статьи Оценка степени заполнения координационной сферы атома металла в Дикарбоксилатах триарилсурьмы и 2-оксо-бис[(карбоксилато)триарилсурьме]
Известно, что на реакционную способность соединения влияет объем лигандов, который определяет доступность центрального атома к действию реагента. Стерические эффекты, создаваемые лигандами, также могут оказывать влияние на искажение координационного полиэдра центрального атома. Чаще всего для количественного описания таких эффектов используют конический угол Толмана (θ), телесный угол (Ω), энергию отталкивания лиганда (E R ), стерические параметры Тафта–Дюбуа (E S ) [1–4].
Одним из методов оценки заполнения координационного пространства центрального атома лигандами в металлоорганических комплексах является расчет G-параметра, который может быть использован как для синтезированных комплексов, так и для предсказания возможности получения неизвестных соединений. Этот метод основан на расчете телесного угла лиганда и описывает каждый лиганд процентной долей координационной сферы центрального атома, экранированной лигандом. Ряд исследований G-параметров комплексов Ti, Mo и V с такими лигандами, как замещенные три-, тетразолы, тетрагидрофуран, хлор, показал, что существует связь между G-параметром и стабильностью комплексов [5]. Расчет G-параметра для дикарбоксилатов триарилсурмы, которые являются одним из наиболее изученных классов органических соединений сурьмы(V) [6–11], никогда не проводился.
Экспериментальная часть
Для расчета конических (θ, град.) и телесных (Ω, ср) углов лигандов, степени заполнения координационной сферы атома металла лигандами (G-параметр, %), степени заполнения координационного пространства лигандом на расстоянии в 2,28 Å от атома металла (параметр G 2,28 , %), а также перекрывания телесных углов лигандов (G γ , %) использовали программу Solid-G [5]. Представленные в работе параметры определены с погрешностью ±0,02 %.
Для осуществления необходимых расчетов в программе Solid-G требуется файл с расширением .xyz , который должен содержать в себе только тип атома, его номер и координаты. Файл формировали с помощью программ OLEX2 [12] и SHELXL/PC [13].
Расчет искомых параметров проводили очередностью команд, отображаемых в интерфейсе программы Solid-G :
-
1. Select Atom – выбор центрального атома, относительно которого будут проводиться расчёты всех параметров.
-
2. Identify Ligands – определение лигандов, связанных с центральным атомом.
-
3. Calculate Angles – запуск расчетов телесных углов и G-параметров.
-
4. Start Viewer – визуализация рассчитанных G-параметров лигандов.
Синтез соединений и рентгеновские эксперименты их кристаллов осуществлены ранее и описаны в работах [14–32].
Расчет G-параметров проведен с учетом геометрии молекул в кристаллическом состоянии по результатам РСА.
РСА кристаллов осуществлен на дифрактометре Bruker D8 QUEST (автоматический, четырехкружный, Mo K α -излучение, графитовый монохроматор, λ = 0,71073 Å). Учет поглощения, сбор, редактирование данных эксперимента, уточнение параметров элементарной ячейки проведены с использованием программ SMART и SAINT-Plus [33]. Структуры определены прямым методом и уточнены (МНК в анизотропном приближении для неводородных атомов) с помощью программного обеспечения OLEX2 [12] и SHELXL/PC [13]. Протоны помещены в рассчитанные геометрическим способом положения и включены в уточнение структуры в модели «наездника». В некоторых структурах отдельные фрагменты молекул, сольватные молекулы были разупорядо-чены при условиях ограничений на их геометрию и параметры колебаний эллипсоидов смещений. Заселенности разупорядоченных атомов были вычислены автоматически. В кристаллах соединений 5 , 6 , 40 , 42 , 44 и 45 присутствуют по два типа кристаллографически независимых молекул а и б . Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1821409 ( 1 ), 1979844 ( 2 ), 1980334 ( 3 ), 2121388 ( 4 ), 850119 ( 5 ), 2089436 ( 6 ), 2127828 ( 7 ), 1573780 ( 8 ), 1573014 ( 9 ), 1573486 ( 10 ),1883064 ( 11 ),1883072 ( 12 ), 2055551 ( 13 ), 1883065 ( 14 ), 1883074 ( 15 ), 1573983 ( 16 ), 1031560 ( 17 ), 2055594 ( 18 ), 1015668 ( 19 ),
1010868 (20), 1919919 (21), 1880056 (22), 1884115 (23), 1462857 (24), 1576023 (25), 1478437(
1576022 (27), 1457885 (28), 1457894 (29), 1576967 (30), 2178731 (31), 1462849 (32), 2045964(
2060290 (34), 2074511 (35), 2048157 (36), 2041587 (37), 2055804 (38), 2051941 (39), 2077192(
1840588 (41), 2217059 (42), 2225642 (43), 2233180 (44), 2233088 (45), 1841803 (46), 1840585(
; . Основные длины связей и валентные углы приведены в табл. 1 и 2.
Таблица 1
Основные геометрические параметры молекул дикарбоксилатов триарилсурьмы Ar 3 Sb[OC(O)R] 2
|
№ |
Ar, R |
Наибольший угол φ(СSbС), град. |
Ср. знач. d (Sb–C), Å |
Ср. знач. d (Sb–О), Å |
d (Sb···O(=С)), Å |
|
1 |
Ph, C 6 HF 4 -2,3,4,5 |
137,2(1) |
2,103(2) |
2,128(2) |
3,110(2), 2,984(2) |
|
2 |
Ph, C 6 H 2 F 3 -3,4,5 |
135,9(1) |
2,103(2) |
2,121(2) |
3,033(1), 3,033(1) |
|
3 |
Ph, C 6 H 3 F 2 -2,3 |
140,9(1) |
2,112(3) |
2,122(2) |
3,054(2), 2,959(3) |
|
4 |
Ph, C 6 H 3 F 2 -3,4 |
137,5(1) |
2,105(2) |
2,120(2) |
3,020(1), 3,020(1) |
|
5а |
Ph, CF 2 CF 3 |
124,6(2) |
2,095(6) |
2,122(4) |
3,193(5), 3,225(7) |
|
5б |
Ph, CF 2 CF 3 |
124,2(2) |
2,087(4) |
2,124(4) |
3,254(6), 3,212(5) |
|
6а |
Ph, CF 2 CF 2 CF 3 |
124,3(3) |
2,099(7) |
2,134(5) |
3,223(7), 3,227(7) |
|
6б |
Ph, CF 2 CF 2 CF 3 |
124,6(3) |
2,093(7) |
2,133(5) |
3,211(7), 3,216(7) |
|
7 |
p -Tol, CH 2 Cl |
135,7(1) |
2,108(2) |
2,144(2) |
3,079(3), 3,054(3) |
|
8 |
p -Tol, CH 2 Br |
134,4(1) |
2,110(3) |
2,131(2) |
3,101(4), 3,071(3) |
|
9 |
p -Tol, С 6 Н 4 NO 2 -3 |
134,4(2) |
2,101(4) |
2,116(3) |
3,168(3), 3,105(4) |
|
10 |
p -Tol, C 6 H 3 (NO 2 ) 2 -3,5 |
135,8(1) |
2,102(3) |
2,123(2) |
3,061(3), 3,095(2) |
|
11 |
4-FC 6 H 4 , C 6 F 5 |
122,9(2) |
2,101(5) |
2,119(3) |
3,156(4), 3,326(5) |
|
12 |
4-FC 6 H 4 , C 6 HF 4 -2,3,4,5 |
143,0(1) |
2,119(3) |
2,130(2) |
3,065(3), 2,895(3) |
|
13 |
4-FC 6 H 4 , C 6 H 3 F 2 -2,5 |
143,2(1) |
2,121(2) |
2,128(2) |
2,969(2), 2,845(2) |
|
14 |
4-FC 6 H 4 , CF 2 CF 3 |
124,3(1) |
2,090(3) |
2,142(2) |
3,196(3), 3,217(2) |
|
15 |
4-FC 6 H 4 , CF 2 CF 2 CF 3 |
124,5(2) |
2,093(4) |
2,155(3) |
3,202(6), 3,181(6) |
|
16 |
4-FC 6 H 4 , CH 2 Cl |
143,4(1) |
2,106(3) |
2,130(2) |
2,943(2), 2,856(2) |
|
17 |
4-FC 6 H 4 , C 6 H 4 -NHС 6 Н 5 -2 |
146,7(1) |
2,114(3) |
2,127(2) |
2,753(2), 2,842(2) |
|
18 |
4-FC 6 H 4 , C≡CС 6 Н 5 |
139,3(1) |
2,093(2) |
2,155(3) |
2,947(3), 2,909(3) |
|
19 |
4-FC 6 H 4 , C 3 H 5 - цикло |
150,5(1) |
2,121(2) |
2,135(2) |
2,773(2), 2,694(1) |
|
20 |
4-FC 6 H 4 , C 10 H 15 |
147,3(2) |
2,113(4) |
2,121(3) |
2,856(6), 2,741(3) |
|
21 |
4-FC 6 H 4 , C 2 B 10 H 11 |
131,5(3) |
2,093(6) |
2,121(5) |
3,287(7), 3,317(7) |
|
22 |
4-FC 6 H 4 , C 2 B 10 H 10 CH 3 -2 |
127,4(2) |
2,097(4) |
2,123(3) |
3,240(4), 3,350(3) |
|
23 |
3-FC 6 H 4 , C 6 HF 4 -2,3,4,5 |
142,5(2) |
2,113(5) |
2,132(3) |
2,831(4), 2,926(4) |
|
24 |
3-FC 6 H 4 , CH 2 Cl |
144,5(1) |
2,123(3) |
2,128(2) |
2,808(2), 2,932(2) |
|
25 |
3-FC 6 H 4 , CH 2 Br |
143,0(2) |
2,105(6) |
2,119(4) |
2,814(4), 2,930(5) |
|
26 |
3-FC 6 H 4 , C 6 H 4 NO 2 -2 |
141,7(2) |
2,106(6) |
2,105(6) |
3,015(4), 3,005(5) |
|
27 |
3-FC 6 H 4 , C 6 H 3 (NO 2 ) 2 -3,5 |
141,1(1) |
2,111(3) |
2,127(2) |
2,968(2), 2,895(3) |
|
28 |
3-FC 6 H 4 , CH 2 C 6 H 4 NO 2 -4 |
141,0(2) |
2,118(3) |
2,096(3) |
2,986(1), 2,986(1) |
|
29 |
3-FC 6 H 4 , C 10 H 15 |
159,3(1) |
2,127(2) |
2,143(1) |
2,590(1), 2,590(1) |
|
30 |
3-FC 6 H 4 , CH=CHPh |
153,1(2) |
2,116(3) |
2,143(3) |
2,601(1), 2,601(1) |
|
31 |
3-FC 6 H 4 , C 2 B 10 H 10 CH 3 -2 |
131,8(3) |
2,107(5) |
2,113(3) |
3,159(1), 3,159(1) |
|
32 |
3-FC 6 H 4 , Ph |
156,6(1) |
2,122(2) |
2,136(1) |
2,745(1), 2,543(1) |
|
33 |
2-СH 3 O-5-BrC 6 H 3, C 6 F 5 |
124,6(2) |
2,105(3) |
2,103(2) |
3,212(3), 3,338(4) |
|
34 |
2-СH 3 O-5-BrC 6 H 3, C 6 H 3 F 2 -2,3 |
129,2(2) |
2,121(4) |
2,116(4) |
3,068(5), 3,056(5) |
|
35 |
2-СH 3 O-5-BrC 6 H 3, Ph |
127,6(1) |
2,107(4) |
2,089(3) |
3,025(4), 3,081(4) |
|
36 |
2-СH 3 O-5-ClC 6 H 3, C 6 H 3 F 2 -2,5 |
127,0(1) |
2,113(3) |
2,109(2) |
2,962(3), 3,120(2) |
|
37 |
2-СH 3 O-5-ClC 6 H 3, СF 2 Br |
128,4(1) |
2,113(3) |
2,123(2) |
3,136(3), 3,141(2) |
|
38 |
2-СH 3 O-5-ClC 6 H 3, CH 2 OC 6 H 3 Cl 2 -2,4 |
120,8(1) |
2,125(3) |
2,115(2) |
3,123(3), 3,171(3) |
|
39 |
2-СH 3 O-5-ClC 6 H 3, C 6 H 3 (NO 2 ) 2 -3,5 |
124,5(1) |
2,111(2) |
2,106(2) |
3,266(3), 3,076(2) |
|
40а |
2-СH 3 OC 6 H 4, C 6 H 3 F 2 -2,5 |
126,4(3) |
2,115(6) |
2,122(2) |
3,063(7), 3,116(7) |
|
40б |
2-СH 3 OC 6 H 4, C 6 H 3 F 2 -2,5 |
127,4(3) |
2,111(7) |
2,118(5) |
3,126(7), 3,120(6) |
Таблица 2
|
№ |
Ar, R |
о о 2 § еЛ п, и о ¥ |
1 s?a ср К |
§ ЕС ¥ |
Ср. знач. d (Sb–C), Å |
& U ЕР 43 |
о о ел ¥ |
р |
|
41 |
Ph, |
175,5(1), |
1 25, 7 (1), |
146,7(1) |
2,106(3), |
2,216(3), 2,241(3) (2,229(3)) |
1,957(3), |
3,280(4), |
|
CF 2 CF 3 |
176,8(1) |
1 26, 8 (1) |
2,115(3) |
1,971(3) |
3,279(5) |
|||
|
42а |
Ph, |
175,2(2), |
1 22, 0 (3), |
141,6(2) |
2,104(6), |
2,233(5), 2,212(5) (2,223(5)) |
1,960(4), |
3,330(2), |
|
CF 2 Br |
177,1(2) |
1 25, 5 (3) |
2,099(6) |
1,971(4) |
3,302(6) |
|||
|
42б |
Ph, CF 2 Br |
174,5(2) |
1 21, 8 (3) |
180,0 |
2,090(6) |
2,209(5) |
1,937(1) |
3,450(8) |
|
43 |
Ph, CF 2 CF 2 CF 3 |
176,1(1) |
1 22, 4 (1) |
180,0 |
2,098(3) |
2,219(3) |
1,937(6) |
3,507(4) |
|
44а |
p -Tol, |
179,0(3), |
1 24, 7 (6), |
139,9(3) |
2,114(12), |
2,184(8), 2,197(8) (2,191(8)) |
1,994(6), |
3,18(1), |
|
CH 2 Br |
178,1(3) |
1 24, 8 (4) |
2,105(5) |
1,971(6) |
3,35(1) |
|||
|
44б |
p -Tol, CH 2 Br |
175,7(4) |
1 24, 9 (9) |
180,0 |
2,086(16) |
2,248(13) |
1,956(1) |
3,36(2) |
|
45а |
p -Tol, |
177,7(1), |
1 23, 8 (2), |
139,9(1) |
2,117(4), |
2,193(3), 2,176(3) (2,185(3)) |
1,971(3), |
3,379(4), |
|
CH 2 Cl |
178,6(1) |
1 25, 8 (2) |
2,114(5) |
1,993(3) |
3,184(4) |
|||
|
45б |
p -Tol, CH 2 Cl |
174,9(1) |
1 24, 7 (2) |
180,0 |
2,090(6) |
2,200(5) |
1,959(1) |
3,467(8) |
|
46 |
3-FC 6 H 4 , |
176,8(1), |
1 29, 1 (2), |
145,2(2) |
2,118(5), |
2,200(4), 2,214(4) (2,207(4)) |
1,957(4), |
3,273(5), |
|
CF 2 CF 3 |
179,1(2) |
1 25, 6 (2) |
2,117(5) |
1,979(4) |
3,300(5) |
|||
|
47 |
3-FC 6 H 4 , C 6 F 5 |
174,9(1) |
1 20, 9 (3) |
180,0 |
2,105(7) |
2,174(4) |
1,950(1) |
3,420(7) |
Обсуждение результатов
В мол е к у ла х д и к арб о к силатов триарилсурьмы атомы сурьмы и м еют тригональн о-би п ирам и дальн у ю к оор ди н а ц и ю с а том а ми к ис ло род а карбоксилатных лигандов в аксиальных позициях (рис. 1) [14–31].
Су ммы э к в атор и а льн ых у глов CS bC в с тр у кт ура х 1 – 40 составляют 360º (в пределах погрешности э к с п е р и ме нта ) , од н а к о з н аче н ия индивидуальных углов часто сильно отличаю тс я д р у г от д р у г а , и ра зни ц а може т д ости га т ь не с кольк и х д е сятк о в гра дусов ( н ап риме р, сое д и н ен ия 19 , 29 , 30 и 32 ).
С ре дн ие значени я связе й S b –C изменяются в узком интервале (2,087(4) - 2,127(2) Å), минимальные значения (менее 2, 100 Å) наблюдаются в фенильных и 4-фторфенильных производных (см. табл. 1). Расстояния Sb– O (с р. зн а ч. 2,089( 3 ) - 2,155(3) Å) практически во всех дикарбоксила-тах триарилсурьмы неск ол ьк о б о льш е сре д н его зн а че н и я д ли н с в язе й S b –C. В связи с потенци альн ым б ид е н та тным ха р а к те ром карбоксилатных лигандов в структурах дик а рб о к с и л а тов три а- р ил с у рьмы и ме ю т ме с то в ну три молекулярные контакты между атомами Sb и O к а рб он и льных групп. Расстояния Sb···O(= С ) изменяются в пределах 2,543(1)–3,317(7) Å (сумма ван-дер- в аа льс ов ы х ра д и у с ов а то мов Sb и O 3, 58 Å).
Прочн ос ть в ну три моле к у ляр ных контактов, возникающих вследствие до н о рн о-акцепторных в за и мод е й стви й , за в и с и т от п ри род ы о рга н и чес к о го рад и ка ла в остатке кислоты –OC(O)R и за мес ти т еле й в ари льн ых г ру п п а х при атоме сурьмы. Так, чем больше электро отри цате льнос ть R, тем з ам етнее с ме ще н и е эле к трон ной плотности с карбоксильной группы и тем в ме н ьш е й с те п е н и п рояв ляю тс я дон орны е свой ст в а к а рбон и льн ог о а т ома кислорода. Например, в ряду соедине н и й c оди на к ов ыми а ри л ьн ыми груп п а ми 33 , 34 , 35 электроотрицательность R (C 6 F 5 , C 6 H 3 F 2 -2,3, Ph) уменьшается, и донорно- ак цепторные взаимодействия усиливаются, что п ри в од и т к у к ороч ению расстояний Sb···O(= С ) ( с р. зн а ч. 3,275(3) Å в 33 , 3,062(5) Å в 34 , 3,053(4) Å в 35 ). Наличие э л е к трон оак ц е п торных з а ме с ти т елей в арильной группе повышает акцепторн ые с п о с об н о с ти атом а ме талла , т е м с а м ы м п ри в одит к упрочнению внутримолекулярных вза и мод е й с тв и й и сокращению расстояний Sb··· O (=С). Та к , н а при м ер, в с ое д и н е н и ях 7 , 16 , 24 с одинаковыми карбок си ла тн ыми лига н да ми и ра зн ы ми арильными группами происходит укороче н и е рас стояний Sb···O(=С) (ср. знач. 3,067(3), 2,900(2) , 2 ,870(2) Å) при появлении атомов фтора в арильных кольцах. Наиболе е к орот к и е ра с с тоян и я Sb···O(=С) (менее 2,8 Å) имеют место в соединениях с до н орн ы м и гру п п а ми R в о с тат ка х карбоновых кислот и фторированными арил ьн ыми за ме с ти тел ями, например, в 29 2,590(1) Å, 30 2,601(1) Å.
Форм и ров а н и е в н у три моле к у лярн ых кон та к тов Sb ⋅⋅⋅O(=С) в дикарбоксилатах триарилсурь- мы м ож е т ос у щ ес тв лятьс я д в у м я способами: внутри одного экваториальн ого у гла C S bC и ли в н у три ра зн ых у глов , чт о оп ре д еляется значениями двугранных углов между п лос к ос тями д в у х ка рб о к с и л ьн ых гру п п . В с ое д и н е н и ях 1 – 4 , 7 – 10 , 12 , 13 , 16–32 двугранные углы между плоско стя ми к арб о к с и ль н ых г руп п ме н ь ш е 16 º, угол CSbC с наибольшим значением обнаруживается со стороны контактов Sb···O (=С ) и в а рьиру е т в п ре д ела х 127,4(2)º–159,3(1)º, увеличиваясь с возрас тан ием прочн ос ти к он так тов . Т ак , экваториальные углы 150,5(1)º, 153,1(2)º, 156,6(1)º, 159,3(1)º обнаружены в структурах 19 , 30 , 32 , 29 соответственно (рис. 2), при этом средние расстояния Sb⋅⋅⋅O(=С) составляют 2, 7 34(2) Å, 2,601(1) Å, 2,644(1) Å, 2,590(1) Å.
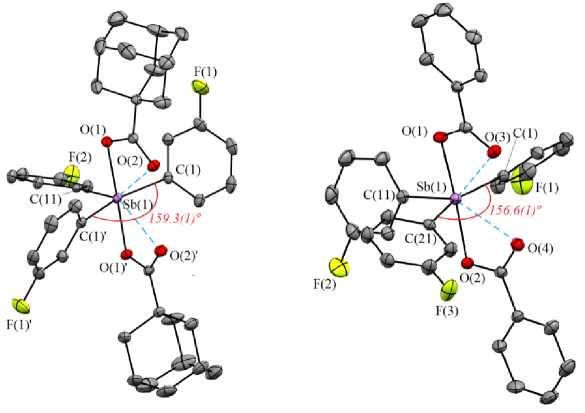
Рис. 2. Молекулярные структуры 29 (слева) и 32 (справа) (атомы водорода не приведены)
В молекулах соединений 5 ( а и б ), 6 ( а и б ), 11 , 14 , 15 , 33 – 40 ( а и б ) двугранный угол между плоскостями карбоксильных групп составляет 45º - 66º, вследствие чего взаимодействия Sb···O(=С) осуществляются внутри разных углов CSbC; в этих молекулах экваториальные углы изменяются в интервале 108,0(2)–129,2(2)º. В молекулах соединений 33 – 40 необычное расположение карбоксильных групп можно объяснить стерическим фактором, обусловленным большим объемом арильных групп с координационными центрами в заместителях (Ar = 2-СH 3 O-5-ClC 6 H 3 , 2-СH 3 O-5-ВrC 6 H 3 , 2-СH 3 OC 6 H 4 ), обеспечивающими возникновение внутримолекулярных контактов атома металла с атомами кислорода метоксигрупп (расстояния Sb···OCH3 3,045(5) - 3,197(3) Å). В 5 , 6 , 11 , 14 , 15 фактор, определяющий расположение карбоксилатных лигандов, не очевиден.
На основании полученных рентгеноструктурных данных впервые для дикарбоксилатов триа-рилсурьмы была проведена количественная оценка степени заполнения координационной сферы атома металла в модели телесных углов лигандов. Целью такого исследования было выявление взаимосвязи степени заполнения координационного пространства центрального атома с наличием внутримолекулярных взаимодействий, приводящих к искажению геометрических характеристик молекул.
Параметр G (%) характеризует процент заполнения координационной сферы атома металла всеми лигандами с учетом областей перекрывания (G γ , %) телесных углов двух и более лигандов (G = (ΣΩ i /4π) · 100 %). Параметр G 2,28 оценивает степень заполнения координационного пространства лигандом (%) на расстоянии в 2,28 Å от атома металла, что позволяет сравнить между собой вклад разных лигандов в заполняемость координационной сферы центрального атома.
Анализ степени заполнения координационного пространства около атома металла в дикар-боксилатах триарилсурьмы показал, что интервал изменения G-параметра составляет 84,60 - 94,90 % (табл. 3). Однако, относительно низкий процент заполнения координационной сферы (85,14, 84,79, 84,60 %) наблюдается только для трех структур ( 11 , 21 , 22 ). Наиболее характерны значения G-параметра от 86 до 88,5 %. Максимально насыщенные координационные сферы центрального атома (более 90 %) обнаружены для арильных производных 33–40 , содержащих метоксигруппы, которые координируют на атом металла. Кроме того, высокие значения G-параметра имеют структуры 17 (89,80 %), 19 (89,41 %), 20 (89,58 %), 29 (91,34 %), 30 (91,17 %), 32 (90,43 %), в которых насыщение координационной сферы обусловлено сильными невалентными взаимодействиями Sb⋅⋅⋅O(=С) (2,543(1) - 2,856(6) Å).
Таблица 3
Значения параметров G и G 2.28 для молекул дикарбоксилатов триарилсурьмы Ar 3 Sb[OC(O)R] 2
|
№ |
Ar, R |
G, % |
G 2.28 (Ar), % |
G 2.28 (OC(O)R), % |
|
1 |
Ph, C 6 HF 4 -2,3,4,5 |
86,97 |
15,46; 15,45; 15,41 |
16,00; 15,37 |
|
2 |
Ph; C 6 H 2 F 3 -3;4,5 |
86,87 |
15,44; 15,20; 15,45 |
15,69; 15,69 |
|
3 |
Ph, C 6 H 3 F 2 -2,3 |
87,21 |
15,46; 15,48; 15,29 |
16,09; 15,58 |
|
4 |
Ph, C 6 H 3 F 2 -3,4 |
87,26 |
15,41; 15,42; 15,26 |
15,72; 15,72 |
|
5а |
Ph, CF 2 CF 3 |
86,75 |
15,33; 15,48; 15,39 |
15,09; 15,29 |
|
5б |
Ph, CF 2 CF 3 |
86,33 |
15,36; 15,39; 15,40 |
14,95; 14,84 |
|
6а |
Ph, CF 2 CF 2 CF 3 |
86,12 |
15,42; 15,50; 15,39 |
14,93; 15,23 |
|
6б |
Ph, CF 2 CF 2 CF 3 |
86,40 |
15,32; 15,41; 15,44 |
14,94; 15,46 |
|
7 |
p -Tol, CH 2 Cl |
86,07 |
15,40; 15,23; 15,38 |
15,64; 15,50 |
|
8 |
p -Tol, CH 2 Br |
86,02 |
15,37; 15,22; 15,38 |
15,57; 15,44 |
|
9 |
p -Tol, С 6 Н 4 NO 2 -3 |
86,82 |
15,38; 15,42; 15,28 |
15,04; 15,33 |
|
10 |
p -Tol, C 6 H 3 (NO 2 ) 2 -3,5 |
86,77 |
15,39; 15,24; 15,38 |
15,41; 15,49 |
|
11 |
4-FC 6 H 4 , C 6 F 5 |
85,14 |
15,40; 15,31; 15,43 |
15,20; 14,81 |
|
12 |
4-FC 6 H 4 , C 6 HF 4 -2,3,4,5 |
87,05 |
15,45; 15,30; 15,42 |
16,50; 15,55 |
|
13 |
4-FC 6 H 4 , C 6 H 3 F 2 -2,5 |
87,42 |
15,39; 15,27; 15,43 |
16,75; 15,98 |
|
14 |
4-FC 6 H 4 , CF 2 CF 3 |
87,37 |
15,45; 15,44; 15,39 |
16,56; 15,90 |
|
15 |
4-FC 6 H 4 , CF 2 CF 2 CF 3 |
87,14 |
15,40; 15,41; 15,45 |
16,30; 16,65 |
|
16 |
4-FC 6 H 4 , CH 2 Cl |
88,75 |
15,40; 15,32; 15,40 |
16,69; 16,16 |
|
17 |
4-FC 6 H 4 , C 6 H 4 -NHPh-2 |
89,80 |
15,34; 15,38; 15,42 |
17,15; 16,65 |
Окончание табл. 3
|
№ |
Ar, R |
G, % |
G 2.28 (Ar), % |
G 2.28 (OC(O)R), % |
|
18 |
4-FC 6 H 4 , C≡CPh |
88,21 |
15,39; 15,37; 15,45 |
16,37; 16,11 |
|
19 |
4-FC6H4, C3H5- цикло |
89,41 |
15,28; 15,41; 15,40 |
17,58; 17,06 |
|
20 |
4-FC 6 H 4 , C 10 H 15 |
89,58 |
15,31; 15,34; 15,38 |
17,35; 16,93 |
|
21 |
4-FC 6 H 4 , C 2 B 10 H 11 |
84,79 |
15,45; 15,33; 15,49 |
14,99; 15,05 |
|
22 |
4-FC 6 H 4 , C 2 B 10 H 10 CH 3 -2 |
84,60 |
15,41; 15,42; 15,39 |
14,96; 15,30 |
|
23 |
3-FC 6 H 4 , C 6 HF 4 -2,3,4,5 |
88,49 |
15,34; 15,42; 15,52 |
16,31; 16,77 |
|
24 |
3-FC 6 H 4 , CH 2 Cl |
88,40 |
15,33; 15,40; 15,41 |
16,89; 16,23 |
|
25 |
3-FC 6 H 4 , CH 2 Br |
88,92 |
15,30; 15,43; 15,40 |
16,81; 16,13 |
|
26 |
3-FC 6 H 4 , C 6 H 4 NO 2 -2 |
89,41 |
15,56; 15,33; 15,54 |
17,02; 16,67 |
|
27 |
3-FC 6 H 4 , C 6 H 3 (NO 2 ) 2 -3,5 |
88,01 |
15,46; 15,28; 15,44 |
15,99; 16,44 |
|
28 |
3-FC 6 H 4 , CH 2 C 6 H 4 NO 2 -4 |
87,54 |
15,44; 15,33; 15,44 |
17,48; 17,48 |
|
29 |
3-FC 6 H 4 , C 10 H 15 |
91,34 |
15,39; 15,25; 15,39 |
18,40; 18,39 |
|
30 |
3-FC 6 H 4 , CH=CHPh |
91,17 |
15,36; 15,63; 15,36 |
18,16; 18,17 |
|
31 |
3-FC 6 H 4 , C 2 B 10 H 10 CH 3 -2 |
87,26 |
15,47; 15,42; 15,46 |
16,66; 16,66 |
|
32 |
3-FC 6 H 4 , Ph |
90,43 |
15,45; 15,28; 15,40 |
17,12; 18,67 |
|
33 |
2-СH 3 O-5-BrC 6 H 3, C 6 F 5 |
91,15 |
17,90; 17,74; 17,88 |
14,96; 14,76 |
|
34 |
2-СH 3 O-5-BrC 6 H 3, C 6 H 3 F 2 -2,3 |
93,13 |
17,80; 17,78; 18,09 |
15,54; 15,67 |
|
35 |
2-СH 3 O-5-BrC 6 H 3, Ph |
94,90 |
17,73; 18,60; 17,90 |
15,38; 15,58 |
|
36 |
2-СH 3 O-5-ClC 6 H 3, C 6 H 3 F 2 -2,5 |
93,96 |
17,65; 17,86; 18,04 |
15,96; 15,34 |
|
37 |
2-СH 3 O-5-ClC 6 H 3, СF 2 Br |
92,25 |
17,99; 17,75; 17,89 |
15,50; 15,70 |
|
38 |
2-СH 3 O-5-ClC 6 H 3, CH 2 OC 6 H 3 Cl 2 -2,4 |
92,22 |
17,66; 18,05; 17,79 |
16,13; 16,09 |
|
39 |
2-СH 3 O-5-ClC 6 H 3, C 6 H 3 (NO 2 ) 2 -3,5 |
92,44 |
17,99; 17,73; 17,59 |
15,54; 14,66 |
|
40а |
2-СH 3 OC 6 H 4, C 6 H 3 F 2 -2,5 |
92,58 |
17,88; 18,20; 17,69 |
15,51; 15,30 |
|
40б |
2-СH 3 OC 6 H 4, C 6 H 3 F 2 -2,5 |
93,66 |
17,68; 18,10; 18,09 |
15,29; 15,25 |
Можно констатировать, что определяющим фактором для увеличения степени заполнения координационного пространства центрального атома является наличие внутримолекулярных взаимодействий с окружающими лигандами, а не их размеры. Так, минимальные значения G обнаружены в структурах 21 и 22 - производных карборанилкарбоновых кислот, в которых внутримолекулярные расстояния Sb⋅⋅⋅O(=С) соизмеримы с суммой ван-дер-ваальсовых радиусов.
Ранее отмечалось, что в молекулах 5 , 6 , 11 , 14 , 15 наблюдается нетипичное для дикарбоксилатов триарилсурьмы расположение карбоксилатных лигандов относительно друг друга. Выявлено, что именно в этих структурах процент координационной сферы, заполняемый областями неблагоприятных взаимодействий лигандов, отсутствует или не превышает 1 %.
Методом РСА также охарактеризовано строение карбоксилатов триарилсурьмы 41 – 47 с мостиковым атомом кислорода (рис. 3) [32].
В соединениях 41 – 47 аксиальные углы OSbO близки к 180º. Значения индивидуальных углов CSbC отличаются от теоретического на 1º–10º. Небольшое искажение координационного полиэдра атома сурьмы проявляется в выходе атома металла из экваториальной плоскости [C 3 ] в сторону мостикового атома кислорода на 0,081–0,210 Å. Средние значения длин связей Sb–С (2,086(16)–2,118(5) Å) сопоставимы с аналогичными в дикарбоксилатах триарилсурьмы. Связи Sb–O терм (2,174(4)–2,248(13) Å) длиннее, чем связи Sb–О мост (1,937(1)–1,994(6) Å). Средние значения расстояний Sb–O терм при этом превышают средние длины связей Sb–O в дикарбоксилатах триарилсурьмы с аналогичными арильными и карбоксилатными лигандами на 0,041–0,117 Å. Основное различие в геометрии молекул соединений [Ar3SbOС(О)R]2O заключается в строении фрагмента Sb–O–Sb. В большинстве случаев фрагменты имеют угловую форму и лишь иногда линейную. В молекулах соединений 41 – 47 углы SbOSb имеют значения 139,9(3)º - 146,7(1)º или 180º. Впервые были выделены кристаллы, в ячейках которых одновременно присутствуют молекулы с угловым ( 42а , 44а , 45а ) и линейным ( 42б , 44б , 45б ) центральными фрагментами. Каких-либо закономерных изменений геометрических характеристик изомерных молекул не выявлено. Для молекул 41 – 47 справедливо: чем ближе значение угла SbОSb к 180º, тем меньше длина связи Sb–O мост .
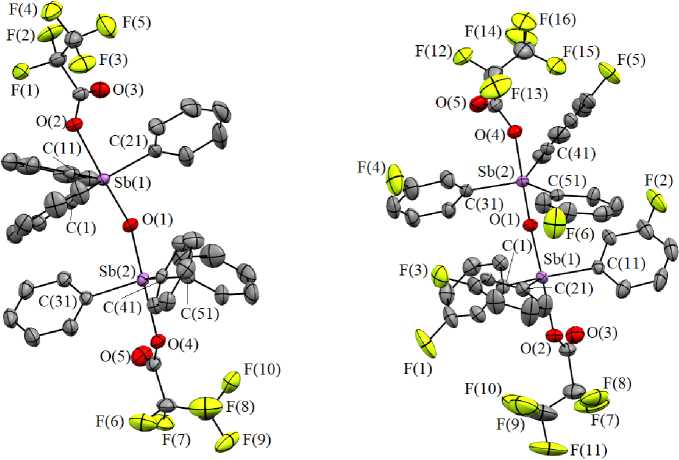
Рис. 3. Молекулярное строение μ 2 -оксо- бис [(карбоксилато)триарилсурьмы] на примере соединений 93 (слева) и 98 (справа) (атомы водорода не приведены)
В сое д и н е н и ях а н ги д ридн ого с трое н и я с к а р б окс ила тн ыми ли га нд а ми G-параметр варьирует в пределах 86,95–91,05 % (та бл. 4 ) , что н а 2–4 % больше, чем в дикарбоксилатах триарилсурьмы с а н а ло ги чн ыми к а рбок си ла тн ыми лига н д а ми, например, в 7 G 86,07 %, в 45а G 91,05; 88,57 %, в 45б G 88,20 %.
Таблица 4
Значения параметров G и G 2.28 для молекул μ 2 -оксо-бис[(карбоксилато)триарилсурьмы] [Ar 3 SbOС(O)R] 2 O
|
№ |
Ar, R |
G(Sb1), G(Sb 2 ), % |
G2.28(ArSb1), % |
G2.28(ArSb2), % |
x0 0х Pi о и о оо ф |
чо 0х Pi о о о оо ф |
|
41 |
Ph, CF 2 CF 3 |
90, 78; 88 ,05 |
15,28; 15,52; 15,45 |
15,40; 15,42; 15,33 |
15,33 |
15,12 |
|
42а |
Ph, CF 2 Br |
86, 95; 90,43 |
15,40; 15,36; 15,41 |
15,28; 15,34; 15,48 |
12,29 |
14,91 |
|
42б |
Ph, CF 2 Br |
8 9, 14; 89,14 |
15,45; 15,33; 15,38 |
15,45; 15,33; 15,38 |
14,14 |
14,14 |
|
43 |
Ph, CF 2 CF 2 CF 3 |
8 8, 79; 88,79 |
15,39; 15,45; 15,43 |
15,39; 15,45; 15,43 |
14,04 |
14,04 |
|
44а |
p -Tol, CH 2 Br |
90, 93; 88 ,65 |
15,24; 15,37; 15,20 |
15,31; 15,31; 15,18 |
15,27 |
14,46 |
|
44б |
p -Tol, CH 2 Br |
88, 32; 88 ,32 |
15,14; 15,22; 14,98 |
15,14; 15,22; 14,98 |
13,72 |
13,72 |
|
45а |
p -Tol, CH 2 Cl |
91, 05; 88 ,57 |
15,32; 15,29; 15,27 |
15,36; 15,33; 15,36 |
15,25 |
14,39 |
|
45б |
p -Tol, CH 2 Cl |
88, 20; 88 ,20 |
15,29; 15,28; 15,30 |
15,29; 15,28; 15,30 |
13,83 |
13,83 |
|
46 |
3-FC 6 H 4 , CF 2 CF 3 |
89, 53; 89 ,90 |
15,47; 15,40; 15,39 |
15,35; 15,37; 15,41 |
15,10 |
14,94 |
|
47 |
3-FC 6 H 4 , C 6 F 5 |
88, 77; 88 ,77 |
15,45; 15,33; 15,29 |
15,45; 15,33; 15,29 |
14,26 |
14,26 |
Проц е н т за п ол н е н ия к оординационной сферы в молекулах с линейным с тро е н и е м фрагме н та Sb–O–Sb в среднем н ем н ого ме н ьше (с р. значе н и е 88 ,64 %), чем с угловым (ср. значение 89,48 % ) . О д н а к о н е о б хо д и мо отметить, что в молекулах с угловым фрагме н том G-параметры дв ух а томов с урь м ы отли ча ю тся друг от друга на несколько процентов. Так , н а п ри ме р, ра зн и ц а в п роц е н та х з апол н е н и я к о орд и н а ц и он н ой с ф е ры ат ом ов с у рьмы в 42а составляет ~3,5 %. Низкие значения G-пара ме тров в с тру к турах 42б , 43 , 44б , 45б и 47 , имеющих линейный фрагмент Sb–O– Sb, я в ляютс я с л е д с тв и е м б оле е д ли н н ых ра сс тоян и й Sb···O(=С).
Заключение
Впервые проведена количественная оценка заполнения координационной сферы атома сурьмы лигандами (стерический фактор). G-параметр (%) для соединений общей формулы Ar 3 Sb[OС(O)R] 2 варьирует в пределах 80,19 - 94,90 %. Насыщение координационного пространства центрального атома (G ≥ 88 %) обусловлено внутримолекулярными невалентными взаимодействиями Sb···OCH 3 и Sb⋅⋅⋅O(=С). Стерическая перегруженность приводит к искажению геометрических характеристик молекул. Заполняемость координационной сферы металла в соединениях [Ar3SbOС(O)R]2О с мостиковым атомом кислорода на 2–4 % больше, чем в производных Ar3Sb[OС(O)R]2 с аналогичными лигандами –OС(O)R. Параметр G для молекул с линейным строением центрального фрагмента Sb–O–Sb меньше, чем с угловым.

![Оценка степени заполнения координационной сферы атома металла в Дикарбоксилатах триарилсурьмы и 2-оксо-бис[(карбоксилато)триарилсурьме] Оценка степени заполнения координационной сферы атома металла в Дикарбоксилатах триарилсурьмы и 2-оксо-бис[(карбоксилато)триарилсурьме]](/file/cover/147248073/ocenka-stepeni-zapolnenija-koordinacionnoj-sfery-atoma-metalla-v-dikarboksilatah.png)
