Оценка токсичности бактериальной нуклеазы, проведенная в остром эксперименте
Автор: Филимонова М.Н., Равилов Р.Х., Маланьева А.Г.
Статья в выпуске: 1 т.257, 2024 года.
Бесплатный доступ
Цель исследования заключалась в выявлении токсических эффектов бактериальной нуклеазы в остром эксперименте, но без достижения летальности. Для этого нуклеазу использовали в количестве близком к дозе, соответствующей дозе для проявления ее биологических эффектов. Установлено, что бактериальная нуклеаза, введенная внутривенно мышам в дозе 0,5 мг/кг веса животного, не вызывала острых побочных эффектов на внешний вид и поведение мышей, что свидетельствовало об отсутствии токсичности нуклеазы in vivo в выбранной дозе.
Нуклеаза serratia marcescens, бактериальная нуклеаза, внутривенное введение, токсичность, острый эксперимент
Короткий адрес: https://sciup.org/142240699
IDR: 142240699 | УДК: 574/577 | DOI: 10.31588/2413_4201_1883_1_257_261
Текст научной статьи Оценка токсичности бактериальной нуклеазы, проведенная в остром эксперименте
Бактериальная нуклеаза – это фермент, который синтезируют и секретируют в окружающую среду грамотрицательные бактерии Serratia marcescens. При физиологических условиях нуклеаза успешно расщепляет ДНК или РНК на нуклеотиды [3]. В настоящее время бактериальная нуклеаза – это хорошо изученный фермент, у которого известны ключевые физикохимические и биохимические свойства, структура и механизм действия [7, 10]. Данные о нуклеазе представлены в таких известных банках данных как SCOP, RCSB, Brenda. Разработаны методы выделения и очистки фермента [12]. Известны биологические эффекты (Таблица 1). Так, показан ее противоопухолевый эффект. При внутрибрюшинном введении нуклеазы в дозе 0,25 мг/кг живой массы мышей происходило торможение развития внутрибрюшинной карциномы Эрлиха более чем на 50 % [1]. Нуклеаза очень активна при деградации ДНК в мокроте [13], приближаясь по эффективности к медицинскому препарату Пульмозим, применяемому при лечении болезней дыхательной системы. Установлен антирабический эффект композиции материалов, ключевым компонентом которой является бактериальная нуклеаза [8]. Под названием Эндовираза (Эндоглюкин) препарат на основе бактериальной нуклеазы применяют в сельском хозяйстве для лечения и профилактики вирусных заболеваний пчел [6]. Показана эффективность Эндовиразы в борьбе с вирусными респираторными инфекциями крупного рогатого скота и птицы [2, 4]. Однако в печати нет сведений, позволяющих охарактеризовать этот фермент токсикометрически. Сведения о невысокой цитотоксичности бактериальной нуклеазы, полученные с использованием ряда культур клеток (Таблица 2), являются недостаточными для токсикометрической характеристики данного вещества. Известно, что начальным этапом для токсикометрической характеристики вещества обычно служит оценка его острой токсичности в опытах in vivo. Учитывая реальное применение бактериальной нуклеазы на практике и его дальнейшие перспективы, цель настоящего исследования заключалась в выявлении токсических эффектов бактериальной нуклеазы в остром эксперименте, но без достижения летальности. В связи с этим нуклеазу использовали в количестве близком к дозе, соответствующей дозе для проявления ее биологических эффектов (Таблица 1).
Материал и методы исследований. Объектом исследования служила гомогенная бактериальная нуклеаза, которую получали выделением из культуральной жидкости S.marcescens и характеризовали чистоту препарата, как описано [11]. Очищенную нуклеазу затем диализовали против дистиллированной воды и лиофилизировали. После этого 1 мг сухой нуклеазы растворяли в 0,2 мл физиологического раствора и центрифугировали при 4 °С для удаления не растворившейся фракции. Концентрацию раствора нуклеазы рассчитывали исходя из поглощения надосадочной жидкости при 280 нм и молярного коэффициента экстинкции 47 292 М-1/см2 [12].
Таблица 1 – Биологические эффекты нуклеазы
|
w Я И я О о я Ч £ о О с S |
н и о Г) |
н О К я S s н н о -©и И Г) |
я 3 о я |
W S я н Я |
о я ч к |
|
Беспородные белые мыши; самцы, вес 2023 г |
Подавление роста раковой опухоли |
Торможение роста внутрибрюшинной карциномы Эрлиха более чем на 50% |
Высокой степени очистки |
0,25мг /кг веса животного |
[1] |
|
Беспородные белые мыши; самцы, вес 10 г |
Антирабич еская активность |
Увеличение выживаемости инфицированных вирусом бешенства мышей более чем на 30 % |
Гомогенная |
1,0 мг/кг веса живот ного |
[8] |
|
Гнойнослизистая мокрота (In vitro) |
Расщепление ДНК в мокроте |
Разжижение мокроты не хуже, чем с Пульмозимом в стандартных для Пульмозима условиях |
Гомогенная |
0,02-34 мкг/мл мокроты |
[12] |
Таблица 2 – Условия определения цитотоксичности бактериальной нуклеазы in vitro
|
Метод определения |
Тип культуры клеток |
Исследование |
|
MTT -тест |
Человеческие фибробласты кожи (HSF) |
[9] |
|
MTS-тест |
Почка эмбрионов человека (HEK293) |
[8] |
|
MTT -тест |
Колоректальный рак человека (HCT-116) |
[9] |
|
MTT -тест |
Рак молочной железы человека (MCF 7) |
[9] |
|
MTS-тест |
Гепатома крысы (H4-II-E-C3) |
[13] |
Ферментативную активность определяли методом, основанным на оценке количества кислоторастворимых низкомолекулярных нуклеотидных фрагментов, образуемых при деградации субстрата (ДНК или РНК) под действием нуклеазы [3].
Испытание токсичности проводили в соответствии с методическими указаниями [5] на половозрелых самцах белых мышей с массой тела 20-21 г, сформированных в 4 группы: контрольную и три опытные (n=5). Основными критериями включения животных в эксперимент было отсутствие клинических признаков заболеваний. После формирования групп грызуны были подвергнуты двухнедельному карантину для последующей оценки их адаптации и физиологического состояния. Содержание животных осуществляли в типовых пластиковых клетках с температурным режимом +18-22 °С в условиях естественного светового цикла на стандартной диете, без ограничений к потреблению пищи и воды.
Дизайн эксперимента был разработан в соответствии с действующими правилами Европейской Конвенции (2010/63/EU) по уходу и защите животных, используемых для исследовательских и иных научных целей, и одобрен Комитетом по этике Казанского федерального университета (Российская Федерация, г. Казань, № 459.06.04.2020).
Объект исследования вводили мышам в хвостовую вену по 0,05 мл/мышь, руководствуясь тем, что кровь, циркулируя по организму, омывает все органы и ткани. Мышам контрольной группы вводили физиологический раствор (физраствор), а опытных групп – по 10,5 мкг нуклеазы в физрастворе/мышь, то есть в дозе 0,5 мг/кг веса животного. Для дальнейшего анализа животных умерщвляли эвтаназией в атмосфере углекислого газа сразу после введения нуклеазы – 1-я опытная группа, через 2 ч после введения – 2-я опытная группа и через 2 недели после введения – 3-я опытная группа – и подвергали вскрытию для исследования органов. Параллельно получали сыворотку крови для анализа динамики изменения содержания нуклеазы в крови, для чего оценивали изменение ДНКазной и РНКазной активностей сыворотки крови, отобранной из сердца животного сразу после начала эвтаназии, но до остановки сердца. Сыворотку выделяли в соответствии с общепринятым методом. Для образования сгустка кровь инкубировали 60 мин. при 25 oC. Затем сгусток удаляли и клетки крови отделяли 10-мин. центрифугированием при 1300 g. Полученные сыворотки хранили при температуре – 20 °С.
Острую токсичность оценивали по таким показателям как клиническое состояние, поведенческая активность, возможная количественная гибель мышей и сроки ее наступления. Контроль за животными и наблюдение для выявления признаков токсикоза продолжали в течение 14 суток от момента введения нуклеазы. В первые сутки учет физиологического состояния проводился каждый час; следующие трое суток – каждые 8 часов; в оставшиеся дни оценка состояния мышей осуществлялась каждые 24 часа.
Данные, полученные в результате исследования, обработаны биометрически с использованием пакета стандартных программ Microsoft Excel.
Результат исследований. В эксперименте была использована гомогенная бактериальная нуклеаза, выделенная, как описано ранее, и охарактеризованная с помощью SDS-PAGE и полносканирующей масс-спектрометрии MALDI-TOF [13]. Ферментативная активность растворенной фракции составляла 389333,3 Ед/мл в час с РНК в качестве субстрата и 294666,6 Ед/мл в час с ДНК. Концентрация нуклеазы перед инъекцией составляла 0,21 мг/мл.
Оценка активности ДНКазы и РНКазы в образцах сыворотки до и после введения нуклеазы мышам показала, что и ДНКазная и РНКазная активности были определены в сыворотке на всех этапах исследования (Рисунок 1). Однако, до введения мышам нуклеазы (контрольная группа) ДНКазная и РНКазная активности соответствовали 30 и 190 Ед/мл в час. Сразу после внутривенного введения нуклеазы (1-я опытная группа) обе активности в сыворотке резко возрастали: соответственно в 350 и в 130 раз. А через два часа после введения нуклеазы (2-я опытная группа) обе активности в сыворотке снижались примерно в 25 и 30 раз, но оставались в 5-10 раз выше, чем в контроле. По истечению 14 суток (3-я опытная группа) показатели РНКазной и ДНКазной активностей сыворотки соответствовали контролю (результаты не показаны).
Таким образом, в сыворотке контрольных мышей по сравнению с вводимым ферментом обе активности были невелики. Сразу после внутривенного введения нуклеазы обе активности в сыворотке резко увеличивались, вероятно, за счет распределения по крови бактериальной нуклеазы. И через два часа после введения нуклеазы (2-я опытная группа) обе активности в сыворотке существенно снижались, но оставались выше, чем в контроле. Повышенные по сравнению с контролем ДНКазная и РНКазная активности сыворотки предполагали наличие в крови остаточных количеств бактериальной нуклеазы. При этом многократное снижение этих активностей спустя 2 ч после введения бактериальной нуклеазы могло быть связано или с протеолизом нуклеазы за счет собственных протеаз сыворотки или с перераспределением бактериальной нуклеазы между кровью и другими тканями мышей, что требует дальнейшего исследования.
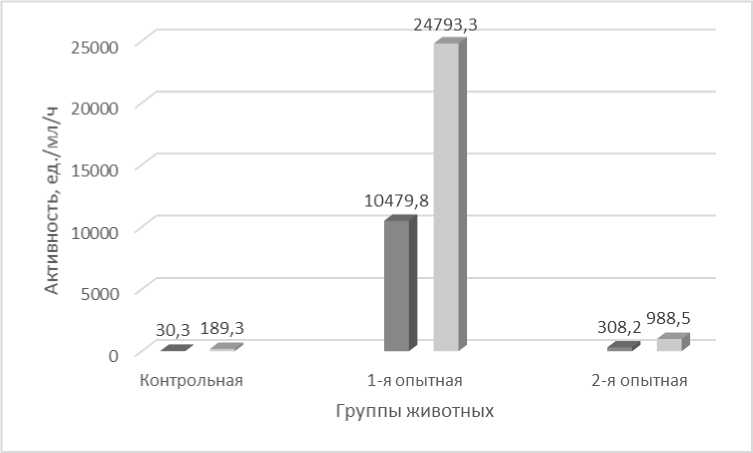
Рисунок 1 – ДНКазная (темные столбики) и РНКазная (светлые столбики) активности в сыворотке крови до введения нуклеазы (контроль), сразу после введения (1-я опытная) и через 2 ч (2-я опытная) после введения нуклеазы в хвостовую вену мышей
При оценке состояния животных по результатам проведенных исследований признаков интоксикации и случаев гибели мышей при однократном введении бактериальной нуклеазы в разовой дозе 0,5 мг/кг веса животного выявлено не было ни сразу, ни через 2 ч, ни через 14 суток после введения. На протяжении всего срока наблюдений общее состояние животных опытных и контрольной групп не различалось, не наблюдалось никаких грубых патологий. Поведенческие реакции не отклонялись от нормы. Реакции на тактильные, болевые, звуковые и световые раздражители были без патологических изменений. Ни у одной мыши не наблюдалось значительных поведенческих изменений, таких как изменение двигательной функции, уровня возбуждения, вегетативных функций и психологического статуса, которые могли бы указывать на эффект нейротоксичности. Отсутствовало влияние введения нуклеазы на аппетит: потребление еды и воды оставалось нормальным, истощение не выявлялось, что свидетельствовало об отсутствии нарушения углеводного, белкового или жирового обменов.
Вскрытие животных как опытных, так и контрольной групп показало, что грудная и брюшная полости не содержали выпота; положение внутренних органов грудной и брюшной полостей анатомически правильное, париетальный и висцеральный листки плевры и брюшины тонкие, блестящие, гладкие. Никаких гистологических изменений в печени, почках, селезенке, сердце, легких мышей, подвергшихся инъекции нуклеазы, не наблюдалось. Состояние волосяного и кожного покровов, окраска слизистых были без патологических изменений: отека, гиперемии, язв, сыпи. Шерсть была блестящей, без очагов аллопеции, зубы сохранены, видимые слизистые оболочки бледно-розовые, блестящие, деформации или отека конечностей не выявлено. Таким образом, оценка токсичности бактериальной нуклеазы, проведенная в остром эксперименте, позволяет заключить, что данный фермент в дозе 0,5 мг/кг веса животного не проявляет органотоксичности.
Заключение. Данные токсикометрии при внутривенном введении бактериальной нуклеазы, а также наблюдение за лабораторными мышами на протяжении 14 суток в постинтоксикационном периоде позволяют заключить, что бактериальная нуклеаза, введенная внутривенно мышам в дозе 0,5 мг/кг веса животного не вызывала острых побочных эффектов на внешний вид и поведение мышей, что свидетельствовало об отсутствии токсичности нуклеазы in vivo в выбранной дозе.
Работа выполнена за счет средств Программы стратегического академического лидерства Казанского (Приволжского) федерального университета (ПРИОРИТЕТ-2030).
Список литературы Оценка токсичности бактериальной нуклеазы, проведенная в остром эксперименте
- Габдуллина, Г. К. Действие нуклеазы Serratia marcescens на клетки и рост асцитной опухоли Эрлиха / Г. К. Габдуллина // Автореферат диссертации на соискание ученой степени кандидата биологических наук. – Казань: Типография издательства Тат. ОК КПСС, 1980. – С.14.
- Живодеров, С. Противостоять вирусам поможет «Эндовираза» / С. Живодеров, А. Рябова // Животноводство России. – 2015. – №10. – С. 3-4.
- Лещинская, И. Выделение и характеристика высокоочищенного препарата нуклеазы Serratia marcescens / И. Лещинская, Н. Балабан, Г. Егорова, В. Таняшин [и др.] // Биохимия. – 1974. – №11. – С. 95-100.
- Порываева, А. Лечебная и профилактическая Эндовираза / А. П. Порываева, Е. В. Печура // Животноводство России. – 2020. – № 2. – С. 26-30.
- Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. Методические рекомендации по изучению общетоксического действия лекарственных средств / Под. ред. А. Н. Миронова // Изучение острой токсичности. Изучение хронической токсичности. – М.: Гриф и К; 2012. – С. 15-19
- Селедцова, Г. В. Изучение действия эндонуклеазы бактериальной на вирус мешотчатого расплода (SBV), поддерживаемого на клеточной линии Vero / Г. В. Селедцова, Э. А. Кащенко, Л. В. Келин, А. А. Рябова // Пчеловодство. – 2016. – № 7. – С. 1-12.
- Friedhoff, P. Analysis of the mechanism of the Serratia nuclease using site-directed mutagenesis / P. Friedhoff, B. Kolmes, O. Gimadutdinow, W. Wende [et al.] // Nucleic Acids Research. – 1996. – № 14. – P. 2632-2639.
- Khismatullina, N. Nuclease Composition with Anti-Rabies Activity / N. Khismatullina, A. Ivanov, E. Martynova, A. Mironov [et al.] //Journal of pure and applied microbiology. – 2014. № 2. – P. 499-504.
- Malanyeva, A. G. The Nuclease from Gram-Negative Bacteria Serratia marcescens is Weakly Cytotoxic at Therapeutic Doses / A. G. Malanyeva, T. Salikhova, A. A. Rizvanov, M. N. Filimonova // Open Access Journal of Veterinary Science & Research. – 2020. – № 2. – P. 1-8.
- Miller, M. A structure of Serratia endonuclease suggests a mechanism for binding to double-stranded DNA / M. Miller, J. Tanner, M. Alpaugh, M. Benedik [et al.] // J. Nature Struct. Biol. – 1994. – № 1. – P. 461-468.
- Ravilov, R. K. Studying of toxicological properties of the "NB" connection possessing antiparasitic action / R. K. Ravilov [et all.] // Research Journal of Pharmaceutical, Biological and Chemical Sciences. – 2018. – Т. 9. – № 6. – P. 1502-1506.
- Vafina, G. A one-step protocol for chromatographic purification of nonrecombinant exogenous bacterial enzyme: nuclease of Serratia marcescens / G. Vafina, E. Bulatov, E. Zainutdinova, M. Filimonova // BioNanoSci. – 2016. – DOI 10.1007/s12668-016-0226-9.
- Vafina, G. Endonuclease from Gram-Negative Bacteria Serratia marcescens Is as Effective as Pulmozyme in the Hydrolysis of DNA in Sputum / G. Vafina, E. Zainutdinova, E. Bulatov, M. Filimonova // Frontiers in Pharmacology. – 2018. – № 9. – P. 1-8.
- Zainutdinova, E. Сombined Effect of Diluted Betadine and Serratia marcescens Nuclease on Viability of Rat Hepatoma Cells / E. Zainutdinova, E. Naumenko, E. Martinova, M. Filimonova // Research Journal of Pharmaceutical, Biological and Chemical Sciences. – 2015. – № 6. – P. 1637-1647.


