Оценка влияния тяжести травмы спинного мозга на механические свойства костей задних конечностей опытных крыс
Автор: Ахметзянова А.И., Шарафутдинова К.Р., Сабирова Д.Э., Балтин М.Э., Герасимов О.В., Балтина Т.В., Саченков О.А.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 4 (98) т.26, 2022 года.
Бесплатный доступ
Травмы спинного мозга часто сопровождаются остеопорозом, что осложняет реабилитацию. При этом влияние тяжести травмы на изменение прочностных свойств костной ткани малоизучено. Поэтому цель настоящего исследования - оценка изменения механических свойств костей в диафизарном участке после травмы спинного мозга разной степени тяжести (контузионная и полная травма спинного мозга). Исследование проводилось на нелинейных крысах весом 180-200 г. Содержание животных и экспериментальные процедуры осуществлялись с соблюдением биоэтических норм. Полную травму спинного мозга моделировали путем перерезки спинного мозга на уровне Th8-Th9. Контузионную травму спинного мозга наносили на уровне Th8-Th9 по модифицированной методике A. R. Allen. Животных выводили из эксперимента на 30-е сутки, после чего извлекались кости (берцовая и бедренная). Для каждой кости определялись геометрические, объёмные и массовые характеристики, а также проводились испытания на трехточечный изгиб. Результаты исследований показали, что травма спинного мозга у опытных крыс приводит к потере прочности бедренной и берцовой костей. При этом в случае контузионной травмы у крыс снижение прочности костей задней конечности более выражено (21% для берцовой и 27% для бедренной костей), чем при полной травме спинного мозга (21% для берцовой и 19% для бедренной костей). В то же время плотность и модуль Юнга берцовой и бедренной костей после полной и контузионной травмы спинного мозга у крыс достоверно не изменялись. На основании полученных результатов авторами выдвинута гипотеза, что в процессе иммобилизации после различной тяжести травмы спинного мозга происходит изменение микроархитектуры костной ткани у опытных животных. Выдвинуто предположение, что именно изменения в микроархитектуре приводят к значительным изменениям прочности костей.
Полная травма спинного мозга, контузионная травма спинного мозга, бедренная и берцовая кости, прочность, упругость, плотность
Короткий адрес: https://sciup.org/146282610
IDR: 146282610 | УДК: 531/534: | DOI: 10.15593/RZhBiomeh/2022.4.04
Текст научной статьи Оценка влияния тяжести травмы спинного мозга на механические свойства костей задних конечностей опытных крыс
Нарушение нейронных связей между головным и спинным мозгом после травмы приводит к стойким функциональным нарушениям опорно-двигательного аппарата, в результате которого человек надолго исключается из привычных для него условий жизнедеятельности и нередко остается недееспособным.
По данным Всемирной организации здравоохранения травмы являются одной из наиболее частых причин смерти среди молодого населения, при этом в структуре показателей травматизма среди взрослого населения травма позвоночника и спинного мозга составляет от 0,8 до 20-26,2 % в объеме всех травм опорнодвигательного аппарата [40], с частотой встречаемости 0,6 на 1000 человек, из них 70 % приходится на повреждения грудопоясничного отдела позвоночника. Около 3 % больных остаются глубокими инвалидами.
Данная группа повреждений зачастую сопровождается остеопорозом. Остеопороз в модели «неиспользования» описывается как форма потери костной ткани в результате механической разгрузки опорнодвигательного аппарата [9; 18]. По данным метаанализа остеопороза в Северной Америке, Японии, Австралии и Европы, 49 млн человек страдают от этого заболевания. По данным анализа подавляющее большинство больных женского пола [40]. Иммобилизация организма влечет за собой серьезную опасность для человека. В группе риска находятся люди, профессия которых связна с малоподвижным образом жизни [1], а так же пациенты, которые долгое время находятся в состоянии ограниченного движения [37]. Остеопороз характеризуется сдвигом баланса остеогенеза и резорбции в сторону последнего, данные изменения происходят на уровне всей кости и клеточной передачи сигнала [19]. Регуляторами механической регенерации кости являются экзогенные (например гравитация) и эндогенные мышечные и прочие силы [17]. Нарушения опорнодвигательного аппарата в условиях ограниченного движения вследствие травмы спинного мозга, очевидно, связаны с изменением механических свойств мышечной ткани и нарушением естественной компенсации при формировании костной ткани.
Крайние проявления остеопороза без нагрузки возникают в результате паралича нижних конечностей после полной травмы спинного мозга (ТСМ), что приводит к повышенному риску переломов в этой популяции пациентов [6; 13]. Потерю костной ткани после ТСМ связывают с мышечным параличом, а также другими факторами, включая поражение спинного мозга и гормональные изменения после травмы [25].
У пациентов после травмы плотность и масса суб-поврежденной кости быстро и линейно снижаются.
Например, при хронических травмах спинного мозга костная ткань большеберцовой кости может быть подвержена снижению плотности на 70 % [27]. Это особенно выражено в губчатой ткани, расположенной в мета-физарно-эпифизарной области дистального отдела бедра и проксимального отдела большеберцовой кости, которые испытывают потерю костной массы на 1-4 % в месяц в течение первых 6-12 месяцев после ТСМ [24], именно эти анатомические участки становятся наиболее частыми местами переломов у людей после ТСМ [12]. Эта частота в 4, 10 и 30 раз выше, чем частота, наблюдаемая в условиях микрогравитации, длительного постельного режима и ранней менопаузы соответственно [21].
ТСМ может не только вызвать потерю костной массы, но и изменить микроструктуру кости. Согласно литературным данным, у пациентов с ТСМ губчатая костная ткань поражается больше, чем пластинчатая. В многочисленных клинических исследованиях сообщается о высокой частоте переломов нижних конечностей у пациентов с ТСМ (до 34 %) [30; 39].
В настоящее время принято считать, что проведение восстановительных мероприятий, направленных на профилактику осложнений ТСМ, необходимо начинать с момента постановки диагноза и непрерывно продолжать в последующие периоды восстановления [17; 37]. Совершенствование хирургической техники и тактики послеоперационного ведения больных, развитие аппаратной реабилитации позволили начинать активизацию и вертикализацию пациентов в ранние сроки после травмы без угрозы дополнительной компрессии спинного мозга [17; 37].
Однако существует точка зрения о небезопасности ранней вертикализации из-за функциональной неподготовленности мышц к выполнению статических и динамических нагрузок, выполнению функционально значимых произвольных напряжений в мышцах, обеспечивающих как статику, так и кинематику у пациентов после травмы. Обсуждается влияние ранней вертикали-зации на механические параметры кости при травме спинного разной степени тяжести [3].
Несмотря на возникающие в клинической практике негативные случаи, связанные с уменьшением прочности костной ткани при ТСМ, исследователями не так подробно изучены влияние степени травмы на прочность костной ткани. Очевидно, что для таких исследований возникают ограничения в случае, если анализируются данные людей, поэтому в настоящем исследовании было принято использовать опытных животных. В качестве опытного животного была выбрана крыса, так как физиологические процессы, происходящие в опорно-двигательном аппарате нижних конечностей при различной физической активности, качественно схожи с человеческими, что было показано исследователями ранее [15; 33].
В литературе имеется несколько исследований, описывающих естественное течение потери костной массы у крыс после ТСМ [10; 41]. Эти исследования, однако, не изучали взаимосвязь между тяжестью травмы и степенью или характером потери костной массы, и, как следствие, механическими свойствами костей. Настоящее исследование было предпринято, чтобы проследить изменение механических свойств костей после травмы спинного мозга разной степени тяжести в диафизарном участке костей задних конечностей у крыс.
Целью работы является оценка влияния полной травмы спинного мозга и контузионной травмы на механические свойства костей у опытных крыс: предел прочности и модуль упругости костной ткани берцовой и бедренной костей.
Материалы и методы
Описание эксперимента
Исследование проводилось на нелинейных крысах весом 180–200 г. Все эксперименты осуществлялись в соответствии с биоэтическими стандартами и одобрены Локальным комитетом по этике Казанского федерального университета (протокол № 2 от 29.05.2018). Содержание, питание, уход за животными и выведение их из эксперимента осуществлялись в соответствии с требованиями Директивы Европейского парламента и Совета от 22 сентября 2010 г. по защите животных, используемых для научных целей ( Directive 2010/63/ UE on the protection of animals used of scientific purposes , 2010).
Все процедуры выполнялись под комбинированной внутримышечной анальгезией с использованием золе-тила ( Zoletil 50, Virbac , Франция) в дозировке 1 мг/кг и ксилавета инъекционного ( XylaVET , Pharmamagist Ltd , Венгрия) в дозировке 0,05 – 0,10 мл/кг. Дозировку подбирали в соответствии с весом экспериментального животного. Эвтаназия животных осуществлялась путем декапитации на гильотине.
В ходе эксперимента воспроизводилась стандартная модель полной и контузионной травмы спинного мозга средней степени тяжести.
Контузионную травму спинного мозга (КТСМ) наносили на уровне Th 8– Th 9 по модифицированной методике A.R. Allen [7] с помощью вертикально падающего груза массой 2,5 г с высоты 5 см. После нанесения травмы наблюдали рефлекторное вытягивание задних конечностей. Падающий груз после нанесения удара сразу удаляли.
Полную травму спинного мозга (ПТСМ) наносили путем перерезки спинного мозга на уровне Th 8– Th 9.
После операции животных помещали в индивидуальные клетки, однократно подкожно вводили 5 мл 0,9 % раствора хлорида натрия. В течение первых суток осуществляли дополнительный обогрев. Доступ к воде и корму не ограничивали. Максимальный срок клинического наблюдения за животными составлял 30 суток. В послеоперационном периоде у животных с нарушением мочеиспускания механически опорожняли мочевой пузырь дважды в день до восстановления его функции.
Животные были разделены на три экспериментальные группы:
-
1. КТСМ – животные с контузионной травмой спинного мозга, 11 животных, 22 образца бедренной и 22 образца берцовой кости.
-
2. ПТСМ – животные с полной травмой спинного мозга, 5 животных, 10 образцов бедренной и 10 образцов берцовой кости.
-
3. Контроль – интактные животные, 5 животных, 10 образцов бедренной и 10 образцов берцовой кости.
Проведение испытаний на трехточечный изгиб
После выведения животного из эксперимента (30-е сутки) производилось извлечение костей. Перед испытанием проводились измерения каждой кости, определялись геометрические, объёмные и массовые характеристики. Определение массы кости осуществлялось с использованием электронных весов. Определение объема кости производилось погружным методом с использованием мерного цилиндра. Плотность кости рассчитывалась по формуле
m
p=v ■
С использованием штангенциркуля проводились измерения проксимального, дистального и диафизарного участков кости. Для фиксации образцов в стаканах использовался сплав Вуда (12,5 % Al, 25 % Pb, 50 % Bi, 12,5 % Cd), позволяющий заплавить и тем самым зафиксировать образец. Низкая температура плавления (60 °C) обеспечивает сохранность образца от тер-мичесокго разрушения.
Для проведения испытаний на трехточечный изгиб применялась специализированная оснастка, схема которой приведена на рис. 1. Ниже представлено описание проведения испытания. Так, проксимальный отдел кости (позиция 1 на рис. 1) устанавливался в стаканы (позиция 2 на рис. 1) и крепился в них с помощью сплава Вуда, после чего производилась центровка крепежного кольца (позиция 3 на рис. 1), которое крепится к верх- ней траверсе установки (позиция 5 на рис. 1), стаканы устанавливались на жесткую опору (позиция 4 на рис. 1), которая крепится к нижней неподвижной траверсе (позиция 5 на рис. 1). При проведении испытаний верхней траверсе задается перемещение, и через крепежное кольцо (позиция 3 на рис. 1) это перемещение передается кости (позиция 1 на рис. 1), при этом производятся замеры прикладываемого усилия, перемещения и времени.
Перед испытанием измерялись: расстояние между краями стаканов (позиция 2 на рис. 1), куда была уста-
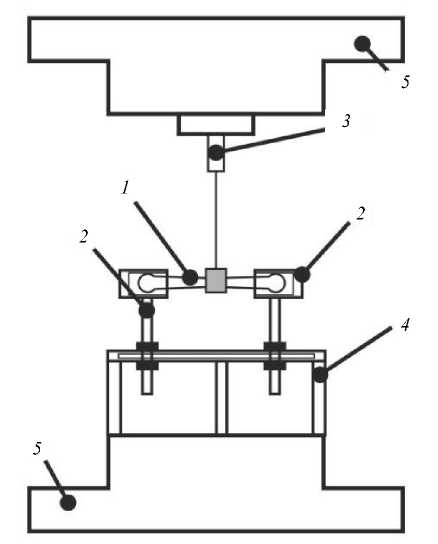
Рис. 1. Схема экспериментальной установки: 1 – кость, 2 – стаканы, 3 – крепежное кольцо, 4 – жесткая опора, 5 – траверсы
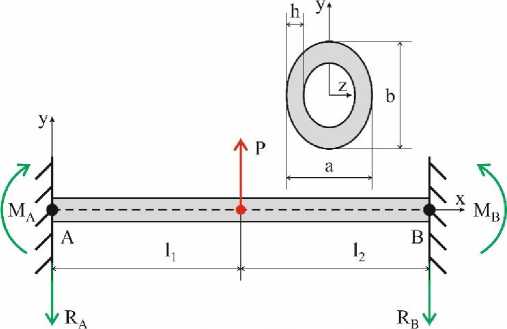
Рис. 2. Расчетная схема: P – прикладываемая сила, l1, l2 – расстояния от заделки до точки приложения силы, RA, RB, MA, MB – возникающие в заделке реактивные силы и моменты новлена кость, и расстояние от крепежного кольца (позиция 3 на рис. 1) до торца каждого стакана.
После окончания испытаний измерялись части кости, полученные после перелома (от начала проксимального и дистального участка до места перелома соответственно), также измерялась толщина стенки кости.
Испытания производились на двухзональной универсальной испытательной машине УТС 110М-100 (Россия, г. Иваново). Выходными данными после проведения испытаний на прессе является файл, содержащий значения перемещения, прикладываемой нагрузки и времени.
Обработка полученный данных
Рассмотрим расчетную схему проводимого эксперимента на трехточечный изгиб. Так как для фиксации дистальных участков кости используются стаканы со сплавом Вуда, то в расчетной схеме граничные условия принимают вид жесткой заделки. Поэтому необходимо определить связь между прикалдываемой силой, перемещением в этой точке и упругими свойствами. На рис. 2 представлена расчётная схема для экспериментального исследования.
Для системы можно выписать условия равновесия в следующем виде:
Ra + Rb = P, (2)
-
- M A + Pl i - Rb ( l i + l 2 ) + M B = 0. (3)
Система является дважды статически неопределимой и для дополнения разрешающих уравнений необходимо добавить уравнения деформирования кости. Таким образом, для определения параметров кости составляется дифференциальное уравнение упругой линии балки при изгибе [2]
EIzz y "( x ) = MA - RA x + P ( x - l i ) , (4)
где E – модуль Юнга, I zz – момент инерции поперечного сечения относительно оси z , y(x) – перемещение по оси y точки с координатой x .
Несмотря на неоднородность геометрии кости, уже на этом этапе была использована гипотеза постоянного поперечного сечения. Это обусловлено сложностью измерения поперечного сечения для реального образца. При проведении экспериментов поперечное сечение описывалось эллиптическим кольцом (см. рис. 2).
Граничные условия для уравнения (4) можно выписать в следующем виде:
|
y ( 0 ) = 0 , |
(5) |
|
ф ( 0 ) = 0 , |
(6) |
|
y ( l i + 1 2 ) = 0 , |
(7) |
ф ( / 1 + 1 2 ) = 0 . (8)
Интегрируя уравнения прогиба (4) совместно с граничными условиями (5)–(8) и дополняя систему уравнениями равновесия (2), (3), получим систему линейных алгебраических уравнений относительно неизвестных реактивных сил и моментов. Решив эту систему линейных алгебраических уравнений, получим величины реакций M a , M b , R a , R b :
R A
R B
= P ( 31 1 1 2 + 1 2 )
" ( 1 1 + 1 2 ) 3 ’
P ( 1 3 + 3 1 2 1 2)
= ( 1 1 + 1 2 ) 3 ,
M A
l 1 l 2 2 P
( 1 1 + 1 2 ) 2 ,
M B
l 1 2 l 2 P
( 1 1 + 1 2 ) 2 .
Подставляя найденные реакции (9)–(12) в дважды проинтегрированное уравнение изгиба (4), в точке приложения силы можно получить следующее выражение для модуля Юнга:
E =___-___-1—2____
I zz y ( 1 ) 3 ( 1 1 + 1 2 ) 3
.
Так, в выражении (13) величины 1 1 и 1 2 - определяются измерением точки приложения силы до начала эксперимента. Величины силы P и перемещения y(1 1 ) определяются показаниями испытательной машины во время эксперимента. Осевой момент инерции для эл-липтичесокго кольца определялся по формуле
I zz =П [ ab 3 -( a - h )( b - h ) 3 ] , (14)
где a - горизонтальный размер диафиза, b - вертикальный размер диафиза, h - толщина стенки костной ткани.
Анализ механических свойств костной ткани
Для дальнейшего определения механических свойств костной ткани полученные данные обрабатывались с помощью ранее разработанной программы в пакете прикладных программ MatLab R 2021 [5]. Входными данными для программы являются значения усилий и перемещений, полученные с экспериментальной установки в виде бинарных файлов. По данным зависимости силы от перемещения определялись линейные участки, коэффициенты пропорциональности и максимальные усилия.
По представленной выше методике производился расчет модуля упругости для линейных участков и максимальное напряжение. Выходными данными программы являются предельные напряжения и модуль упругости для каждой кости, а также графическое изображение диаграммы нагружения.
Анализ механических свойств, полученных после обработки данных с экспериментальной установки на ЭВМ, производился на основе методов математической статистики. Для каждого механического параметра из группы производилась проверка на нормальность распределения (тест Jarque - Bera ), определялся доверительный интервал. Далее производился парный тест на равенство средних значений в двух выборках (парный критерий Стьюдента) или проверка однородности двух генеральных совокупностей (ранговый тест Вилкоксона) [4]. Требуемый уровень значимости составлял p =0,05 для всех доверительных интервалов , р езультаты в тексте приведены в виде среднее ± половина доверительного интервала.
Результаты
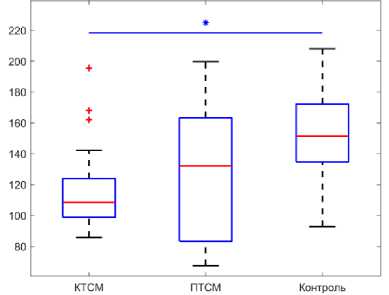
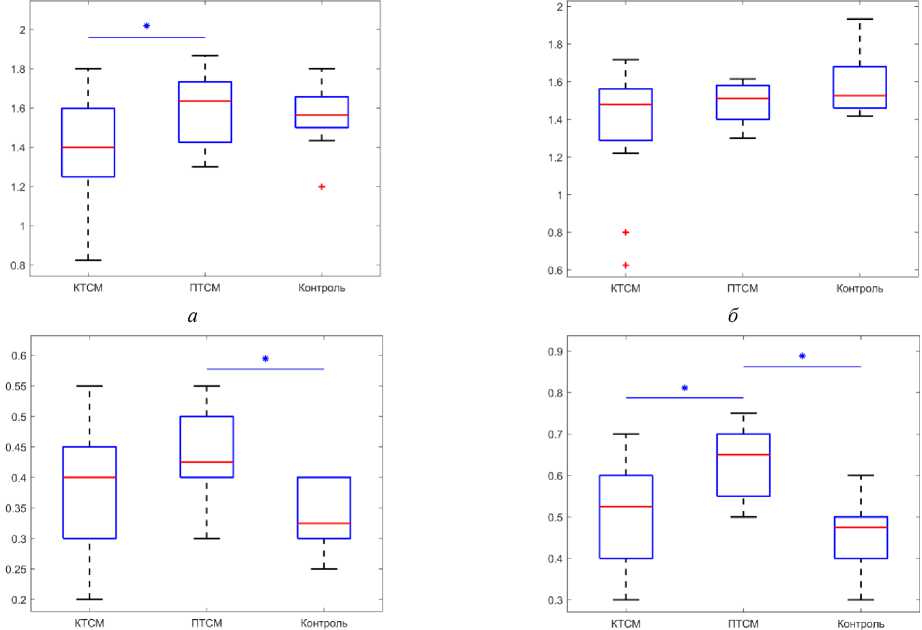
В группах с контузионной травмой спинного мозга и полной травмой спинного мозга были обнаружены следующие изменения прочности костной ткани (рис. 3, а и б) . У берцовой и бедренной кости в группе КТСМ достоверно уменьшился предел прочности на 21,09 и 27,26 % соответственно относительно данных контрольной группы (бедренная - 150,77 ± 20,11 МПа; берцовая - 117,48 ± 9,90 МПа) (р <0,05). Значение предельного напряжения костей в группе ПТСМ также достоверно уменьшилось для бедренной кости на 19,29 % (117,48 ± 9,90 МПа) относительно данных контрольной группы ( p <0,05). Предел прочности берцовых костей из группы ПТСМ недостоверно уменьшился относительно данных группы контроля на 21 % (117,48 ± 9,90 МПа). Доверительные интервалы величин предельных напряжений представлены в табл. 1.
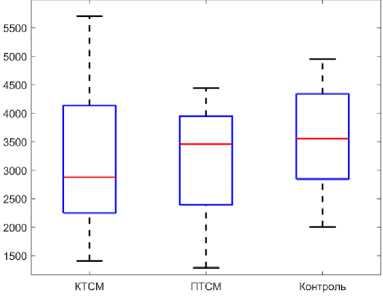
Модуль Юнга в группах контузионной и полной травмы спинного мозга изменился следующим образом (рис. 3, в и г ). В группе КТСМ и ПТСМ значения модуля Юнга для берцовой кости недостоверно уменьшились относительно данных контрольной группы на 10,3 % (3243,93 ± 526,11 МПа) и 12,49 % (3165,50 ± 667,15 МПа) соответственно. Для бедренной кости групп КТСМ и ПТСМ недостоверно увеличились значения модуля Юнга относительно данных контрольной группы на 11,28 % (1627,83 ± 430,73 МПа) и 14,02 % (1667,78 ± 317,00 МПа). Доверительные интервалы величин модуля Юнга представлены в табл. 2.
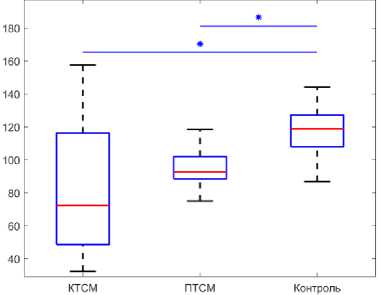
Были измерены параметры плотности костей задних конечностей крысы во всех экспериментальных группах (рис. 4, а и б). У берцовой и бедренной костей в группе КТСМ недостоверно уменьшилась плотность на 10,19 и 11,46 % соответственно относительно значений контрольной группы (1,41 ± 0,12 г/см3; 1,39 ± 0,12 г/см3). Значения плотности в группе ПТСМ недостоверно увеличились на 2,54 % (1,61 ± 0,11 г/см3) для берцовой кости относительно данных контрольной группы и недостоверно уменьшились для бедренной кости также относительно данных контрольной группы на 5,09 % (1,49 ± 0,07 г/см3). Доверительные интервалы величин плотности представлены в табл. 3.
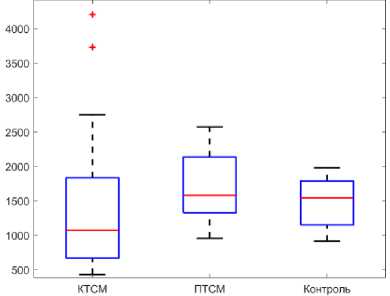
Объем кости изменился следующим образом (рис. 4, в и г ): для группы ПТСМ: достоверно увеличилось значение для берцовой и бедренной костей относительно данных контрольной группы на 26,47 и 36,17 % (0,43 ± 0,05 см3; 0,64 ± 0,05 см3) (р <0,05). В группе КТСМ значение объема недостоверно увеличилось на 11,76% для берцовой (0,38 ± 0,04 см3) и на 6,38 % для бедренной кости (0,50 ± 0,05 см3) ( р <0,05). Доверительные интервалы величин объема кости представлены в табл. 4.
Обсуждение
Двигательная разгрузка задних конечностей постоянна в модели полной травмы, но временна после контузии спинного мозга у крыс. Таким образом, обе модели - полной травмы и контузии - воспроизводят дифференциальную нагрузку на конечности. Результаты показали, что травма спинного мозга приводит к потере прочности бедренной и берцовой костей у крыс. В модели контузионной травмы снижение прочности костей задней конечности у крыс более выражено, чем при полной травме спинного мозга, в то же время жесткость берцовой и бедренной костей после полной и контузионной травмы спинного мозга у крыс достоверно не изменялась.
Иммобилизация приводит к адаптивному отве-ту, который включает ингибирование образования остеобластами кости и усиление резорбции кости остеокластами, все это приводит к деминерализации [6]. Данные изменения характерны как для контузионной, так и для полной травмы спинного мозга.
Существуют исследования по изучению увеличения резорбции кости и связанного с ней оттока кальция из костей после ТСМ, что приводит к превышающим норму концентрациям кальция в моче (гиперкаль-циурия) и крови (гиперкальциемия) [29].
В исследовании профилей витамина D, паратгормона и кальцитонина у лиц с длительной травмой спинного мозга было выдвинуто предположение, что снижение паратиреоидного гормона обусловлено «незначительным повышенным высвобождением кальция», это также указывает на постоянно повышенную резорб- цию кости даже спустя несколько лет после ТСМ [14; 16; 28].
Рассуждая об этиологии ТСМ, нужно упомянуть половые гормоны. Они принимают участие в регуляции костного метаболизма [34]. Эстроген и андроген ингибируют резорбцию кости и способствуют формированию кости с помощью различных механизмов [35; 38]. Так же эстроген предотвращает апоптоз остеоцитов [23; 27]. ТСМ вызывает ингибирование производства и секреции половых гормонов. Так, уровень тестостерона у людей с ТСМ ниже уже в течение 16 недель после травмы [28].
Предполагается, что потеря костной массы в диафизарных участках, состоящих в основном из кор -тикальной кости, характеризуется уменьшением толщины стенки за счет эндокортикальной резорбции в дополнение к меньшему снижению минеральной плотности пластинчатой кости [42; 32; 36].
Однако результаты показали, что общая плот-ность для костей в обоих случаях травмы не изменялась. Толщина стенки кости также оставалась не изменной во всех группах. При этом прочность снизилась значительно (в группе КТСМ для бедренной кости на 21 % и для берцовой кости на 27 %, в группе ПТСМ на 19 % для бедренной кости).
Достоверное снижение прочности при постоянной плотности в группах ПТСМ и КТСМ даёт основание предположить, что прочность снижается в силу изменения микроархитектуры костной ткани. Так как в работе рассматривалась пластинчатая костная ткань, то можно выдвинуть предположение, что в этом случае микроархитектура определяется кровеносными сосудами, остеоцитами и гаверсовыми каналами [11]. Также можно рассматривать влияние симпатической нервной системы на потерю костной массы: было показано [25; 26], что прерванные симпатические нервы приводят к модификации сосудов в субповрежденных областях. Схожие результаты были получены авторами ранее в моделях антиортостатического вывешивания опытных крыс [10]. На основе данных съемки на микрофокусном рентгеновском компьютерном томографе было показано, что архитектура кровеносных каналов в пластинчатой костной ткани изменяется, что и приводит к значительному снижению прочности.
В то же время в клинической практике наиболее распространённые методы диагностики остеопороза опираются на оценку плотности костного вещества. Так, денситометрия измеряет площадную минеральную плотность кости, на которую сильно влияет размер кости, что приводит к тому, что более крупные кости имеют большую плотность, чем более мелкие, по результатам исследования [22]. Денситометрические измерения не различают губчатую и пластинчатую компоненты [22].
а
б
в
г
Рис. 3. Предельное напряжение (МПа): а – берцовая кость, б – бедренная кость; модуль Юнга (МПа): в – берцовая кость, г – бедренная кость
в г
Рис. 4. Плотность (г/см3): а – берцовая кость, б – бедренная кость; объем (см3): в – берцовая кость, г – бедренная кость
Таблица 1
Доверительные интервалы для предельных напряжений (МПа)
|
Берцовая кость |
Бедренная кость |
||
|
Контузионная травма спинного мозга |
118,96 ± 11,74 |
85,45 ± 14,91 |
|
|
Полная травма спинного мозга |
129,80 ± 28,38 |
94,82 ± 8,50 |
|
|
Контроль |
150,77 ± 20,11 |
117,48 ± 9,90 |
|
|
Доверительные интервалы для модуля Юнга (МПа) |
Таблица 2 |
||
|
Берцовая кость |
Бедренная кость |
||
|
Контузионная травма спинного мозга |
3243,93 ± 526,11 |
1627,83 ± 430,73 |
|
|
Полная травма спинного мозга |
3165,50 ± 667,15 |
1667,78 ± 317,00 |
|
|
Контроль |
3617,78 ± 576,52 |
1462,22 ± 241,84 |
|
|
Доверительный интервал для плотности (г/см3) |
Таблица 3 |
||
|
Берцовая кость |
Бедренная кость |
||
|
Контузионная травма спинного мозга |
1,41 ± 0,12 |
1,39 ± 0,12 |
|
|
Полная травма спинного мозга |
1,61 ± 0,11 |
1,49 ± 0,07 |
|
|
Контроль |
1,57 ± 0,11 |
1,57 ± 0,10 |
|
|
Доверительный интервал для объема (см3) |
Таблица 4 |
||
|
Берцовая кость |
Бедренная кость |
||
|
Контузионная травма спинного мозга |
0,38 ± 0,04 |
0,50 ± 0,05 |
|
|
Полная травма спинного мозга |
0,43 ± 0,05 |
0,64 ± 0,05 |
|
|
Контроль |
0,34 ± 0,03 |
0,47 ± 0,06 |
Это ограничение особенно актуально при диагностике остеопороза из-за различий в степени и времени потери костной массы этих двух костных компонентов [6].
Исследователями уже озвучиваются тезисы, что прочность костной ткани зависит не только от минеральной плотности кости, что иллюстрируется расхождениями между результатами денситометрии и наблюдаемыми рисками перелома [8; 20]. А это приводит к необходимости развития новых технологий, направленных на оценку микроархитектуру кости [31]. Более того, полученные в исследовании результаты иллюстрируют непоказательность такого рода измерений. Иными словами, при той же или повышенной минеральной плотности микроархитектура костной ткани может отличаться, что на самом деле влияет на прочностные характеристики. Всё это может привести к недооценке риска переломов при диагностике методом денситометрии.
Рентгеновская компьютерная томография (РКТ), напротив, позволяет восстановить объемные данные, а значит и позволяет количественно оценить параметры губчатой и пластинчатой компонентов кости [22], в том числе потенциально оценить микроархитектуру костной ткани. Но в случае оценки микроархитектуры пластинчатой костной ткани с помощью РКТ наиболее важным параметром становится разрешающая способность. При этом в клинических исследованиях для наиболее распространенных моделей томографов (например, Siemens Somatom Emotion 6) и протоколов исследования размер вокселя составляет порядка 0,7×0,7 мм в поперечном сечении и от 1 до 3 мм в продольном. А такой разрешающей способности не хватает для достоверной оценки микроархитектуры пластинчатой костной ткани. И если размер в поперечном сечении чаще всего определяется непосредственно томографом, то большой размер вок-селя в продольном направлении чаще всего связан с протоколом исследования, а именно со скоростью подачи стола. Это обусловлено большим потоком пациентов и временными ограничениями диагностических исследований.
А значит, полученные результаты сигнализируют о необходимости развития клинических диагностических методов для достоверной оценки прочности костной ткани в случае ТСМ. При этом в исследовании показано, что пациенты с КТСМ в условиях существующих диагностических методов находятся в группе риска, так как у них наблюдается большее снижение прочности.
Конечно, гипотеза о влиянии микроархитектуры кровеносной системы должны быть проверена, для чего авторами планируется дополнительное исследование образцов на микрофокусном рентгеновском компьютерном томографе.
Заключение
В исследовании были проанализированы механические свойства костной ткани при контузионной и полной травмах спинного мозга. Использовались экспериментальные модели на животных. В исследовании измерялись геометрические, массовые и прочностные свойства бедренных и берцовых костей. В качестве основных результатов можно выделить следующие:
-
1. Прочность бедренной и берцовой костей при контузионной травме спинного мозга у крыс снижается.
-
2. Прочность бедренной кости при полной травме спинного мозга у крыс снижается.
-
3. Модуль упругости и плотность бедренной и берцовой костей при контузионной и полной травме спинного мозга у крыс не изменяется.
-
8. Ammann P, Rizzoli R. Bone strength and its determinants // Osteoporos Int. – 2003. – Vol. 14, suppl. 3. – P. 13-18. DOI: 10.1007/s00198-002-1345-4. Epub 2003 Mar 19. PMID: 12730800.
-
9. Alexandre C., Vico L. Pathophysiology of bone loss in disuse osteoporosis // Joint. Bone Spine. – 2011. – Vol. 78, no. 6. – P. 572–576. DOI: 10.1016 /j.jbspin.2011.04.007.
-
10. Baltina T., Sachenkov O., Gerasimov O., Baltin M., Fedyanin A., Lavrov I. The influence of hindlimb un-loading on the bone tissue’s structure // BioNanoSci-ence. – 2018. – Vol. 8, no. 3. – P. 864–867.
-
11. Biering-Sorensen F., Bohr H., Schaadt O. Bone mineral content of the lumbar spine and lower extremities years after spinal cord lesion // Paraplegia. – 1998. – Vol. 26. – P. 293–301.
-
12. Cirnigliaro C.M., Myslinski M.J., La Fountaine M.F., Kirsh-blum S.C., Forrest G.F., Bauman W.A. Bone loss at the distal femur and proximal tibia in persons with spinal cord injury: imaging approaches, risk of fracture, and potential treatment options // Osteoporos. Int. – 2017. – Vol. 28, no 3. – P. 747– 765. DOI: 10.1007 /s00198-016-3798-x.
-
13. Dimitri P., Rosen C. The central nervous system and bone me-tabolism:an evolving story // Calcif Tissue Int. – 2017. – Vol. 100, no. 5. – P. 476–485.
-
14. Frost H. M. Bone's mechanostat: a 2003 update. The anatomical record part a: discoveries in molecular, cellu
lar, and evolutionary biology // An Official Publication of the American Association of Anatomists. – 2003. – Vol. 275, no. 2. – P. 1081–1101.
-
15. Frost H.M., Jee W.S.S. On the rat model of human osteopenias and osteoporoses // Bone and Mineral. – 1992. – Vol. 18, is. 3. – P. 227–236.
-
16. Frotzler A., Cheikh-Sarraf B., Pourtehrani M., Krebs J., Lip-puner K. Long-bone fractures in persons with spinal cord injury // Spinal Cord. – 2015. – Vol. 53, no. 9. – P. 701–704.
-
17. Griffith J.F., Genant H.K. New advances in imaging osteoporosis and its complications // Endocrine. – 2012. – Vol. 42. – P. 39–51.
-
18. Jiang S., Jiang L., Dai L. Mechanisms of osteoporosis in spinal cord injury // Clin Endocrinol. – 2006. – Vol. 65. – P. 555–565.
-
19. Krassioukov A.V., Bunge R.P., Pucket W.R., Bygrave MA. The changes in human spinal sympathetic pregan-glionic neurons after spinal cord injury // Spinal Cord. – 1999. – Vol. 37. – P. 6–13.
-
20. Licata A.A. Challenges of estimating fracture risk with dxa: changing concepts about bone strength and bone density // Aerosp Med Hum Perform. – 2015. – Vol. 86, is. 7. – P. 628– 632. DOI: 10.3357/AMHP.4208.2015. PMID: 26102143.
-
21. Lin T., Tong W., Chandra A., Hsu S.Y., Jia H., Zhu J., Tseng W.J., Levine M.A., Zhang Y., Yan S.G., Liu X.S., Sun D., Young W., Qin L. A comprehensive study of long-term skeletal changes after spinal cord injury in adult rats // Bone Res. – 2015. – Vol. 3. – Art. 15028. DOI: 10.1038/boneres.2015.28.
-
22. Maimoun L., Couret I., Mariano-Goulart D., Dupuy A.M., Micallef J.P., Peruchon E. Changes in osteopro-tegerin/RANKL system , bone mineral density , and bone biochemicals markers in patients with recent spinal cord injury // Calcif Tissue Int. – 2005. – Vol. 76. – P. 404–411.
-
23. Maïmoun L., Fattal C., Micallef J.P., Peruchon E., Rabischong P. Bone loss in spinal cord-injured patients: from physiopathology to therapy // Spinal Cord. – 2006. – Vol. 44. – P. 203. DOI: 10.1038/sj.sc.3101832.
-
24. Maïmoun L., Fattal C., Sultan C. Bone remodeling and calcium homeostasis in patients with spinal cord injury: a review // Metabolism. – 2011. – Vol. 60, no 12. – P. 1655–1663. DOI: 10.1016/j.metabol.2011.04.005.
-
25. Maynard F.M. Immobilization hypercalcemia follow-ing spinal cord injury // Arch Phys Med Rehabil. – 1986. – Vol. 67, no 1. – P. 41–44.
-
26. Nielsen S.P. The fallacy of bmd :a critical review of the diagnostic use of dual x-ray absorptiometry // Clin Rheumatol. – 2000. – Vol. 19. – P. 174–183.
-
27. Qin W., Bauman W.A., Cardozo C.P. Evolving con-cepts in neurogenic osteoporosis // Curr Osteoporos Rep. – 2010. – Vol. 8, no. 4. – P. 212–218.
-
28. Riggs B.L., Khosla S., Melton L.J. Sex steroids and the construction and conservation of the adult skeleton // Endocr Rev. – 2002. – Vol. 23, no. 3. – P. 279–302.
-
29. Sievanen H., Koskue V., Rauhio A., Kannus P., Hei-nonen ARI, VUORI I. Peripheral quantitative computed tomography in human long bones:evaluation of in vitro and in vivo precision // Bone Miner Res. – 1998. – Vol. 13, no. 5. – P. 871–882.
-
30. Sözen T., Özışık L., Başaran N.Ç. An overview and management of osteoporosis // European journal of rheumatology. – 2017. – Vol. 4, no. 1. – P. 46.
-
31. Williams S., MS, RD, MD, CCD, FACP, FACE, Leila Khan, MD and Angelo A. Licata, MD, PhD, FACP, FACE // Cleveland Clinic Journal of Medicine. – 2021. – Vol. 88, is. 11. – P. 615–622. DOI: 10.3949 /ccjm.88a.20199.
-
32. Syed F., Khosla S. Mechanisms of sex steroid effects on bone // Biochem Biophys Res Commun . – 2005. – Vol. 328. – P. 688– 696.
-
33. Taguchi T., Lopez M.J. An overview of de novo bone generation in animal models // Journal of orthopedic research. – 2020. – Vol. 39, Is. 1. – P.7–21.
-
34. Wade S.W., Strader C., Fitzpatrick L.A., Anthony M.S., O’Malley C.D. Estimating prevalence of osteoporosis: examples from industrialized countries // Archives of os-teoporosis. – 2008. – Vol. 9, no. 1. – P. 1–10.
-
35. Yarrow J.F., Wnek R.D., Conover C.F., Reynolds M.C., Buckley K.H., Kura J.R., Sutor T.W., Otzel D.M., Mattingly A.J., Croft S., Aguirre J.I., Borst S.E., Beck D.T., McCullough D.J. Bone loss after severe spinal cord injury coincides with reduced bone formation and precedes bone blood flow deficits // Appl Physiol. – 2021. – Vol. 131, no. 4. – P. 1288–1299. DOI: 10.1152 /japplphysiol.00444.2021.
-
36. Zehnder Y., Thi M.L., Michel D., Knecht H., Perrelet R., Neto I. Long-term changes in bone metabolism , bone mineral density , quantitative ultrasound parameters, and fracture incidence after spinal cord injury:a cross-sectional observational study in 100 paraplegic men // Osteoporos Int. – 2004. – Vol. 15. – P.180–189.
-
37. Metzger C.E., Gong S., Aceves M., Bloomfield S.A., Hook M.A. Osteocytes reflect a pro-inflammatory state following spinal cord injury in a rodent model // Bone. – 2019. – Vol. 120. – P. 465–475. DOI: 10.1016 /j.bone.2018.12.007.
-
38. Baltin M.E., Sabirova D.E., Kiseleva E.I., Baltina T.V., Lavrov I.A. Comparison of systemic and localized carrier-mediated delivery of methylprednisolone succinate for treatment of acute spinal cord injury // Experimental Brain Research. – 2021. – Vol. 239, no. 2. – P. 627–638. DOI: 10.1007/s00221-020-05974-w.
-
39. Gordienko D.I. Tactics of surgical treatment of open shin fractures // The department of traumatology and orthopedics. – 2013. – Vol. 1, no. 5. – P. 15–26.
-
40. Boehl G., Raguindin P.F., Valido E., Bertolo A., Itodo O.A., Minder B., Lampart P., Scheel-Sailer A., Leichtle A., Glisic M., Stoyanov J. Endocrinological and inflam-matory markers in individuals with spinal cord injury: A systematic review and me-ta-analysis // Rev Endocr Metab Disord. – 2022. – Vol. 23. – P. 1035–1050. DOI: 10.1007/s11154-022-09742-9.
-
41. Tettero J.M., van Eeghen E., Kooter A.J. Extreme hypercal-caemia caused by immobilisation due to acute spinal cord injury // BMJ Case Rep. – 2021. – Vol. 14, no. 6. – Art. e241386. DOI: 10.1136/bcr-2020-241386.
-
42. He B., Zhu Y., Cui H., Sun B., Su T., Wen P. Compari-son of necroptosis with apoptosis for ovx-induced osteoporosis // Front Mol Biosci. – 2021. – Vol. 8. – Art. 790613. DOI: 10.3389/fmolb.2021.790613.
Таким образом, была произведена оценка влияния полной и контузионной травмы спинного мозга на механические свойства костей у опытных крыс.
in. the spinal cord dueto impact an experimental study // Nerv. Ment. Dis. – 1998. – Vol. 31. – P. 141–147.
DOI:10.3171/jns.1971.35.6.0709.
Список литературы Оценка влияния тяжести травмы спинного мозга на механические свойства костей задних конечностей опытных крыс
- Корнилов Н.В., Аврунин. А.С. Адаптационные про-цессы в органах скелета. - СПб.: Морсар АВ; М-во здравоохранения РФ; Рос. науч.-исслед. ин-т травматологии и ортопедии им. Р. Р. Вредена, 2001. - 296 с.
- Кривошапко С. Н. Сопротивление материалов // Юрайт. -M., 2017. - 416 с.
- Мамбетова ГШ., Такенов Ж.Т., Мустафаева А.С., Садыр-бекова А.К., Кисаев Е.В., Садыкова К.Т., Абишева А.К., Бергенева А.А. Применение ранней вертикализации в нейрореабилитации // Нейрозирурияи иневрология казахстана. - 2018. - Т. 4, № 53. - С. 25-31.
- Письменный Д.Т. Конспект лекций по теории вероятностей и математической статистике. - М.: Айрис-пресс, 2008. - 288 с.
- Свидетельство о государственной регистрации ПЭВМ № 2020615249 Программа для автоматического определения механических свойств костной ткани по экспериментальным данным: № 2020613959: заявл. 03.04.2020: опубл. 19.05.2020 / Саченков О.А., Яикова В.В., Харин Н.В. ; заявитель ФГАОУ ВО «Казанский (Приволжский) федеральный университет».
- Abdelrahman S., Ireland A., Winter E.M., Purcell M., Coupaud S. Osteoporosis after spinal cord injury: aeti-ology, effects and therapeutic approaches // Musculo-skelet Neuronal Interact. -2021. - Vol. 21 , no. 1. - P. 26-50. PMID: 33657753.
- Allen A.R., Remarks on the histopathological changes in. the spinal cord dueto impact an experimental study // Nerv. Ment. Dis. - 1998. - Vol. 31. - P. 141-147. D01:10.3171/jns.1971.35.6.0709.
- Ammann P, Rizzoli R. Bone strength and its determinants // Osteoporos Int. - 2003. - Vol. 14, suppl. 3. - P. 13-18. DOI: 10.1007/s00198-002-1345-4. Epub 2003 Mar 19. PMID: 12730800.
- Alexandre C., Vico L. Pathophysiology of bone loss in disuse osteoporosis // Joint. Bone Spine. - 2011. - Vol. 78, no. 6. - P. 572-576. DOI: 10.1016 /j.jbspin.2011.04.007.
- Baltina T., Sachenkov O., Gerasimov O., Baltin M., Fedyanin A., Lavrov I. The influence of hindlimb un-loading on the bone tissue's structure // BioNanoSci-ence. - 2018. - Vol. 8, no. 3. -P. 864-867.
- Biering-Sorensen F., Bohr H., Schaadt O. Bone mineral content of the lumbar spine and lower extremities years after spinal cord lesion // Paraplegia. - 1998. - Vol. 26. - P. 293-301.
- Cirnigliaro C.M., Myslinski M.J., La Fountaine M.F., Kirsh-blum S.C., Forrest G.F., Bauman W.A. Bone loss at the distal femur and proximal tibia in persons with spinal cord injury: imaging approaches, risk of fracture, and potential treatment options // Osteoporos. Int. - 2017. - Vol. 28, no 3. - P. 747765. DOI: 10.1007 /s00198-016-3798-x.
- Dimitri P., Rosen C. The central nervous system and bone metabolisms evolving story // Calcif Tissue Int. - 2017. - Vol. 100, no. 5. - P. 476-485.
- Frost H. M. Bone's mechanostat: a 2003 update. The anatomical record part a: discoveries in molecular, cellular, and evolutionary biology // An Official Publication of the American Association of Anatomists. - 2003. - Vol. 275, no. 2. - P. 1081-1101.
- Frost H.M., Jee W.S.S. On the rat model of human osteopenias and osteoporoses // Bone and Mineral. - 1992. - Vol. 18, is. 3. - P. 227-236.
- Frotzler A., Cheikh-Sarraf B., Pourtehrani M., Krebs J., Lip-puner K. Long-bone fractures in persons with spinal cord injury // Spinal Cord. - 2015. - Vol. 53, no. 9. - P. 701-704.
- Griffith J.F., Genant H.K. New advances in imaging osteoporosis and its complications // Endocrine. - 2012. - Vol. 42. - P. 39-51.
- Jiang S., Jiang L., Dai L. Mechanisms of osteoporosis in spinal cord injury // Clin Endocrinol. - 2006. - Vol. 65. - P. 555-565.
- Krassioukov A.V., Bunge R.P., Pucket W.R., Bygrave MA. The changes in human spinal sympathetic pregan-glionic neurons after spinal cord injury // Spinal Cord. - 1999. - Vol. 37. -P. 6-13.
- Licata A.A. Challenges of estimating fracture risk with dxa: changing concepts about bone strength and bone density // Aerosp Med Hum Perform. - 2015. - Vol. 86, is. 7. - P. 628632. DOI: 10.3357/AMHP.4208.2015. PMID: 26102143.
- Lin T., Tong W., Chandra A., Hsu S.Y., Jia H., Zhu J., Tseng W.J., Levine M.A., Zhang Y., Yan S.G., Liu X.S., Sun D., Young W., Qin L. A comprehensive study of long-term skeletal changes after spinal cord injury in adult rats // Bone Res. -2015. - Vol. 3. - Art. 15028. DOI: 10.1038/boneres.2015.28.
- Maimoun L., Couret I., Mariano-Goulart D., Dupuy A.M., Micallef J.P., Peruchon E. Changes in osteopro-tegerin/RANKL system , bone mineral density , and bone bio-chemicals markers in patients with recent spinal cord injury // Calcif Tissue Int. - 2005. - Vol. 76. - P. 404-411.
- Maimoun L., Fattal C., Micallef J.P., Peruchon E., Rabischong P. Bone loss in spinal cord-injured patients: from physiopathol-ogy to therapy // Spinal Cord. - 2006. - Vol. 44. - P. 203. DOI: 10.1038/sj.sc.3101832.
- Maimoun L., Fattal C., Sultan C. Bone remodeling and calcium homeostasis in patients with spinal cord injury: a review // Metabolism. - 2011. - Vol. 60, no 12. - P. 1655-1663. DOI: 10.1016/j.metabol.2011.04.005.
- Maynard F.M. Immobilization hypercalcemia follow-ing spinal cord injury // Arch Phys Med Rehabil. - 1986. - Vol. 67, no 1. - P. 41 -44.
- Nielsen S.P. The fallacy of bmd:a critical review of the diagnostic use of dual x-ray absorptiometry // Clin Rheumatol. -2000. - Vol. 19. - P. 174-183.
- Qin W., Bauman W.A., Cardozo C.P. Evolving con-cepts in neurogenic osteoporosis // Curr Osteoporos Rep. - 2010. - Vol. 8, no. 4. - P. 212-218.
- Riggs B.L., Khosla S., Melton L.J. Sex steroids and the construction and conservation of the adult skeleton // Endocr Rev. - 2002. - Vol. 23, no. 3. - P. 279-302.
- Sievanen H., Koskue V., Rauhio A., Kannus P., Hei-nonen ARI, VUORI I. Peripheral quantitative computed tomography in human long bones:evaluation of in vitro and in vivo precision // Bone Miner Res. - 1998. - Vol. 13, no. 5. - P. 871-882.
- Sözen T., Özi^ik L., Ba^aran N.Q. An overview and management of osteoporosis // European journal of rheumatology. -2017. - Vol. 4, no. 1. - P. 46.
- Williams S., MS, RD, MD, CCD, FACP, FACE, Leila Khan, MD and Angelo A. Licata, MD, PhD, FACP, FACE // Cleveland Clinic Journal of Medicine. - 2021. - Vol. 88, is. 11. - P. 615-622. DOI: 10.3949 /ccjm.88a.20199.
- Syed F., Khosla S. Mechanisms of sex steroid effects on bone // Biochem Biophys Res Commun . - 2005. - Vol. 328. - P. 688696.
- Taguchi T., Lopez M.J. An overview of de novo bone generation in animal models // Journal of orthopedic research. - 2020. - Vol. 39, Is. 1. - P.7-21.
- Wade S.W., Strader C., Fitzpatrick L.A., Anthony M.S., O'Malley C.D. Estimating prevalence of osteoporosis: examples from industrialized countries // Archives of os-teoporosis. - 2008. - Vol. 9, no. 1. - P. 1-10.
- Yarrow J.F., Wnek R.D., Conover C.F., Reynolds M.C., Buckley K.H., Kura J.R., Sutor T.W., Otzel D.M., Mattingly A.J., Croft S., Aguirre J.I., Borst S.E., Beck D.T., McCullough D.J. Bone loss after severe spinal cord injury coincides with reduced bone formation and precedes bone blood flow deficits // Appl Physiol. - 2021. - Vol. 131, no. 4. - P. 1288-1299. DOI: 10.1152 /japplphysiol.00444.2021.
- Zehnder Y., Thi M.L., Michel D., Knecht H., Perrelet R., Neto I. Long-term changes in bone metabolism , bone mineral density , quantitative ultrasound parameters, and fracture incidence after spinal cord injury:a cross-sectional observational study in 100 paraplegic men // Osteoporos Int. - 2004. - Vol. 15. -P.180-189.
- Metzger C.E., Gong S., Aceves M., Bloomfield S.A., Hook M.A. Osteocytes reflect a pro-inflammatory state following spinal cord injury in a rodent model // Bone. - 2019. - Vol. 120. - P. 465-475. DOI: 10.1016 /j.bone.2018.12.007.
- Baltin M.E., Sabirova D.E., Kiseleva E.I., Baltina T.V., Lavrov I.A. Comparison of systemic and localized carrier-mediated delivery of methylprednisolone succinate for treatment of acute spinal cord injury // Experimental Brain Research. - 2021. -Vol. 239, no. 2. - P. 627-638. DOI: 10.1007/s00221-020-05974-w.
- Gordienko D.I. Tactics of surgical treatment of open shin fractures // The department of traumatology and orthopedics. -2013. - Vol. 1, no. 5. - P. 15-26.
- Boehl G., Raguindin P.F., Valido E., Bertolo A., Itodo O.A., Minder B., Lampart P., Scheel-Sailer A., Leichtle A., Glisic M., Stoyanov J. Endocrinological and inflam-matory markers in individuals with spinal cord injury: A systematic review and me-ta-analysis // Rev Endocr Metab Disord. - 2022. - Vol. 23. - P. 1035-1050. DOI: 10.1007/s11154-022-09742-9.
- Tettero J.M., van Eeghen E., Kooter A.J. Extreme hypercal-caemia caused by immobilisation due to acute spinal cord injury // BMJ Case Rep. - 2021. - Vol. 14, no. 6. - Art. e241386. DOI: 10.1136/bcr-2020-241386.
- He B., Zhu Y., Cui H., Sun B., Su T., Wen P. Compari-son of necroptosis with apoptosis for ovx-induced osteoporosis // Front Mol Biosci. - 2021. - Vol. 8. - Art. 790613. DOI: 10.3389/fmolb.2021.790613.


