Оценка воспалительной реакции после введения аскорбиновой кислоты в модели лучевого гепатита
Автор: Демяшкин Г.А., Якименко В.А., Вадюхин М.А., Угурчиева Д.И.
Журнал: Владикавказский математический журнал @vmj-ru
Статья в выпуске: 3 т.26, 2024 года.
Бесплатный доступ
Воздействие ионизирующего излучения при лечении злокачественных новообразований печени вызывает радиационно-индуцированную гибель гепатоцитов с развитием лучевого гепатита. Потенциальным радиопротектором печени в условиях облучения электронами может быть аскорбиновая кислота.
Электроны, печень, цитокины, радиопротектор, иммуногистохимия
Короткий адрес: https://sciup.org/143183210
IDR: 143183210 | УДК: 615.849.12 | DOI: 10.34014/2227-1848-2024-3-98-106
Текст научной статьи Оценка воспалительной реакции после введения аскорбиновой кислоты в модели лучевого гепатита
Введение. Воздействие ионизирующего излучения при лечении злокачественных новообразований печени и/или органов брюшной полости вызывает радиационно-индуцированную гибель интактных гепатоцитов, попадающих в зону облучения [1]. В некоторых случаях это приводит к развитию признаков лучевого гепатита с исходом в острую печеночную недостаточность [2]. Нарушение функций печени в половине случаев происходит уже при дозе 43 Гр при Y-облучении, а при дозе 60 Гр авторы наблюдали увеличение риска летального исхода в результате декомпенсации печеночной недостаточности более чем в 70 % случаев [3].
В единичных работах показано, что воздействие Х-лучей в суммарной дозе 12 Гр сопровождается вакуолизацией гепатоцитов и воспалением, а также гибелью 20 % животных [4].
В другом исследовании было показано развитие радиационно-индуцированного фиброза печени уже спустя две недели после однократного воздействия ионизирующего излучения в дозе 20 Гр [5].
Однако не смотря на множественные данные о радиационно-индуцированном поражении печени в ответ на воздействие Х- и Y-лучей актуальным остается проведение исследований постлучевых осложнений электроноте-рапии, которая оказывает более «щадящее»
влияние на здоровые ткани, при этом сохраняя высокую эффективность в отношении атипичных клеток [6]. В связи с этим интерес представляет исследование маркеров воспалительной реакции в печени при облучении электронами с целью оценки степени лучевого гепатита.
Известно, что в ответ на γ-облучение печени образуется цитокиновый дисбаланс с преобладанием провоспалительных цитокинов [7], в то время как другие исследователи указывают на увеличение активности противовоспалительного IL-10 [8]. Учитывая противоречивость данных в научных работах, а также отсутствие исследований, посвященных изучению постлучевых эффектов элек-тронотерапии в печени, необходимо проведение иммунофенотипической оценки воспалительной реакции.
Не менее важным представляется экспериментальная апробация методов защиты здоровых тканей от ионизирующего излучения. Среди потенциальных радиопротективных средств наиболее перспективными являются препараты из группы антиоксидантов, к которым относится аскорбиновая кислота [9]. Ее способность связывать свободные радикалы и индуцировать эндогенную систему антиоксидантной защиты была доказана в экспериментах на многих органах [10]. На основании этого мы ожидаем позитивные результаты ее применения при оксидативном стрессе, развивающемся в ответ на воздействие электронами.
Результаты данного исследования могут послужить основой для внедрения предлуче-вого введения аскорбиновой кислоты в клиническую практику при назначении электроно-терапии пациентам с злокачественными новообразованиями органов брюшной полости с целью протекции здоровых гепатоцитов, попадающих в зону облучения.
Цель исследования. Иммуногистохимическая оценка уровней экспрессии IL-1β, IL-6, IL-10 после введения аскорбиновой кислоты в модели лучевого гепатита.
Материалы и методы. Самцы крыс породы «Вистар» (Rattus Wistar, возраст 8–9 нед.; вес 220±20 г; n=40) были поделены на четыре экспериментальные группы:
I (n=10) – введение 0,9 % раствора NaCl (контрольная);
-
II (n=10) – фракционное локальное облучение электронами в суммарной очаговой дозе (СОД) 30 Гр;
-
III (n=10) – интраперитонеальное введение аскорбиновой кислоты в дозе 50 мг/кг за 1 ч до локального облучения электронами в СОД 30 Гр;
-
IV (n=10) – интраперитонеальное введение аскорбиновой кислоты в дозе 50 мг/кг.
Локальное облучение электронами животных проводили на линейном акселераторе NOVAC-11. Животных всех групп выводили из эксперимента путем введения высоких доз анестетика через неделю после последней фракции. Все манипуляции выполняли согласно Международным рекомендациям по проведению медико-биологических исследований с использованием животных (ЕЭС, Страсбург, 1985) и Хельсинкской декларации Всемирной медицинской ассоциации.
ELISA. Образцы печени взвешивали и добавляли физиологический раствор в пропорции 1:1. Затем готовили гомогенат в условиях охлаждающей водяной бани, который центрифугировали при 3000 об./мин в течение 10 мин, а супернатант забирали для дальнейшего исследования. Количественный анализ экспрессии цитокинов IL-1β, IL-6, IL-10 проводили с использованием коммерческих наборов ELISA (Cloud-Clone Corp., США).
Гистологическое исследование. Фрагменты печени фиксировали в растворе забу-ференного формалина, после проводки в автоматическом режиме заливали в парафиновые блоки, готовили серийные срезы (толщиной 2 мкм), депарафинировали, дегидратировали и окрашивали гематоксилином и эозином. Гистологические микропрепараты изучали под микроскопом Leica DM2000 с микрофотосъемкой. Оценивали степень повреждения печени по стандартным критериям в соответствии с адаптированной балльной шкалой Histologic Activity Index (HAI) [11].
Иммуногистохимическое исследование. В качестве первичных использовали поликлональные антитела к интерлейкину-1β (IL-1β; ThermoFisher, 1:100, США), интерлейкину-6
(IL-6; ThermoFisher, 1:100, США), интерлейкину-10 (IL-10; ThermoFisher, 1:100, США). Для определения вторичных антител использовались универсальная двухкомпонентная система детекции HiDef Detection™ HRP Polymer system, (Cell Marque, США), анти-IGG мыши/кролика, пероксидаза хрена (HRP) и субстрат DAB. Ядра клеток докрашивали гематоксилином Майера. Иммуногистохимический анализ проводили в 10 случайно отобранных полях зрения при увеличении ×400.
Статистическая обработка. Полученные в результате подсчета данные обрабатывали с использованием компьютерной программы SPSS 12 for Windows (IBM Analytics, США). Данные выражены как среднее значение и стандартная ошибка. Для оценки нор- мальности распределения использовали критерий Шапиро – Уилка. При сравнении исследуемых групп при распределении, отличном от нормального, применяли критерий Краскела – Уоллиса с апостериорным критерием Данна. Множественные сравнения проводили при помощи U-теста Манна – Уитни. Различия при p≤0,05 считали статистически значимыми.
Результаты. При гистологическом исследовании фрагментов печени контрольной группы наблюдали четко определяющиеся печеночные балки, состоящие из гепатоцитов полигональной формы с крупным ядром в центре клетки (0 баллов по HAI) (рис. 1А). Аналогичную морфологическую картину наблюдали в необлученной группе, которой вводили аскорбиновую кислоту.
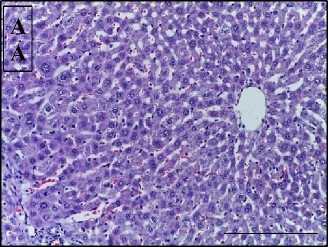
Рис. 1. Печень контрольной (А) и облученной (Б) групп.
Окрашивание гематоксилином и эозином, ×400, отрезок – 50 мкм
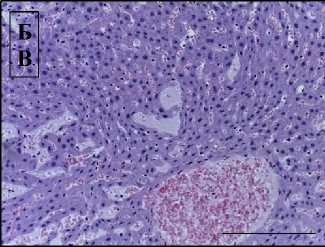
Fig. 1. Liver of control (A) and irradiated (B) groups.
Hematoxylin and eosin staining, ×400, segment – 50 μm
Облучение электронами в суммарной дозе 30 Гр приводило к нарушению гистоархитектоники печени и развитию признаков гепатита (9 баллов по HAI): фокальная атрофия печеночных долек, баллонная дистрофия гепатоцитов, фокальный некроз, умеренная клеточная инфильтрация портальных трактов, расширение синусоидов, кровоизлияния в перисинусоидном пространстве, гиперплазия клеток Купфера (рис. 1Б). При предлучевом введении аскорбиновой кислоты отмечали менее выраженные признаки лучевого гепатита (4 балла по HAI) со слабой степенью атрофии печеночных долек, вакуолизации цитоплазмы гепатоцитов, воспалительной инфильтрации портальных трактов.
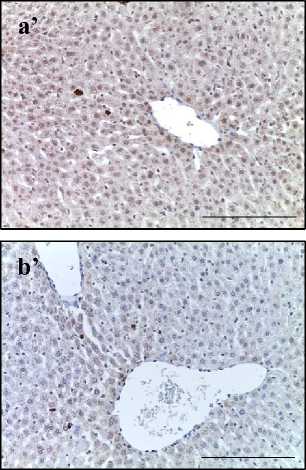
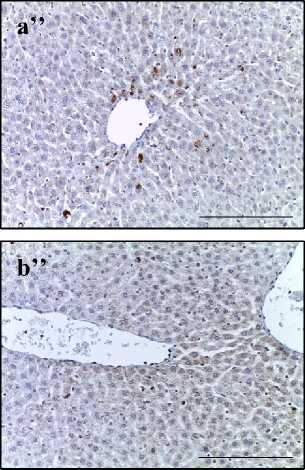
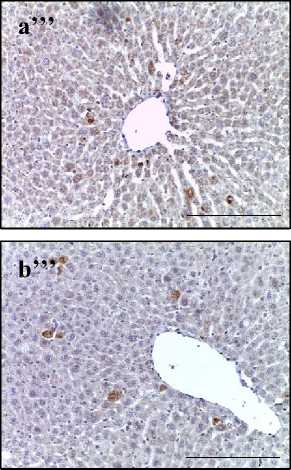
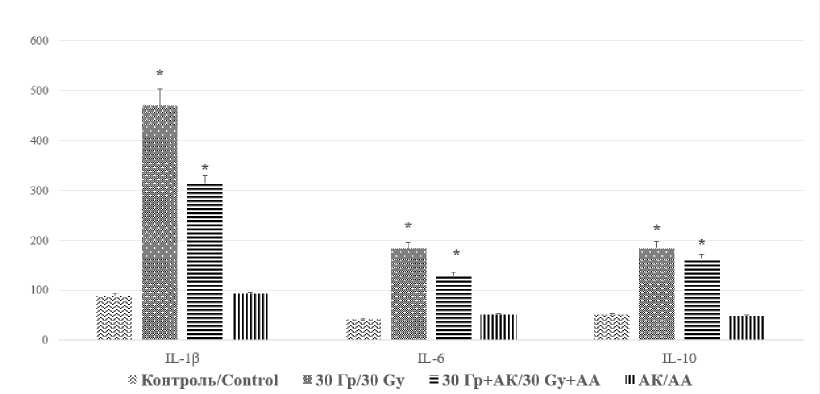
При иммуногистохимическом исследовании печени крыс II группы после воздействия электронами в суммарной дозе 30 Гр обнаружили увеличение количества окрашенных на цитокины клеток по сравнению с контролем. В большинстве образцов (92 %) количество IL-1β- и IL-6-позитивных клеток преобладало над числом IL-10-клеток. При этом иммунные клетки располагались преимущественно пери-васкулярно: в интерстициальной ткани и перисинусоидном пространстве (зона III) (рис. 2А). Выявленный дисбаланс цитокино-вой системы подтвержден результатами количественного анализа гомогената печени методом ELISA (рис. 2Б).
A / A
Б / B
Рис. 2. A – печень крыс контрольной группы (a, b), облученной группы (a’, b’) и группы предлучевого введения аскорбиновой кислоты (a’’, b’’). Иммуногистохимические реакции с антителами к IL-1 (a–a’’’) и IL-10 (b–b’’’), ×400, отрезок – 50 мкм.
Б – распределение экспрессии про- и противовоспалительных цитокинов в гомогенате печени контрольной и опытных групп в пг/мл (* – статистически значимые различия по сравнению с контрольной группой, р≤0,05)
Fig. 2. A – Liver of control group (a, b), irradiated group (a’, b’) and group of pre-radiation administration of ascorbic acid (a’’, b’’). Immunohistochemical reactions with antibodies to IL-6 (a–a’’’) and IL-10 (b–b’’’), ×400, segment – 50 µm.
B – Distribution of pro- and anti-inflammatory cytokine expression in liver homogenate, control and experimental groups, pg/ml (* – the differences are statistically significant compared with the control, p≤0.05)
Предлучевое введение аскорбиновой кислоты привело к частичному сохранению баланса между провоспалительными (IL-1β, IL-6) и противовоспалительными (IL-10) цитокинами, однако экспрессия этих цитокинов превышала значения контрольной группы (рис. 2).
Обсуждение. Воздействие локального облучения электронами в СОД 30 Гр привело к развитию морфологических признаков лучевого гепатита.
Следует отметить, что cравнение наших результатов и данных, полученных другими исследователями при использовании Х- и γ-облучения [4, 12], демонстрирует, что электроны оказывают более «щадящее» токсическое действие на гепатоциты, однако не уступают в противоопухолевой эффективности другим видам ионизирующего излучения [6].
Так, облучение влияет на гепатоциты напрямую (посредством нарушения структуры ДНК заряженными частицами) и опосредованно (путем генерации многочисленных продуктов радиолиза воды), что вызывает гибель гепатоцитов с высвобождением молекулярных паттернов, связанных с повреждением (DAMPs), а также продукцией цитокинов и аларминов выжившими клетками [13]. В результате в печени происходит резкое увеличение экспрессии этих молекул с вовлечением иммунных клеток в облученную зону для утилизации патологически измененных клеток и демаркации воспаления, что было подтверждено результатами иммуногистохимического исследования и количественного анализа экспрессии про- (IL-1β, IL-6) и противовоспалительных (IL-10) факторов. Аналогичные результаты были получены в исследованиях других авторов, но при воздействии на печень Х-излучения в дозе 4 Гр, в ответ на которое развивалась локальная воспалительная реакция, более выраженная по изучаемым показателям [4].
Кроме того, необходимо отметить, что по результатам количественного анализа мы наблюдали значительное увеличение концентраций провоспалительных цитокинов по сравнению с противовоспалительными. Обнаруженный цитокиновый дисбаланс, вероятно, связан с декомпенсацией локальной иммун- ной защиты в печени после воздействия облучения электронами [14].
Предлучевое введение аскорбиновой кислоты демонстрировало частичное сохранение баланса про- и противовоспалительных цитокинов. Вероятно, это связано со способностью аскорбиновой кислоты защищать клетки от прямых механизмов радиационного повреждения: в единичных исследованиях была доказана протективная активность этого антиоксиданта в отношении молекул ДНК [15]. Кроме того, являясь мощным утилизатором свободных токсических радикалов, аскорбиновая кислота также частично предотвращает гибель гепатоцитов от косвенных механизмов цитотоксического действия электронов, снижая степень оксидативного стресса в паренхиме печени [16]. Более того, по данным проведенного иммуногистохимического исследования экспрессии маркеров воспалительной реакции, не исключены косвенные противовоспалительные эффекты данного вещества, однако для доказательства данной гипотезы необходимо проведение молекулярно-биологических и молекулярно-генетических тестов с изучением конкретных сигнальных путей.
Заключение. Через неделю после воздействия локального облучения электронами в суммарной дозе 30 Гр происходит развитие признаков лучевого гепатита. В печени выявлено статистически значимое увеличение экспрессии провоспалительных цитокинов. В то же время предлучевое введение аскорбиновой кислоты обеспечивает частичную радиопротекцию здоровых гепатоцитов, а также восстановление цитокинового баланса и уменьшение клеточной воспалительной инфильтрации.
Список литературы Оценка воспалительной реакции после введения аскорбиновой кислоты в модели лучевого гепатита
- Koay E.J., Owen D., Das P. Radiation-Induced Liver Disease and Modern Radiotherapy. Semin Radiat Oncol. 2018; 28 (4): 321-331. DOI: 10.1016/j.semradonc.2018.06.007.
- Kim J., Jung Y. Radiation-induced liver disease: current understanding and future perspectives. Exp Mol Med. 2017; 49 (7): e359. DOI: 10.1038/emm.2017.85.
- Yang W., Shao L., Zhu S. Transient Inhibition of mTORC1 Signaling Ameliorates Irradiation-Induced Liver Damage. Front Physiol. 2019; 10: 228. DOI: 10.3389/fphys.2019.00228.
- Li W., Jiang L., Lu X., Liu X., Ling M. Curcumin protects radiation-induced liver damage in rats through the NF-kB signaling pathway. BMC Complement Med Ther. 2021; 21 (1): 10. DOI: 10.1186/s12906-020-03182-1.
- Cheng W., Xiao L., Ainiwaer A. Molecular responses of radiation-induced liver damage in rats. Mol Med Rep. 2015; 11 (4): 2592-2600. DOI: 10.3892/mmr.2014.3051.
- Calvo F.A., Serrano J., Cambeiro M. Intra-Operative Electron Radiation Therapy: An Update of the Evidence Collected in 40 Years to Search for Models for Electron-FLASH Studies. Cancers (Basel). 2022; 14 (15): 3693. DOI: 10.3390/cancers14153693.
- Attia A.A., HamadH.A., Fawzy M.A., Saleh S.R. The Prophylactic Effect of Vitamin C and Vitamin B12 against Ultraviolet-C-Induced Hepatotoxicity in Male Rats. Molecules. 2023; 28 (11): 4302. DOI: 10.3390/molecules28114302.
- Khalil A., Omran H., Alsheikh F. Balance of pro- and anti-inflammatory cytokines in livers of high fat diet rats exposed to fractionated gamma irradiation. BMC Res Notes. 2018; 11 (1): 741. DOI: 10.1186/s13104-018-3851-2.
- Aliper A.M., Bozdaganyan M.E., Sarkisova V.A. Radioprotectors.org: an open database of known and predicted radioprotectors. Aging (Albany NY). 2020; 12 (15): 15741-15755. DOI: 10.18632/ag-ing.103815.
- ZhengH., Xu Y., Liehn E.A., RusuM. Vitamin C as Scavenger of Reactive Oxygen Species during Healing after Myocardial Infarction. Int J Mol Sci. 2024; 25 (6): 3114. DOI: 10.3390/ijms25063114.
- Knodell R.G., Ishak K.G., Black W.C. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology. 1981; 1 (5): 431435. DOI: 10.1002/hep.1840010511.
- El-Maraghi E.F., Abdel-Fattah K.I., Soliman S.M., El-Sayed W.M. Taurine abates the liver damage induced by y-irradiation in rats through anti-inflammatory and anti-apoptotic pathways. Int J Radiat Biol. 2020; 96 (12): 1550-1559. DOI: 10.1080/09553002.2020.1828656.
- Yamaga S., AzizM., Murao A., Brenner M., Wang P. DAMPs and radiation injury. Front Immunol. 2024; 15: 1353990. DOI: 10.3389/fimmu.2024.1353990.
- Zhang C., Liang Z., Ma S., LiuX. Radiotherapy and Cytokine Storm: Risk and Mechanism. Front Oncol. 2021; 11: 670464. DOI: 10.3389/fonc.2021.670464.
- Cai L., Koropatnick J., Cherian M.G. Roles of vitamin C in radiation-induced DNA damage in presence and absence of copper. Chem Biol Interact. 2001; 137 (1): 75-88. DOI: 10.1016/s0009-2797(01)00210-1.
- Ali A., Riaz S., Khalid W., Fatima M., Mubeen U., Babar Q., Madilo F.K. Potential of ascorbic acid in human health against different diseases: an updated narrative review. International Journal of Food Properties. 2024; 27 (1): 493-515. DOI: 10.1080/10942912.2024.2327335.


