Одиночные новообразования кожи: анализ эпидемиологии и гистологическая верификация
Автор: Среедеви Л., Рао Д.Э., Кумари А.В., Нихарика М., Сравани П., Наик В.С.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.15, 2024 года.
Бесплатный доступ
Обоснование. Опухоли кожи возникают в результате пролиферации одного или нескольких компонентов кожи и классифицируются на доброкачественные и злокачественные. В последние десятилетия распространённость рака кожи выросла, поэтому особое значение приобретает гистологическая верификация различных видов злокачественных новообразований кожи. Цель исследования - охарактеризовать эпидемиологию, течение и гистопатологическую картину разных видов новообразований кожи.
Одиночная опухоль кожи, гистопатология, кератиноцитарная опухоль, опухоль придатков кожи, подкожная опухоль
Короткий адрес: https://sciup.org/143183231
IDR: 143183231 | DOI: 10.17816/clinpract625962
Текст научной статьи Одиночные новообразования кожи: анализ эпидемиологии и гистологическая верификация
Леккала Среедеви, Эдукондала Рао, Биджайя Кумари А., Мачани Нихарика, Сравани П., Сива-санкара Наик В. Одиночные новообразования кожи: анализ эпидемиологии и гистологическая верификация. Клиническая прак тика. 2024;15(2):39–50. doi:
Lekkala Sreedevi, Edukondala Rao D., Vijaya Kumari A., Machani Niharika, Sravani P., Sivasankara Naik V. Solitary cutaneous neoplasms: analysing the uncertain behaviour with the aid of histopathology. Journal of Clinical Practice. 2024;15(2):39–50. doi:
Submitted 24.01.2024 Revised 11.05.2024 Published online 11.05.2024
Опухоли кожи можно подразделить на три широкие категории — распространённые, которые легко определить в соответствии с размером, цветом, расположением и типичным внешним видом; редкие и мимикрирующие образования, в связи с чем их сложно диагностировать. Последняя группа в основном диагностируется с помощью гистологической верификации, иммуногистохимического исследования и других продвинутых диагностических методов [3].
Для гистологической верификации клинической картины применяется классификация кожных опухолей Всемирной организации здравоохранения (ВОЗ) [3, 4]. Опухоли классифицируются как кера-

Том 15 № 2
тиноцитарные, опухоли придатков кожи, которые в свою очередь подразделяются на опухоли апокринных, потовых и сальных желёз, и меланоцитарные опухоли, опухоли мягких тканей, нейральные опухоли и опухоли подкожной клетчатки [3, 4].
Для того чтобы не пропустить злокачественные опухоли и обеспечить правильное вмешательство и последующее лечение, важно получить гистологически верифицированный диагноз. В этом исследовании предпринята попытка охарактеризовать эпидемиологию, течение и гистопатологическую картину разных видов новообразований кожи, с которыми сталкивается врач на амбулаторном приёме.
МЕТОДЫ
Проспективное исследование проведено в период с июля 2019 по июль 2023 года в амбулаторном отделении дерматологии, венерологии и лепроло-гии Государственной больницы общего профиля в Анантапуре (Индия).
В исследование включено 123 пациента с солитарными новообразованиями кожи вне зависимости от возраста, пола и локализации опухоли. Перед вмешательством от каждого пациента получено информированное согласие. Пациенты с кистозными и инфекционными опухолями, со множественными очагами поражения и те, кто не предоставил информированное согласие на участие в исследовании, были исключены.
Каждый пациент прошёл тщательное клиническое обследование с фотодокументированием опухоли и эксцизионной биопсей очагов поражения и последующей гистопатологической верификацией в соответствии с классификацией кожных опухолей ВОЗ. При необходимости проводилось иммуногистохимическое исследование и специальное окрашивание компонентов.
РЕЗУЛЬТАТЫ
В рамках данного исследования изучены 123 солитарных опухоли. Опухоли наблюдались во всех возрастных группах, однако большинство поражало взрослых людей — 26–44 (31,7%) и 45–59 (30,08%) лет, а также пожилых людей (26,01%). В рамках нашего исследования обнаружена взаимосвязь: чем старше возраст, тем выше тенденция наличия злокачественных опухолей, при этом наибольшая частота приходится на возрастную группу от 60 лет и старше (табл. 1) [5]. Соотношение мужчин и женщин в исследовании в целом составило 1:1,16, однако злокачественные опухоли чаще (в соотношении 2,12:1) диагностировали у мужчин.
Таблица 1
Клинико-демографические характеристики исследования
|
Показатель |
Число пациентов, n |
% |
||
|
Возраст*, лет |
0–12 |
05 |
4,06 |
|
|
13–18 |
05 |
4,06 |
||
|
19–25 |
05 |
4,06 |
||
|
26–44 |
39 |
31,7 |
||
|
45–59 |
37 |
30,08 |
||
|
≥60 |
32 |
26,01 |
||
|
Пол |
Мужской |
57 |
46,34 |
|
|
Женский |
66 |
53,65 |
||
|
Расположение опухоли |
Конечности |
Доброкачественная |
45 |
84,90 |
|
Злокачественная |
08 |
15,09 |
||
|
Голова и шея |
Доброкачественная |
25 |
69,44 |
|
|
Злокачественная |
11 |
30,55 |
||
|
Тело |
Доброкачественная |
26 |
92,85 |
|
|
Злокачественная |
02 |
7,14 |
||
|
Половые органы |
Доброкачественная |
02 |
33,33 |
|
|
Злокачественная |
04 |
66,66 |
||
|
Градация опухолей |
Доброкачественная |
98 |
79,67 |
|
|
Злокачественная |
25 |
20,32 |
||
Примечание. * В соответствии с классификацией возрастов ВОЗ, 2015 [5].
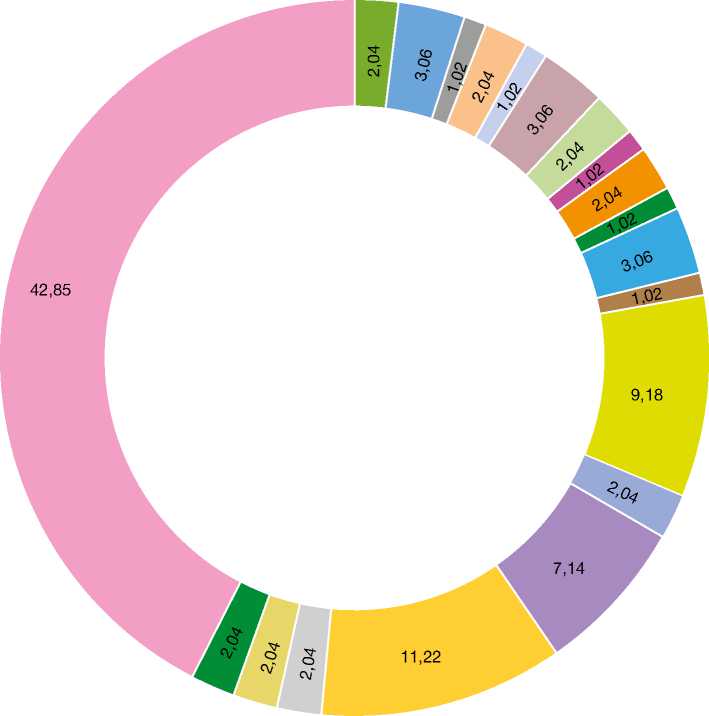
Большинство опухолей были расположены на конечностях (43,08%), а также (в порядке убывания) на голове и шее (29,26%), теле (22,76%) и половых органах (4,87%). Гистопатологическая верификация показала, что 98 (79,67%) случаев опухолей кожи были диагностированы как доброкачественные, а 25 (20,32%) — как злокачественные. В нашем исследовании доброкачественные очаги поражения располагались в основном на конечностях, в то время как злокачественные опухоли чаще всего находились в области головы и шеи (см. табл. 1). Большинство опухолей образовалось в подкожной клетчатке (42 случая; 34,14%), второе и третье место поделили опухоли мягких тканей (31; 25,2%) и кера-тиноцитарные опухоли (16; 13%); по 4 (3,25%) случая пришлось на опухоли наиболее редкого происхождения — меланоцитарного и нейрального (рис. 1).
Самой распространённой доброкачественной опухолью в нашем исследовании была липома: число случаев заболевания составило 42 (42,85%), затем — опухоли мягких тканей (30,61%, причём гемангиомы составили среди них большинство — 11,22%), фиброма мягких тканей (9,18%) и пиогени-ческая гранулёма (7, 14%) (рис. 2). Среди опухолей
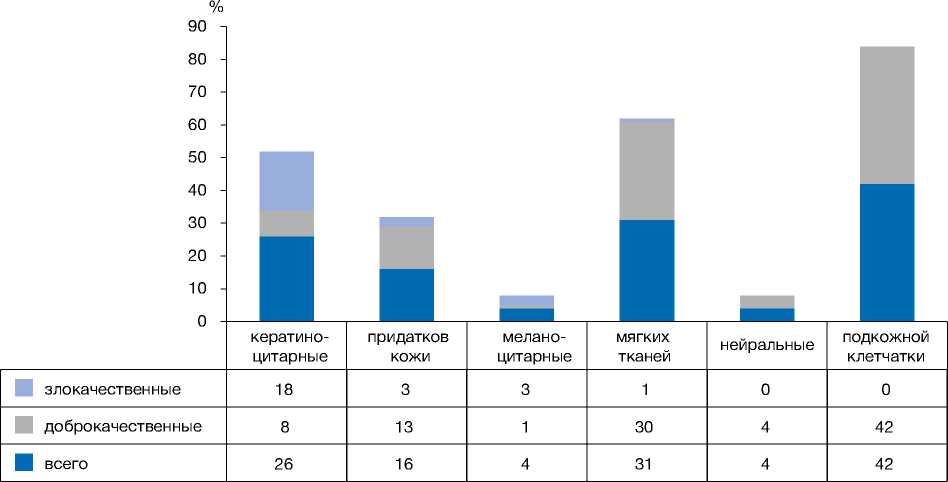
Рис. 1. Гистограмма, отражающая количество пациентов в зависимости от происхождения опухоли, согласно классификации ВОЗ.
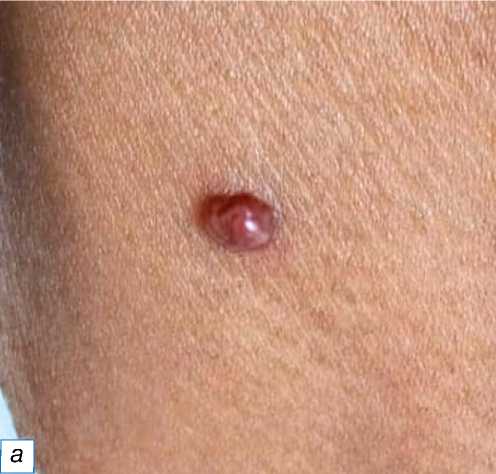
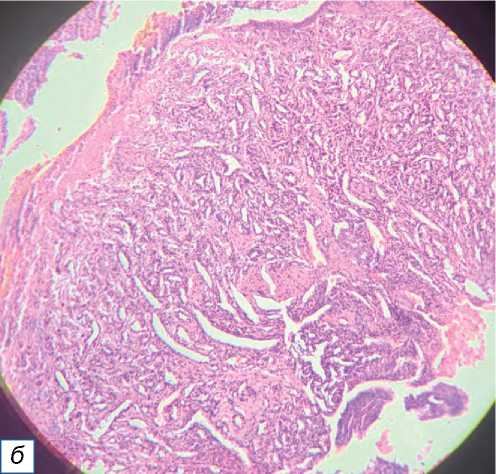
Рис. 2. Пиогеническая гранулёма: a — небольшой красновато-розовый узел на правой стороне нижней части шеи; б — узловая пролиферация кровеносных сосудов с эритроцитами (окраска гематоксилином и эозином, х400).
придатков кожи (13,26%) самыми распространёнными были нодулярная гидраденома и седативный невус (по 3,06% каждый) (рис. 3). Среди кератино-цитарных опухолей большинство случаев составила кератоакантома (3,06%) (рис. 4), из нейральных опухолей по два случая пришлось на нейрофиброму и невриному (по 2,04% каждая). Доброкачественные опухоли меланоцитарного происхождения (рис. 5–8) были наименее распространёнными в нашем исследовании: зафиксирован всего один случай (1,02%) врождённого меланоцитарного невуса.
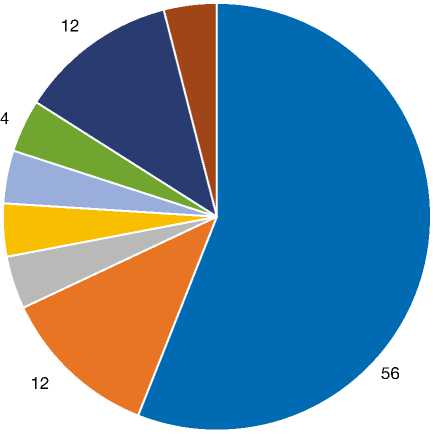
Большинство злокачественных опухолей были кератиноцитарного происхождения, Из 25 злокачественных опухолей выявлено 14 случаев плоскоклеточного рака (рис. 9), что составило большинство (56%); второе место поделили случаи базалиомы (рис. 10) и злокачественной меланомы (по 12%) (рис. 11), далее следуют болезнь Боуэна (рис. 12), злокачественная пролиферирующая опухоль сальных желёз (рис. 13), кистозная опухоль сальных желёз с базальноклеточной малиг-низацией, пигментированная карцинома сальных
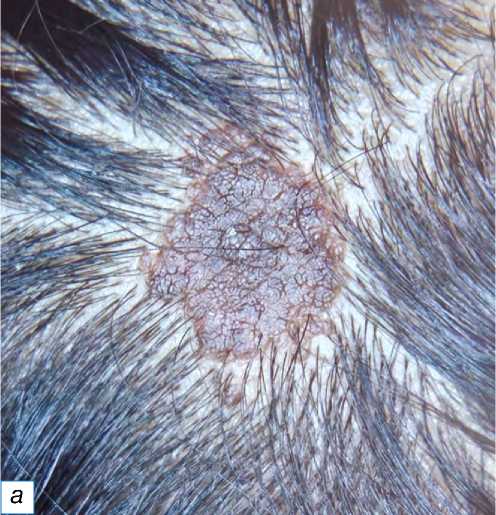
Рис. 3. Невус сальных желёз: a — гиперпигментированная бляшка с веррукозной поверхностью на коже головы с несколькими волосками; б — эпидермальный папилломатоз: стрелкой показаны сальные дольки, нет стержня волоса (окраска гематоксилином и эозином, х400).
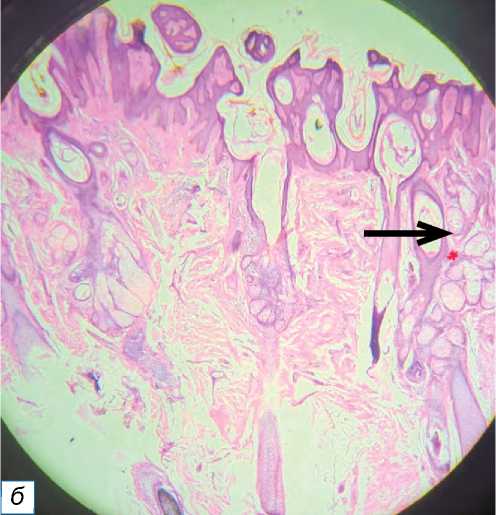
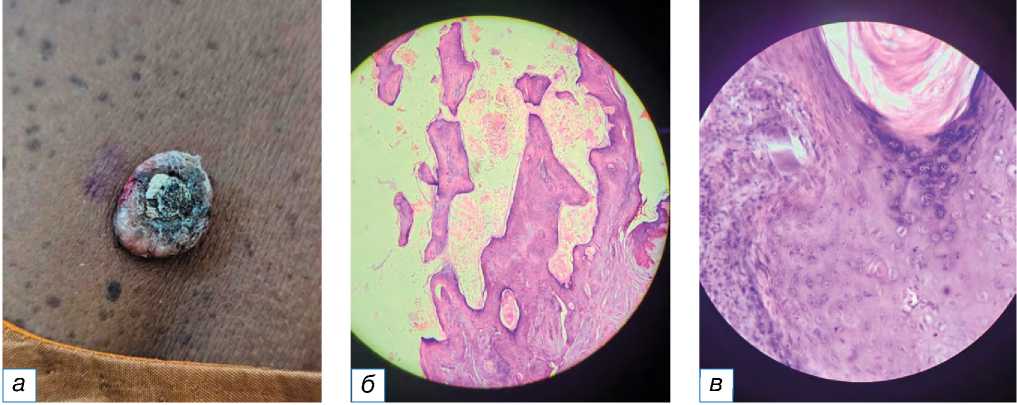
Рис. 4. Кератоакантома: a — выпуклый узел телесного цвета с кератиновым углублением в середине; б — углубление, заполненное кератином; в — хорошо заметны некератизированные клетки (окраска гематоксилином и эозином, х400).
меланоакантома кератоакантома узловатое пруриго Гайда себорейный кератоз эккринная спираденома нодулярная гидраденома гидраденома папиллиформная хондроидная сирингома пиломатриксома трихоэпителиома невус сальных желез конгенитальный меланоцитарный невус мягкая фиброма дерматофиброма пиогенетическая гранулема гемангиома келоид шваннома нейрофиброма липома
Рис. 5. Круговая диаграмма, демонстрирующая процентное соотношение доброкачественных опухолей, %.
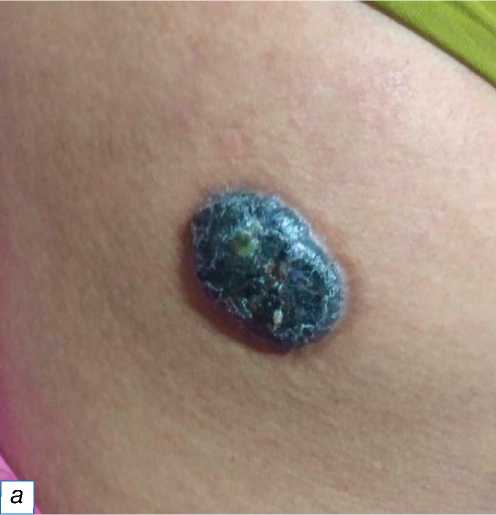
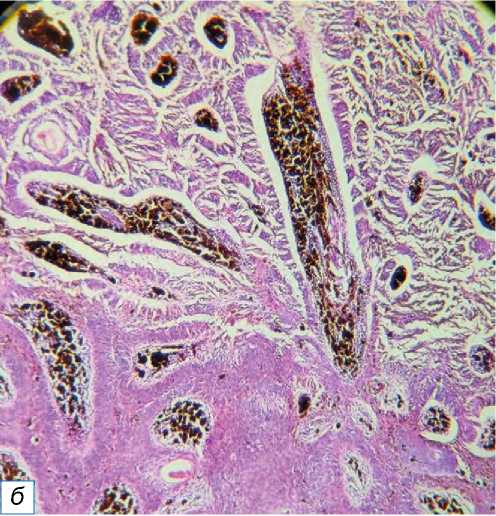
Рис. 6. Меланоакантома: a — гиперпигментированная гиперкератинированная бляшка на правой стороне спины, имитирующая меланому; б — клетки опухоли собрались в выросты со скоплением меланина в середине и внеклеточным меланином (окраска гематоксилином и эозином, х400).
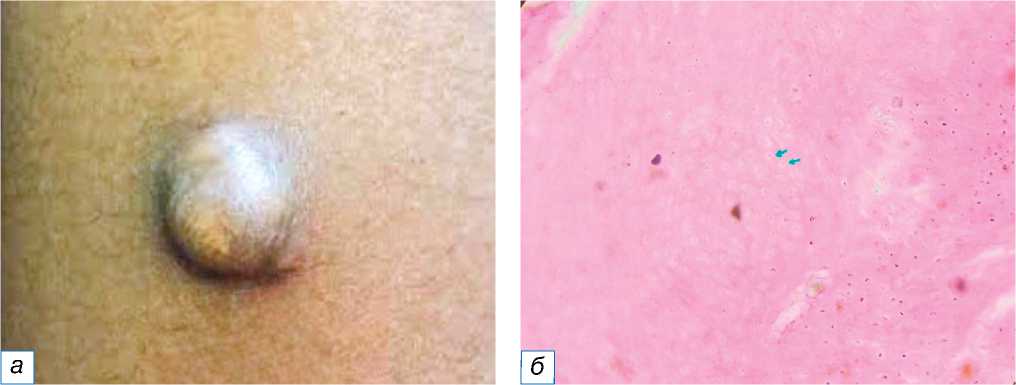
Рис. 7. Пиломатрикома: a — твёрдое узловатое образование в форме полусферы на правом предплечье, имитирующее кальциноз кожи; б — зелёными стрелками обозначены характерные ахромациты (окраска гематоксилином и эозином, х400).
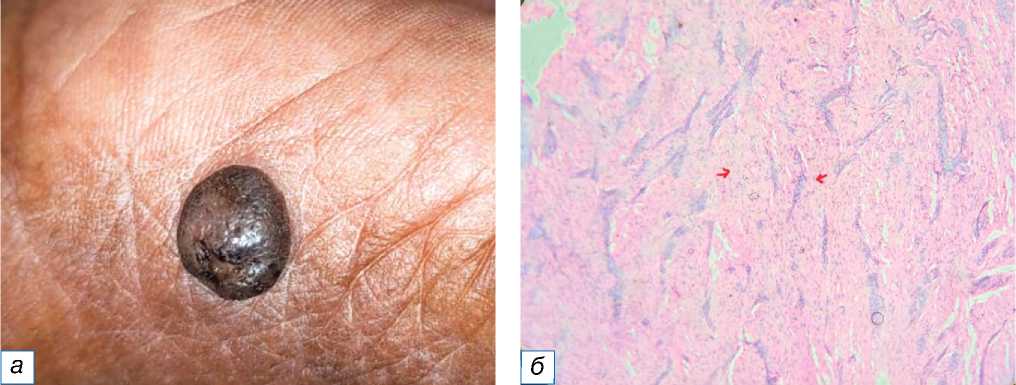
Рис. 8. Дерматофиброма: a — гиперпигментированный плотный или твёрдый узел на левой кисти, имитирующий кальциноз кожи; б — красными стрелками обозначена многочисленная пролиферация удлинённых веретенообразных клеток (окраска гематоксилином и эозином, х400).
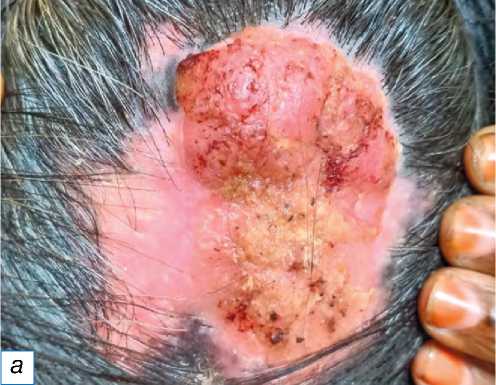
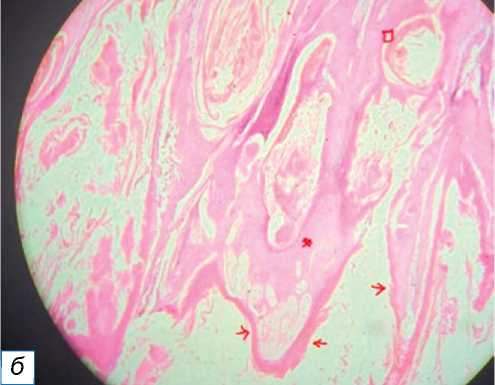
Рис. 9. Плоскоклеточная карцинома, веррукозная форма: a — одиночная веррукозная бляшка телесного цвета с нечёткими границами, покрытая коркой; б — изображение HPE показывает папиллярные образования (обозначены красными стрелками), диспластический эпителий (отмечен красной звёздочкой) и раковые жемчужины, обозначенные красным квадратом (окраска гематоксилином и эозином, х400).
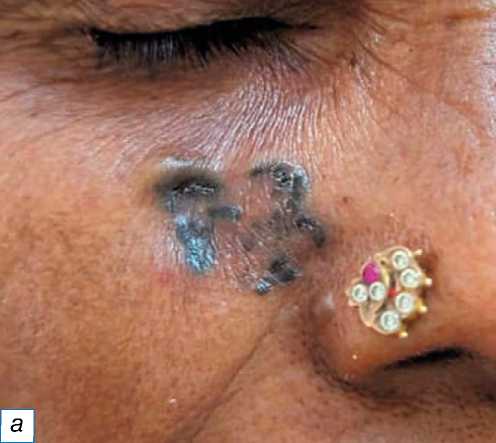
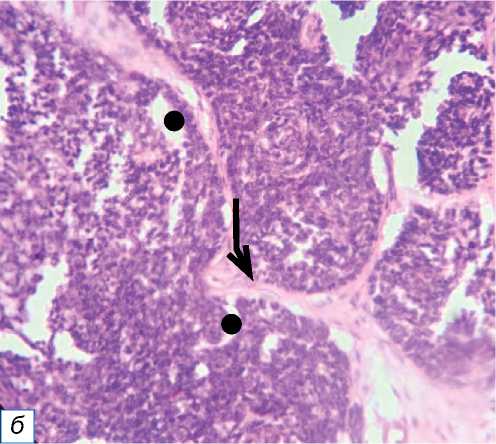
Рис. 10. Базальноклеточная карцинома: a — чёрная бляшка неправильной формы под правым глазом; б — граница из атипичных базалоидных клеток, разделённых волокнистой стромой (обозначена чёрной стрелкой), включает ретракционные щели, обозначенные чёрным кружком (окраска гематоксилином и эозином, х400).
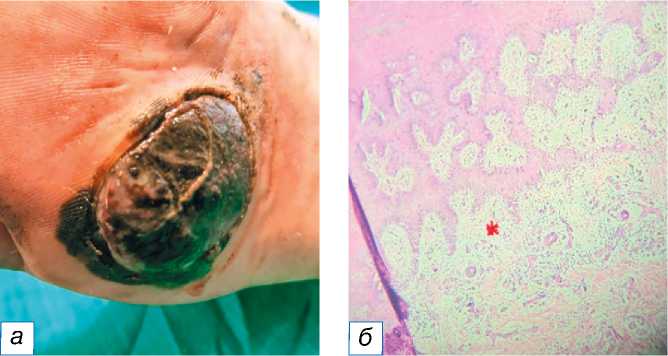
Рис. 11. Злокачественная меланома: a — гиперпигментированная гиперкератизированная бляшка на левой стопе; б — инфильтрация клеток опухоли в дерму (обозначена красной звёздочкой); в — заметные эозинофильные ядрышки, обозначенные красными стрелками (окраска гематоксилином и эозином, х400).
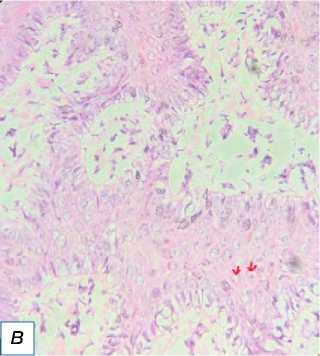
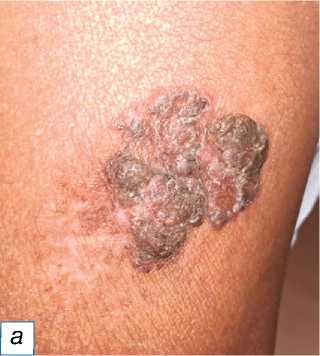
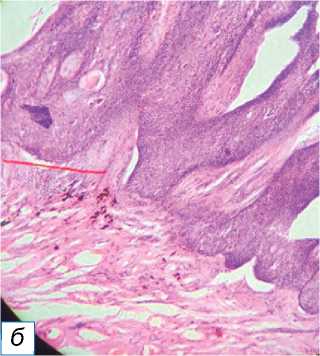
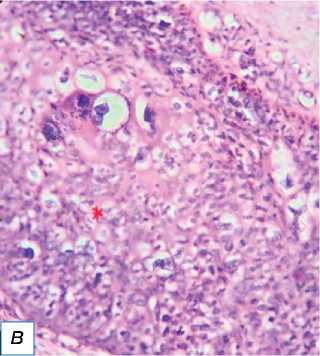
Рис. 12. Болезнь Боуэна: a — чёрно-коричневая бляшка с неровной поверхностью на левой голени, похожая на волчанку обыкновенную; б — гиперпластический эпидермис с серьёзной дисплазией (обозначен красной звёздочкой), но не инфильтрирующий дерму ( в ) (окраска гематоксилином и эозином, х400).
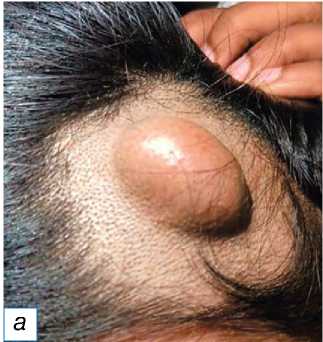
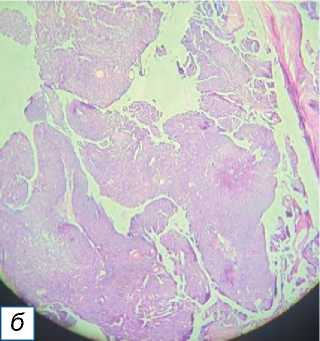
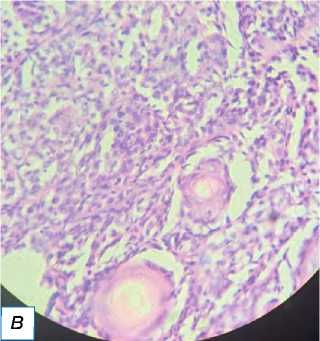
Рис. 13. Пролиферирующая трихолеммальная опухоль: a — гладкое образование справа спереди на коже головы, имитирующее кисту сальной железы; б — пролиферирующий дольковый вырост; в — серьёзная кератиноци-тарная атипия ядра с трансформацией в плоскоклеточный рак (окраска гематоксилином и эозином, х400).
желёз и злокачественная гигантоклеточная опухоль, составившие 4% всех злокачественных опухолей соответственно (рис. 14). Злокачественные опухоли часто наблюдались у пожилых пациентов мужского пола, и в основном затрагивали область головы и шеи.
ОБСУЖДЕНИЕ
Растущая частота злокачественных новообразований кожи за последние десять лет вызывает серьёзные опасения в связи с обусловленной ими летальностью и экономическим бременем вследствие необходимости мониторинга и лечения [6, 7]. В этипатогенезе новообразований кожи самым важным фактором риска считается ультрафиолетовое излучение. Как плоскоклеточная карцинома (cSCC), составляющая 20% всех злокачественных опухолей головы и шеи, так и неме-ланомный рак кожи (NMSC) в 70% случаев возникает на инсолированных участках кожи, особенно в зоне головы и шеи.
Гистологическое исследование остаётся простым и экономичным методом верификации опухолей кожи. Иммуногистохимическое исследование (ИГХ) является важным вспомогательным инструментом для постановки диагноза в сложных случаях, требующих определения стадии опухоли, идентификации генетических вариантов с целью таргетной терапии. ИГХ широко используется для дифференциации внекожных очагов поражения, таких как метастатическая карцинома, новообразования мягких тканей, и гематологических злокачественных опухолей [8]. В дополнение к используемым на данный момент маркерам ИГХ появляются новые: например, для диагностики меланомы при- меняются маркеры статуса генетической мутации протоонкогена B-raf (рекомбинантный белок v-raf murine sarcoma viral oncogene homolog B) и онкогена NRAS (neuroblastoma RAS viral oncogene homolog),
плоскоклеточный рак базально-клеточная карцинома (БКК)
болезнь Боуэна злокачественная пролиферирующая трихолеммальная опухоль опухоль сальных желез с трансформацией БКК пигментированная карцинома сальных желез злокачественная меланома злокачественная гигантоклеточная опухоль
Рис. 14. Круговая диаграмма, демонстрирующая процентное соотношение злокачественных опухолей, %.
а также эпигенетические маркеры (например, 5-гидроксиметилцитозин). Помимо биомаркеров ИГХ, с целью изучения опухоли в режиме реального времени, диагностики прогрессирования или рецидива опухоли, а также ответа на терапию и оценки профиля опухоли без необходимости повторной биопсии применяется исследование циркулирующих опухолевых клеток (circulating tumour cells, CTC) и циркулирующей опухолевой ДНК [9, 10]. Вместе с тем для достоверной оценки чувствительности, специфичности и прогностической значимости этих методов требуются масштабные многоцентровые рандомизированные исследования.
За последние несколько лет по мере развития технологий были разработаны диагностические методы in vivo и ex vivo в попытке более точно и своевременно установить диагноз [6, 7]. Некоторые из них, такие как цифровая фотография, двух- и трёхмерная фотография всего тела, дерматоскопия, не требуют дорогостоящего оборудования и применяются довольно широко. Другие современные технологии, такие как оптическая когерентная томография, отражательная конфокальная микроскопия, флюоресцентная вре-мя-разрешающая микроскопия, доступны только в отдельных центрах, специализирующихся на лечении рака кожи [11]. Говоря о дерматологической диагностике, нужно отметить, что особое внимание стоит уделить машинному обучению и искуствен-ному интеллекту [12]. Эти технологии, построенные на принципах обучения нейронных сетей на основе имеющихся диагностических данных, могут помочь практикующим врачам в принятии решений [13].
Соотношение доброкачественных и злокачественных опухолей кожи в нашем исследовании на основе анализа 123 случаев составило 79,67% и 20,32% соответственно. В аналогичных работах групп исследователей N. Patel [14], P. Goel [15] и V. Shrivastava [16] сообщается о 90,7; 53 и 63,84% доброкачественных и 9,29; 47 и 36,15% злокачественных опухолях соответственно (табл. 2). Распределение опухолей по возрасту и полу в нашем и приведённых выше исследованиях примерно совпадало, однако расходилось в показателях локализации: наше исследование показало большую по-ражаемость конечностей — 43,08%, в аналогичных работах [14–16] в большинстве случаев была поражена область головы и шеи (см. табл. 2). В нашем исследовании, как и в исследовании V. Shrivastava и соавт. [16], из всех злокачественных опухолей чаще всего встречался плоскоклеточный рак (56%), но по результатам исследований групп N. Patel [14] и P. Goel [15] наиболее частой злокачественной нозологией была базалиома (см. табл. 2).
Опухоли придатков кожи происходят из недифференцированных плюрипотентных стволовых клеток, которые, в конечном счёте, дифференцируются на три основные категории — опухоли сальных, потовых или апокринных желёз или опухоли волосяных фолликулов [17]. Важность диагностики опухолей придатков кожи связана с тем, что в некоторых случаях наличие этих опухолей ассоци-
Таблица 2
Сравнительный анализ разных параметров доброкачественных и злокачественных опухолей кожи в настоящем и аналогичных исследованиях
|
Показатель |
Patel и соавт. [14] |
Goel и соавт. [15] |
Shrivastava и соавт. [16] |
Настоящее исследование |
|
Число случаев, n |
249 |
232 |
130 |
123 |
|
Соотношение м/ж |
1,28/1 |
1,15/1 |
1,24/1 |
1/1,16 |
|
Встречаемость злокачественных опухолей в возрастных группах |
Пожилые |
Пожилые |
Пожилые |
Пожилые |
|
Обычное расположение |
Голова и шея |
Голова и шея |
Голова и шея |
Конечности |
|
Доброкачественные опухоли, % |
82,32 |
53 |
63,84 |
79,67 |
|
Злокачественные опухоли, % |
8,43 |
47 |
36,15 |
20,32 |
|
Часто наблюдаемые доброкачественные опухоли, % |
Кератиноцитар-ные (49,27) |
Кератиноцитар-ные (46,3) |
Кератиноцитар-ные (42,3) |
Подкожной клетчатки (34,14) |
|
Часто наблюдаемая злокачественная опухоль, % |
Кератиноцитар-ные (95,23) |
Кератиноцитар-ные (79,8) |
Кератиноцитар-ные (54,54) |
Кератиноцитар-ные (72) |
|
Распространённая злокачественная опухоль, % |
Базальноклеточная карцинома (57,14) |
Базальноклеточная карцинома (33,3) |
Почечноклеточный рак (27,65) |
Почечноклеточный рак (56) |
Таблица 3
Сравнительный анализ случаев опухолей придатков кожи в настоящем и аналогичных исследованиях
|
Исследование |
Опухоли потовых желёз, % |
Фолликулярные опухоли, % |
Опухоли сальных желёз, % |
|
N. Sharma и соавт. [19] |
49,3 |
26,5 |
29 |
|
A. Sharma и соавт. [20] |
42,86 |
35,71 |
21,43 |
|
Pappala и соавт. [21] |
71,42 |
28,57 |
- |
|
Pujani и соавт. [22] |
56 |
28 |
16 |
|
Rajalakshmi и соавт. [23] |
52,38 |
33,33 |
4,76 |
|
Nair и соавт. [24] |
57,57 |
36,36 |
6,06 |
|
Настоящее исследование |
43,75 |
25 |
31,25 |
Том 15 № 2
ировано с генетическими синдромами, такими как синдром Мьюира–Торре, связанный с опухолями сальных желёз, болезнь Коудена, связанная с трихолеммомами, и т.д. [18]. В настоящем исследовании опухоли придатков кожи составили 13%. Чаще всего опухоли зарождались в потовых железах (43,75%), на втором месте были опухоли сальных желёз (31,25%), а затем фолликулярные опухоли (25%). Подобное распределение частоты опухолей придатков кожи показано и в исследовании N. Sharma и соавт. [19]. В других аналогичных исследованиях также отмечено, что на первом месте по происхождению находятся опухоли, развивающиеся из потовых желёз, в то время как второе место занимают опухоли фолликулярного происхождения [20–24] (табл. 3).
ЗАКЛЮЧЕНИЕ
В настоящем исследовании большинство опухолей были определены как доброкачественные (79,27%), злокачественные опухоли составили меньше 1/4 случаев (20,32%). Мы наблюдали небольшое преобладание лиц женского пола, связанное с включением в наше исследование опухолей подкожной клетчатки, которые чаще встречаются у женщин. При этом выявлено, что злокачественные опухоли кожи чаще всего наблюдаются у пожилых мужчин и поражают область головы и шеи. Клинически наблюдаемые опухоли могли не отличаться от доброкачественных, поэтому гистологическая верификация являлась ключевым исследованием для постановки диагноза.
Различия в типах кожи, разные географические условия, профессиональное облучение, воздействие солнца и защита кожи, а также различный уровень осведомлённости о болезни и условия наблюдения определяют сложность диагностики новообразований кожи. Наряду с рутинной гисто- логической верификацией, которая остаётся золотым стандартом, применяются иммуногистохимия, исследование циркулирующих опухолевых клеток и ДНК, цифровая фотография, дерматоскопия, оптическая когерентная томография, отражательная конфокальная микроскопия с последующей обработкой с помощью машинного обучения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование не спонсировалось сторонними организациями.
Список литературы Одиночные новообразования кожи: анализ эпидемиологии и гистологическая верификация
- Breathnach SM. Drug reactions. In: Champion RH, Burton JL, Burns T, Breathnach S, editor. Rook/Wilkinson/ebling: Textbook of dermatology (Four-Volume Set). 6th edn. London: Blackwell Science; 1998. P. 3349–3517.
- Carrow A, Brownstein BR. Tumors of skin. In: Moschella SL, Hurley HJ, editor. Dermatology. 2nd edn. WB Saunders Company, Philadelphia; 1996. 1721 р.
- Khandpur S, Ramam M. Skin tumours. J Cutan Aesthet Surg. 2012;5(3):159–162. doi: 10.4103/0974-2077.101368
- Elder DE, Massi D, Scolyer RA, Willemze R, editor. WHO Classification of Skin Tumours. Vol. 11. 4th edition. WHO Classification of Tumours; 2018.
- Dyussenbayev A. Age periods of human life. Adv Social Sci Res J. 2017;4(6):258–263. doi: 10.14738/assrj.46.2924
- Schneider SL, Kholi I, Hamzavi IH, et al. Emerging imaging technologies in dermatology: Part II: Basic prinicples. J Am Acad Dermatol. 2019;80(4):1121–1131. doi: 10.1016/j.jaad.2018.11.043
- Schneider SL, Kholi I, Hamzavi IH, et al. Emerging imaging technologies in dermatology. Part I: Applications and limitations. J Am Acad Dermatol. 2019;80(4):1114–1120. doi: 10.1016/j.jaad.2018.11.042
- Compton LA, Murphy GF, Lian CG. Diagnostic Immunohistochemistry in Cutaneous Neoplasia: An update. Dermatopathology (Basel). 2015;2(1):15–42. doi: 10.1159/000377698
- Morosin T, Ashford B, Ranson M, et al. Circulating tumour cells in regionally metastatic cutaneous squamous cell carcinoma: A pilot study. Oncotarget. 2016;7:47111–47115. doi: 10.18632/oncotarget.9946
- Lianidou E, Hoon D. Circulating tumor cells and circulating tumor DNA. In: Nader R, Horrath A, Wittwer C, editors. Tietz textbook of clinical chemistry and molecular diagnostics. 6th ed. Elsevier Ltd., Amsterdam, Netherlands; 2017. P. 1111–1144.
- Soglia S, Pérez-Anker J, Lobos Guede N, et al. Diagnostics using non-invasive technologies in dermatological oncology. Cancers (Basel). 2022;14(23):5886. EDN: CWEZMR doi: 10.3390/cancers14235886
- Murphy R. Introduction to AI robotics, second edition. MIT Press, Cambridge, MA, USA; 2019. 648 р.
- Mitra B, Craswell N. An introduction to neural information retrieval. Now Publishers Inc., Boston, MA, USA; 2018. P. 1–126. doi: 10.1561/1500000061
- Patel N, Suthar T, Suthar H, Arora A. A study of tumours, tumour like lesions and cysts of epidermis and its appendages. Ind J Clin Exp Dermatol. 2018;4(3):194–200. doi: 10.18231/2581-4729.2018.0042
- Goel P, Kaur S, Garg A, et al. A clinicopathological study of skin tumors from a tertiary care centre in North India. Indian Dermatol Online J. 2021;12(1):66–71. doi: 10.4103/idoj.IDOJ_257_20
- Shrivastava V, Tangde A, Joshi A, Bindu R. Clinicopathological study of skin tumours. Int J Res Med Sci. 2019;7(5):1712–1719. doi: 10.18203/2320-6012.ijrms20191664
- Alsaad KO, Obaidat NA, Ghazarian D. Skin adnexal neoplasms. Part 1: An approach to tumours of the pilosebaceous unit. J Clin Patholog. 2007;60(2):129–144. doi: 10.1136/jcp.2006.040337
- Mahajan S, Mahaja A, Chopra M. A Retrospective study of morphology and histology of cutaneous appendageal tumours from Northern India. Res J Med Sci. 2024;18:114–119. doi: 10.59218/makrjms.2024.6.114.119
- Sharma N, Nakra T, Agarwal S, et al. Cutaneous adnexal tumours: A study of 395 cases from a tertiary care hospital. Indian J Dermatol. 2023;68(1):41–44. doi: 10.4103/ijd.ijd_586_22
- Sharma A, Paricharak DG, Nigam JS, et al. Histopathological study of skin adnexal tumours-institutional study in South India. J Skin Cancer. 2014;2014:543756. doi: 10.1155/2014/543756
- Pappala P, Raksha S, Vasundara G, et al. Histopathological study of skin tumours. Indian J Pathol Oncol. 2019;6(4):543–547. doi: 10.18231/j.ijpo.2019.106
- Pujani M, Madaan GB, Jairajpuri ZS, et al. Adnexal tumors of skin: An experience at a tertiary care center at Delhi. Ann Med Health Sci Res. 2016;6(5):280–285. doi: 10.4103/amhsr.amhsr_339_14
- Rajalakshmi V, Selvakumar S, Rajeswari K, et al. Case series of skin adnexal tumours. J Clin Diagn Res. 2014;8(9):FC07-10. doi: 10.7860/JCDR/2014/8710.4844
- Nair PS. A clinicopathologic study of skin appendageal tumors. Indian J Dermatol Venereol Leprol. 2008;74(5):550. doi: 10.4103/0378-6323.44339


