Однореакторный синтез 3,4-дитиосемикарбазона дегидроаскорбиновой кислоты
Автор: Рыбакова Анастасия Владимировна, Слепухин Павел Александрович, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Краткие сообщения
Статья в выпуске: 4 т.5, 2013 года.
Бесплатный доступ
Показано, что при окислении аскорбиновой кислоты гипохлоритом натрия и последующем действии тиосемикарбазидом образуется 3,4-дитиосемикарбазон дегидроаскорбиновой кислоты, структура которого исследована методами РСА, ЯМР 1Н и ИК спектроскопии.
Аскорбиновая кислота, дегидроаскорбиновая кислота, 4-дитиосемикарбазон дегидроаскорбиновой кислоты, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147160278
IDR: 147160278 | УДК: 547.475.2
Текст краткого сообщения Однореакторный синтез 3,4-дитиосемикарбазона дегидроаскорбиновой кислоты
Причина незатухающего интереса к химии витамина С (аскорбиновая кислота) объясняется биологической важностью данного соединения, а также тем фактором, что, несмотря на простоту молекулы, наличие в ней ендиольной группировки предполагает протекание сложных окислительно-восстановительных процессов с участием промежуточных радикалов, на стабильность которых влияют свойства кислотных групп самой молекулы [1, 2].
Благодаря подвижности водородных атомов енольных гидроксилов аскорбиновая кислота легко окисляется, причем окисление может идти в две стадии [2]. Первая стадия характеризуется процессом окисления, при котором аскорбиновая кислота окисляется до дегидроаскорбиновой кислоты (кетонная форма). На второй стадии в водной среде процесс окисления может идти дальше – до разложения дегидроаскорбиновой кислоты.
Окисление аскорбиновой кислоты легко происходит в нейтральной и щелочной среде, под действием HNO 2 , KMnO 4 , реактива Фелинга, K 3 [Fe(CN) 6 ], AgNO 3 . Данные о процессах окисления под действием солей хлорноватистой кислоты неизвестны.
Целью работы является однореакторный синтез 3,4-дитиосемикарбазона дегидроаскорбино-вой кислоты и исследование его структуры методами РСА, ЯМР 1Н и ИК спектроскопии.
Результаты и обсуждение
Известно, что конденсация дегидроаскорбиновой кислоты с o -фенилендиамином или его 4,5-диметилпроизводными в основной среде идет с образованием производных хиноксалина [3, 4]. Реакция тиосемикарбазида с монокарбонильными соединениями обычно протекает с образованием тиосемикарбазонов [5, 6]. В случае с дегидроаскорбиновой кислотой, которую можно отнести к поликарбонильным соединениям, взаимодействие с тиосемикарбазидом может идти по положениям 2, 3 или 4, а также с разрывом лактонного цикла.
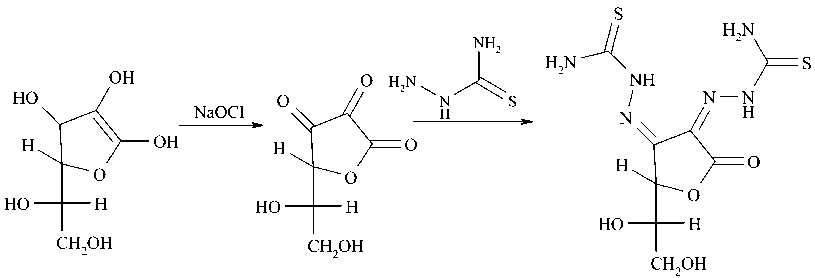
Нами впервые осуществлен однореакторный синтез 3,4-дитиосемикарбазона дегидроаскор-биновой кислоты ( 1 ). Метод синтеза заключается в окислении аскорбиновой кислоты до дегид-роаскорбиновой кислоты раствором гипохлорита натрия (NaClO) и дальнейшем взаимодействии его (без выделения его из реакционной смеси) с тиосемикарбазидом:
Соединение 1 кристаллизуется в виде моногидрата и исследовано методами РСА, ЯМР 1Н и ИК спектроскопии. По данным РСА две кристаллографически независимые молекулы соединения 1 формируют триклинную элементарную ячейку хиральной (Р1) пространственной группы.
Ввиду низкого соотношения значимых интенсивностей рефлексов к общему их числу, определение абсолютной конфигурации соединения не проводилось, и пары Фриделя были усреднены (использование команды MERG 4 в файле инструкции .ins программного пакета SHELXTL [8]). Абсолютная конфигурация полученного соединения определена из предположения, что абсолютная конфигурация аскорбинового фрагмента в ходе реакции не менялась.
Две кристаллографически независимые молекулы соединения 1 имеют близкую пространственную конфигурацию. Общий вид и принятая в структурном эксперименте нумерация атомов на примере одной из молекул показаны на рис. 1. Атомы второй молекулы несут дополнительный индекс «А», атомы сольватированных молекул воды обозначаются индексом «S».
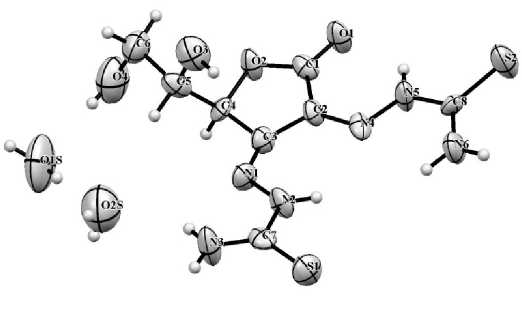
Рис. 1. Соединение 1 согласно данным РСА в тепловых эллипсоидах 50 % вероятности и принятая в структурном эксперименте нумерация атомов
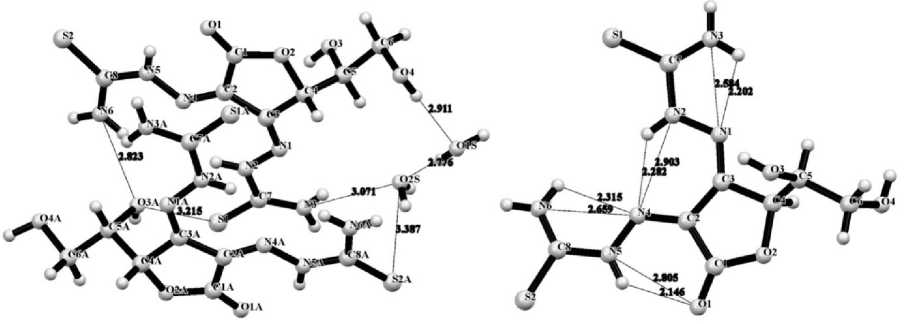
Кристаллическая упаковка характеризуется наличием довольно сложной системы водородных связей, вызывающих сближение атомов на расстояние, значительно меньшее, чем сумма ван-дер-ваальсовых радиусов [7]. При этом межмолекулярные водородные связи
(ММВС) формируют слоевую упаковку молекул, а внутримолекулярные водородные связи (ВМВС) определяют кон- фигурацию молекулы. В частности,
ММВС (рис. 2, а) N6⋅⋅⋅O3A (2,823 Å), О3A⋅⋅⋅S1 (3,215 Å), О2S⋅⋅⋅N3 (3,071 Å), S2A⋅⋅⋅O2S (3,387 Å) стаби- лизируют положение кристаллизационных молекул воды и обуславливают взаимное расположение молекул дигидразона, а ВМВС (рис. 2, б) N1⋅⋅⋅N3 (2,584 Å), N2⋅⋅⋅N4 (2,903 Å), N4⋅⋅⋅N6 (2,659 Å), N5⋅⋅⋅O1 (2,805 Å) определяют ориентацию гидразонных фрагментов в плоскости лактонного цикла.
а)
б)
Рис. 2. Избранные укороченные контакты и водородные связи в кристалле соединения 1: а) межмолекулярные; б) внутримолекулярные
Плоские фрагменты кристаллографически независимых молекул располагаются в кристалле центросимметрично (см. рис. 2, а). Нарушение симметрии кристаллической упаковки и отнесение кристалла к хиральной пространственной группе симметрии связано с ориентацией заместителей хирального узла при атоме С4 (С4А) (см. рис. 2, а).
В ИК спектре соединения 1 имеется полоса колебаний карбонильной группы при 1790 см–1, а в области 3172, 3250, 3375 и 3423 см–1 наблюдаются уширенные полосы колебаний, которые можно отнести к колебаниям NH, NH 2 и ОН групп. В спектре ЯМР 1Н соединения 1 протоны метиленовой группы образуют мультиплет при 3,45 м.д., протон метиновой группы (СН – ОН) –
Рыбакова А.В., Слепухин П.А., Ким Д.Г.
мультиплет при 4,07 м.д., а протон 5-Н фуранового цикла – мультиплет при 5,61 м.д. Следует отметить, что химический сдвиг протона 5-Н находится в значительно более слабом поле, чем в дегидроаскорбиновой кислоте [8], что, по-видимому, обусловлено влиянием гидразонового фрагмента.
Заключение
Найдено, что 3,4-дитиосемикарбазон дегидроаскорбиновой кислоты образуется в условиях однореакторного синтеза при взаимодействии тиосемикарбазида с дегидроаскорбиновой кислотой, полученной окислением аскорбиновой кислоты гипохлоритом натрия.
Экспериментальная часть
Спектры ЯМР 1Н растворов веществ в ДМСО-d 6 получены на спектрометре Bruker DRX-400 (400 МГц), внутренний стандарт ТМС. ИК спектры сняты на спектрофотометре Varian 800FT-IR Scimitar Serias.
Рентгеноструктурный анализ проведён для обломка коричневого кристалла по стандартной процедуре на автоматическом дифрактометре «Xcalibur S» (МоК-излучение, графитовый монохроматор, 295(2) К, ω-сканирование с шагом 1о). Введена эмпирическая поправка на поглощение (µ=0,409 мм–1), Кристалл триклинный, a=6,9561(8), b=10,0812(12), c=11,4702(14), α=65,473(11) °, β=87,147(9) °, γ=75,179(10) °, Р1. На углах отражений Θ<26,37 ° собрано 5573 отражений, из них 2796 независимых (Rint=0,0527), в том числе 1280 с I>2σ(I). Расчет и уточнение структуры произведены с использованием программного пакета SHELXTL [8]. Неводородные атомы уточнены в анизотропном приближении, атомы водорода частично уточнены независимо, частично помещены в рассчитанные положения и включены в уточнение с зависимыми от родительских атомов тепловыми параметрами. Окончательные результаты уточнения: S=0,999, R1=0,0491, wR2=0,0491 (по отражениям с I>2σ(I)). Полный набор кристаллографических данных в виде cif-файла зарегистрирован в Кембриджской базе структурных данных под номером ССDC 958906. Эти данные находятся в свободном доступе и могут быть запрошены по адресу
3,4-Дитиосемикарбазон дегидроаскорбиновой кислоты. В 25 мл 10 % раствора гипохлорита натрия растворяют 1,761 г (0,010 моль) аскорбиновой кислоты и выдерживают в течение 15 минут. Затем добавляют раствор 1,276 г (0,014 моль) тиосемикарбазида в 20 мл воды. Через 24 ч отфильтровывают оранжево-красные игольчатые кристаллы. Выход – 1,12 г (35 %). Т пл =185 °С.
Список литературы Однореакторный синтез 3,4-дитиосемикарбазона дегидроаскорбиновой кислоты
- Петров, А.А. Органическая химия/А.А. Петров, Х.В. Бальян, А.Т. Трощенко. -М.: Высшая школа, 1981. -С. 539-540.
- Мелентьева, Г.А. Фармацевтическая химия/Г.А. Мелентьева, Л.А. Антонова. -М.: Медицина, 1985. -480 с.
- Szepesi, G. New method for the spectrophotometric determinations of ascorbic acid and dehydroascorbic acid/G. Szepesi//Fresenius' Zeitschrift für analytische Chemie. 30. VII. -1973. -Vol. 265. -Issue 5. -P. 334 -336.
- Muralidhar Reddy, P. Synthesis of new macrocyclic rhodium(III) compounds and their utility as catalysts for the oxidation of ascorbic acid/P. Muralidhar Reddy, V.S.S. Adapa, Ch. Kista Reddy, V. Ravinder//Transition Metal Chemistry. -2008. -Vol. 33. -Issue 2. -P. 251-258.
- Миронович, Л.М. 1,2,4-Триазин/Л.М. Миронович, В.К. Промоненков//Итоги науки и техники. Серия «Органическая химия». -М.: ВИНИТИ, 1990. -Т. 22. -268 c.
- Жунгиету, Г.И. Изатин и его производные/Г.И. Жунгиету, М. Рехтер. -Кишенев: Штиинца. 1977. -225 с.
- Зефиров, Ю.В. Ван-дер-ваальсовы радиусы и их применение в химии/Ю.В. Зефиров, П.М. Зоркий//Успехи химии. -1989. -Т. 58. -С. 714-716.
- Sheldrick, G.M. A short history of SHELX/G.M. Sheldrick//Acta Crystallogr. -2008. -A64. -P.112-122.


