Окисление Сr2O3 в системе мелкодисперсных оксидов ТiO2-Сr2O3
Бесплатный доступ
Исследованы окислительно-восстановительные процессы в системе мелкодисперсных оксидов ТiO2-Сr2O3 при прокаливании исходных смесей на воздухе и хранении в обычных условиях. Показано, что на воздухе при температурах 800-1000 °С в мелкодисперсной системе ТiO2-Сr2O3 состояние иона Сr6+ оказывается более устойчивым, тогда как при комнатных температурах более устойчивы ионы Сr3+. Установлено, что в процессе хранения происходит восстановление ионов Сr6+ до Сr3+. При этом данный процесс полностью обратим. Восстановление обусловлено частичной гидратацией поверхности кристалликов Сr2O3 и TiO2.
Короткий адрес: https://sciup.org/147158550
IDR: 147158550 | УДК: 540.145
Текст научной статьи Окисление Сr2O3 в системе мелкодисперсных оксидов ТiO2-Сr2O3
Единственным стабильным оксидом в системе Сг-0 при температуре ниже 1600 °C является Сг2О3 Оксид СгО3 при 200 °C плавится и при 400 °C полностью диссоциирует в Сг2О3, выделяя молекулярный кислород [1]. Однако стабильность Сг2О3 и СгО3 в мелкодисперсном состоянии существенно отличается от устойчивости крупнокристаллических оксидов. Установлено [2], что мелкодисперсный оксид Сг2О3 при нагревании на воздухе окисляется с образованием Сгб+, причем величина окисления возрастает с увеличением поверхности Сг2О3. Показано [3,4], что нагревание на воздухе мелкодисперсного Сг2О3 с А12О3 и ТЮ2 приводит к значительному увеличению окисления Сг2О3, а максимум окисления наблюдали при 500-600 °C. Следует отметить, что природа аномальной устойчивости ионов Сг6+, а также механизм окисления Сг3т~* Сг6+ в мелкодисперсной системе TiO2-Cr2O3 до настоящего времени остаются не ясными.
Целью настоящей работы являлось изучение окислительно-восстановительных процессов и устойчивости ионов Сг6+ в системе из мелкодисперсных оксидов TiO2 и Сг2О3 в процессе длительной выдержки в обычных условиях после прокаливания смесей на воздухе.
Экспериментальная часть
Для исследования взяты а-Сг2О3 и Т1О2 марки «х. ч». Диоксид титана использовали анатазной и рутильной модификации, которые получали прокаливанием гидратированного диоксида титана при 600 и 1000 °C соответственно. В свою очередь ГДТ получали по способу, детально описанному в [5], путем термического гидролиза растворов сульфатных соединений Ti (IV). Гидролиз проводили в присутствии анатазных зародышей, которые согласно [1] являются центрами образования первичных частиц ГДТ в процессе его гидролиза. Смеси состава 95 мас.% ТЮ2 и 5 мас.% Сг2О3 готовили тщательным перемешиванием оксидов в агатовой ступке до получения образцов однородного цвета. Полученные смеси прокаливали на воздухе в интервале температур 850-1000 °C в течении часа, которые исследовали рентгенографическим и химическим анализами как сразу после охлаждения смесей, так и в процессе хранения в обычных условиях в течении 720 сут. Количественный и качественный фазовый анализ образцов проводили на дифрактромет-ре ДРОН-ЗМ с Кц-излучением кобальта. Количественный фотоколориметрический анализ хрома (VI) и хрома (III) проводили по методикам подробно описанным в [6].
Средний размер кристалликов (<Д, рассчитанный из микроскопических данных и по ширине рентгеновских дифракционных максимумов, следующий: для a-Cr2O3 d ~ 700 А; для Т1О2 анатазной модификации d ~ 200 А; для Т1О2 рутильной модификации d ~ 600 А. Удельная поверхность оксидов, в приближении сферических частиц, для а-Сг2О3 равна 16,5 м2/г, для анатаза 29 м2/г, для рутила 120 м2/г.
Обсуждение результатов
В таблице представлены данные по эффективности окисления Сг2О3 после прокаливания его на воздухе отдельно и в смеси с Т1О2. За количественную оценку эффектности окисления Сг2О3 после прокаливания смесей на воздухе принимали величину 5, которую определяли из равенства (1)
5 = ^Ь^-100%, (1)
^Сг где N^6+ - количество ионов Сг6+, найденное в результате химического анализа; Л^сг ~ общее количество ионов хрома в смеси.
Отметим, что механизм взаимодействия ТЮ2 анатазной и рутильной модификации с оксидом хрома (III) существенно различен. При совместном прокаливании анатаза с Сг2О3 на воздухе наблюдается интенсивное окисление последнего с образованием метастабильных соединений с Сг6+.
Эффективность окисления Сг2О3 после прокаливания смесей ТЮг-Сг2О3 на воздухе в течении часа
|
Температура прокаливания, °C |
Коэффициент 5 (%) смесей состава |
||
|
а-Сг2О3 |
95% Т1О2(анатаз)- -5% а-Сг2О3 |
95% Т1О2(рутил)- -5% а-Сг2О3 |
|
|
850 |
0,007 |
2,5 |
0,63 |
|
900 |
0,010 |
1,0 |
0,58 |
|
1000 |
0,032 |
1,11 |
0,50 |
При этом количество соединений с Сг6+ определяется временем и температурой изотермической выдержки. Наиболее интенсивное окисление происходит при 850 °C в течении 60 минут. Дальнейшее увеличение температуры и времени выдержки существенно снижают содержание Сг6+. Как видно из таблицы, при взаимодействии Т1О2 рутильной модификации с Сг2О3, окисление незначительно и на порядок меньше, чем при взаимодействии анатаза с оксидом хрома (Ш). Анализ полученных результатов показывает сильное влияние ТЮ2 на окисление Сг2О3, поскольку при совместном прокаливании коэффициент 8 увеличивается почти на 3 порядка. При увеличении удельной поверхности ТЮ2 в смесях Т1О2-Сг2О3 в 63 раза коэффициент эффективности окисления 8 возрастает приблизительно в 60 раз. Таким образом, количество Сг6+ в смесях после прокаливания пропорционально удельной поверхности реагирующих оксидов.
Следует отметить, что в процессе хранения содержание ионов Сг6+ уменьшается. При исследовании спектров ЭПР прокаленных в обычных условиях смесей сигнала, который отвечает состоянию иона Сг5+ или Сг4+, не обнаружено. Следовательно, в процессе хранения происходит восстановление ионов Сг6+ до Сг3+. При этом данный процесс полностью обратим, поскольку повторный нагрев смесей на любой стадии хранения приводит к первоначальным значениям величин 8.
Таким образом, анализ вышеизложенных экспериментальных данных позволяет сделать вывод, что на воздухе при температурах 800-1000 °C в мелкодисперсной системе TiO2-Cr2O3 состояние иона Сгб+ оказывается более устойчивым, тогда как при комнатных температурах более устойчивы ионы Сг3+.
На рисунке представлены зависимости изменения энергии Гиббса AGT° от температуры для реакций, приводящих к окислению Сг3+до Сг6+ по данным [7]. Прямая реакция (2)
Сг2О3 + 1,5 О2 = 2 СгО3 (2) при температурах выше 27 °C невозможна. Вероятность протекания обратной (2) реакции возрастает с увеличением температуры, что соответствует литературным данным по термической стабильности СгО3, однако не согласуется с экспериментальным фактом частичного окисления Сг3+ до Сг6+ при прокаливании на воздухе мелкодисперсного оксида Сг2О3. Окисление, по-видимому, связано с тем, что анатаз содержит значительное количество поверхностной воды [8].
Химия
Подобное окисление оксида хрома (III) наблюдали в системе у-А12О3-Сг2О3 и связывали с наличием ОН-групп на поверхности оксида алюминия [9, 10].
Одной из возможных причин окисления Ci^^Cr^ после прокаливания мелкодисперсного Сг2О3 на воздухе отдельно и в смеси с Т1О2 может быть частичная их гидратация с образованием
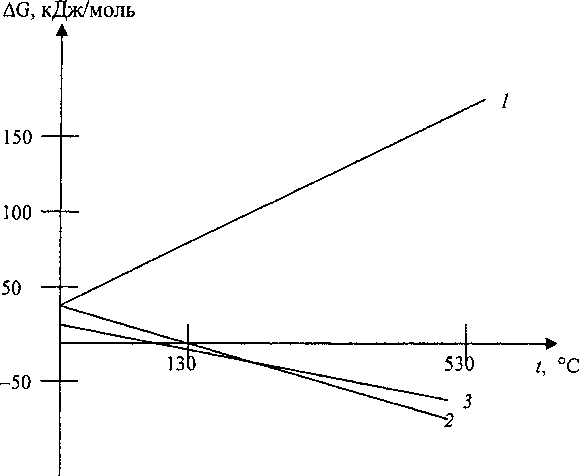
Зависимость энергии Гиббса от температуры для реакции 2(1), 3(2), 4(3)
в приповерхностных слоях структур близких к Сг(ОН)з и Ti(OH)4, в этом случае реакции, приводящие к образованию Сгб+, могут быть представлены в виде (3) и (4):
2 Сг(ОН)3 + 1,5О2 = 2 СгОз + ЗН2О, (3)
Cr2O3 + Ti(OH)4 + 1,5-О2 = 2 СгО3 + ТЮ2 + 2Н2О. (4)
Вероятность окисления гидроксида хрома возрастает с увеличением температуры, причем прямая реакция (3) возможна выше 130 °C, что хорошо согласуется с экспериментальными данными. Для реакции (4), как и для реакции (3), в температурном интервале 30-630 °C AGT° меняет знак, причем прямая реакция возможна выше 120 °C.
Реакции (3) и (4) качественно объясняют зависимости эффективности окисления Сг2О3 в системе Т1О2-Сг2Оз от размеров кристалликов исходных оксидов. С увеличением удельной поверхности оксидов ТЮ2 или Сг2О3 поверхностная гидратация кристалликов возрастает, что приводит к увеличению окисления Сг20з. Гидратация кристалликов Т1О2 и Сг20з с образованием химически активных групп ОН" происходит при комнатной температуре в обычных условиях. Поверхностные связи Cr3+-OH", Ti4-OH' оказываются устойчивыми и сохраняются выше 730 °C [8]. При прокаливании смесей на воздухе происходит дегидратация кристалликов с образованием ионов Сг6+. В окислении Сг3+—»Сг6+ не исключена роль протонов. В процессе хранения прокаленных смесей вновь происходит гидратация поверхности кристалликов и восстановление Сг —> Сг3+, так как реакции (3) и (4) при комнатных температурах идут в обратном направлении.
Выводы
-
1. Исследованы окислительно-восстановительные процессы в системе мелкодисперсных оксидов ТЮ2-Сг20з при прокаливании исходных смесей на воздухе и хранении в обычных условиях.
-
2. Показано, что на воздухе при температурах 800-1000 °C в мелкодисперсной системе Т1О2-Сг20з состояние иона Сг6+ оказывается более устойчивым, тогда как при комнатных температурах более устойчивы ионы Сг3+.
-
3. Установлено, что в процессе хранения происходит восстановление ионов Сг6+ до Сг3+. При этом данный процесс полностью обратим.
-
4. Взаимодействие анатазной и рутильной модификации ТЮ2 с Сг2О3 различно. При взаимодействии Сг2О3 с анатазом наблюдается интенсивное окисление Сг3+ с образованием метаста-бильных соединений с Сгб+. Максимальное количество этих соединений наблюдается при 850 °C при изотермическом прокаливании в течение 60 минут. Окисление оксида хрома (III) в присутствии рутила незначительно.
Работа выполнена при поддержке гранта губернатора Челябинской области (Гр. Ур. Чел. 29/МОб/А).
Список литературы Окисление Сr2O3 в системе мелкодисперсных оксидов ТiO2-Сr2O3
- Большой энциклопедический справочник -Химия/под ред. И.Л. Кнунянц. -М.: Научное издательство «Большая Российская энциклопедия», 1998. -789 с.
- Deren, J. Studia on the physical-chemical and surface properties of chromium oxides/J. Deren, J. Haber//Solid State Ionics.-2003.-V. 157, № l.-P. 397-386.
- Взаимодействие в системе мелкодисперсных оксидов А12O3-Сr2Oз при 400-800 °С/В.В. Викторов, В.Е. Гладков, А.А. Фотиев и др.//Изв. АН СССР. Неорган, материалы -1983. -Т. 19, №6.-С. 930-933.
- Влияние TiO2 на окисление Сr2O3 в системе мелкодисперсных оксидов А12О3-Сr2О3/В.В. Викторов, В.Е. Гладков, А.А. Фотиев и др.//Изв. АН СССР. Неорган. материалы -1984. -Т. 20, №4.-С. 686-689.
- Беленький, Е.Ф. Химия и технология пигментов/Е.Ф. Беленький, И.В. Рискин. -Л.: Химия, 1974.-656 с.
- Золотов, Ю.А. Основы аналитической химии/Ю.А. Золотов. -М.: Высшая школа, 1999. -351с.
- Артеминко, А.И. Справочное руководство по химии/А.И. Артеминко, И.В. Тикунова, В.А. Малеванный. -М.: Высшая школа, 2002. -362 с.
- Моррисон, С. Химическая физика поверхности твердого тела/С. Моррисон. -М.: Мир, 1980.-488 с.
- Особенности образования твердых растворов (Сrх Аl1-xО3 при совместном прокаливании гидроксидов А1 и Сr/М.С. Ковель, В.В. Викторов, И.В. Евдокимов и др.//Изв. АН СССР. Неорганические материалы. -1989. -Т. 25, № 7. -С. 1160-1164. 10.
- Викторов, В.В. Кинетика образования твердых растворов в системе А12O3 -Сr2O3/
- В.В. Викторов, И.В. Евдокимов, М.С. Ковель//Журнал физической химии. -1990. -Т. 64, № 7. -С.1820-1824.


