Окисление трис(2-метоксифенил)сурьмы трет-бутилгидропероксидом в присутствии карбоновой кислоты
Автор: Шарутин В.В., Шарутина О.К., Палилова В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.17, 2025 года.
Бесплатный доступ
Окисление трис(2-метоксифенил)сурьмы трет-бутилгидропероксидом в присутствии карбоновой кислоты в тетрагидрофуране или диэтиловом эфире приводит к образованию бис(хлорацетата) трис(2-метоксифенил)сурьмы (2-MeOC6H4)3Sb[OC(O)CH2Cl]2 (1), бис(2-метоксибензоата) трис(2-метоксифенил)сурьмы (2-MeOC6H4)3Sb[OC(O)C6H4(OMe-2)]2 (2), бис(2,3-дифторбензоата) трис(2-метоксифенил)сурьмы [(2-MeOC6H4]3Sb[OС(O)C6H3F2-2,3]2 (3) и сольвата бис(пентафторбензоата) трис(2-метоксифенил)сурьмы с бензолом [(2-MeOC6H4]3Sb[OС(O)C6F5]2 ∙ ½ PhH (4). Соединения 1-4, выделенные после перекристаллизации из смеси бензол-октан в виде монокристаллов, охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). В ИК-спектрах присутствуют полосы, характеризующие колебания карбонильных груп (1697, 1624, 1655, 1668 см-1), фрагмента SbC3 (440-447 см-1), связей Sb-O (575-536 см-1) соответственно. По данным РСА, кристаллы 1 и 4 принадлежат триклинной сингонии, группа симметрии Р-1; кристаллы 2 и 3 - моноклинной сингонии, группа симметрии P21/n. Факторы недостоверности уточнения структурных данных соствляют R1 = 0,0502 (1), R1 = 0,0437 (2), R1 = 0,0409 (3), R1 = 0,0333 (4). В тригонально-бипирамидальных молекулах с электроотрицательными лигандами в аксиальных положениях расстояния Sb-C составляют для 1 2,0966(17)-2,1194(18) Å, для 2 2,104(2)-2,126(2) Å, для 3 2,0889(19)-2,1134(19) Å и для 4 2,109(2)-2,123(2) Å; валентные углы OSbO принимают значения 175,15(5)° (1), 171,42(6)° (2), 176,97(6)° (3) и 164,47(6)° (4). Расстояния Sb-О в 1 [2,1088(15) и 2,1269(15) Å] сопоставимы с наблюдаемыми в 2 [2,1137(17) и 2,1232(18) Å], в 3 [2,0880(14) и 2,1063(14) Å] и несколько отличными для 4 [2,1035(17) и 2,1460(17) Å]. Сольватные молекулы бензола в 4 связывают собой соседние молекулы дикарбоксилатов [расстояния С∙∙∙H и Сl∙∙∙H равны 2,84 Å и 3,06 Å, что меньше суммы ковалентных радиусов атомов-партнеров. Атом сурьмы координирует карбонильные атомы кислорода со стороны малых экваториальных углов (115,31(9)° и 119,59(9)°), при этом внутримолекулярные контакты Sb∙∙∙O=C составляют 3,374(3) и 3,296(3) Å, что больше внутримолекулярных контактов Sb∙∙∙OMe (3,079-3,172 Å). Отметим, что подобное различие внутримолекулярных контактов Sb∙∙∙O и Sb∙∙∙OMe наблюдается и в первых трех молекулах комплексов [3,296(3), 3,374(3) Å и 3,102-3,167 Å для 1, 3,010(3), 3,164(3) Å и 3,058-3,202 Å для 2 и 3,190(3), 3,233(3) Å и 3,056-3,120 Å для 3]. Внутримолекулярные контакты Sb∙∙∙O=С между центральным атомом металла и карбонильным атомом кислорода наибольшие в 1 и 4, что можно объяснить присутствием электроакцепторных карбоксилатных лигандов. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2416266 (1), № 2415652 (2), № 2415732 (3), № 2415648 (4), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Трис(2-метоксифенил)сурьма, трет-бутилгидропероксид, хлоруксусная, 2-метоксибензойная, 2, 3-дифторбензойная, пентафторбензойная, кислота, синтез, карбоксилаты трис(2-метоксифенил)сурьмы, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147248076
IDR: 147248076 | УДК: 546.865+547.53.024+548.312.5 | DOI: 10.14529/chem250204
Текст научной статьи Окисление трис(2-метоксифенил)сурьмы трет-бутилгидропероксидом в присутствии карбоновой кислоты
Аннотация. Окисление трис(2-метоксифенил)сурьмы трет-бутилгидропероксидом в присутствии карбоновой кислоты в тетрагидрофуране или диэтиловом эфире приводит к образованию бис(хлорацетата) трис(2-метоксифенил)сурьмы (2-MeOC6H4)3Sb[OC(O)CH2Cl]2 (1), бис(2-метоксибензоата) трис(2-метоксифенил)сурьмы (2-MeOC6H4)3Sb[OC(O)C6H4(OMe-2)]2 (2), бис(2,3-дифторбензоата) трис(2-метоксифенил)сурьмы [(2-MeOC6H4]3Sb[OС(O)C6H3F2-2,3]2 (3) и сольвата бис(пентафторбензоата) трис(2-метоксифенил)сурьмы с бензолом [(2-MeOC6H4]3Sb[OС(O)C6F5]2 ∙ ½ PhH (4). Соединения 1-4, выделенные после перекристаллизации из смеси бензол-октан в виде монокристаллов, охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). В ИК-спектрах присутствуют полосы, характеризующие колебания карбонильных груп (1697, 1624, 1655, 1668 см–1), фрагмента SbC3 (440–447 см–1), связей Sb–O (575–536 см–1) соответственно. По данным РСА, кристаллы 1 и 4 принадлежат триклинной сингонии, группа симметрии Р–1; кристаллы 2 и 3 - моноклинной сингонии, группа симметрии P2 1/n. Факторы недостоверности уточнения структурных данных соствляют R1 = 0,0502 (1), R1 = 0,0437 (2), R1 = 0,0409 (3), R1 = 0,0333 (4). В три-гонально-бипирамидальных молекулах с электроотрицательными лигандами в аксиальных положениях расстояния Sb-C составляют для 1 2,0966(17)-2,1194(18) Å, для 2 2,104(2)-2,126(2) Å, для 3 2,0889(19)-2,1134(19) Å и для 4 2,109(2)-2,123(2) Å; валентные углы OSbO принимают значения 175,15(5)° (1), 171,42(6)° (2), 176,97(6)° (3) и 164,47(6)° (4). Расстояния Sb-О в 1 [2,1088(15) и 2,1269(15) Å] сопоставимы с наблюдаемыми в 2 [2,1137(17) и 2,1232(18) Å], в 3 [2,0880(14) и 2,1063(14) Å] и несколько отличными для 4 [2,1035(17) и 2,1460(17) Å]. Сольватные молекулы бензола в 4 связывают собой соседние молекулы дикарбоксилатов [расстояния С∙∙∙H и Сl∙∙∙H равны 2,84 Å и 3,06 Å, что меньше суммы ковалентных радиусов атомов-партнеров. Атом сурьмы координирует карбонильные атомы кислорода со стороны малых экваториальных углов (115,31(9)° и 119,59(9)°), при этом внутримолекулярные контакты Sb∙∙∙O=C составляют 3,374(3) и 3,296(3) Å, что больше внутримолекулярных контактов Sb—OMe (3,079-3,172 А). Отметим, что подобное различие внутримолекулярных контактов Sb∙∙∙O и Sb∙∙∙OMe наблюдается и в первых трех молекулах комплексов [3,296(3), 3,374(3) А и 3,102-3,167 А для 1, 3,010(3), 3,164(3) А и 3,058-3,202 А для 2 и 3,190(3), 3,233(3) А и 3,056-3,120 А для 3]. Внутримолекулярные контакты Sb—О=С между центральным атомом металла и карбонильным атомом кислорода наибольшие в 1 и 4, что можно объяснить присутствием электроак-цепторных карбоксилатных лигандов. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2416266 (1), № 2415652 (2), № 2415732 (3), № 2415648 (4), ; .
Органические соединения Sb(V) применяются в различных областях. Так, хорошо изучены полезные свойства дикарбоксилатов триарилсурьмы, которые представлены многочисленным рядом [1]. Например, установлена их способность выступать арилирующими агентам в реакциях кросс-сочетания, катализируемых палладием, для образования как новых углерод-углеродных связей [2–8], так и связей углерода с гетероатомами (C–B [9] и C–P [10]). Установлена биологическая активность некоторых дикарбоксилатов триарилсурьмы [11], например, противоопухоле- вое [12] или антилейшманиозное действие [13]. Опубликованы примеры использования сурьма-органических производных непредельных карбоновых кислот, способных к полимеризации, в фотолитографии в качестве высокочувствительных УФ-резистов [14] и для получения прозрачных металлосодержащих органических стекол и полимеров [15]. Исследована возможность использования дикарбоксилатов триарилсурьмы в качестве фотокатализаторов при разложении красителей [16].
Особенности строения дикарбоксилатов триорганилсурьмы описаны многократно [17 - 27]; в большей мере, безусловно, это касается фенильных производных c карбоксилатными лигандами разнообразного строения. Тем не менее, из имеющихся публикаций следует, что искажение три-гонально-бипирамидальной конфигурации молекул дикарбоксилатов в значительной степени определяется природой карбоксилатных остатков и заместителей в арильных группах [28 - 32].
Соединения сурьмы общей формулы Ar 3 Sb[OC(O)R] 2 , содержащие в арильных лигандах при атоме сурьмы различные функциональные группы, изучены в меньшей степени, хотя именно в строении этих соединений чаще всего встречаются интересные особенности [31 - 32].
Целью настоящей работы явился синтез и установление особенностей строения дикарбоксилатов трис (2-метоксифенил)сурьмы, которые в настоящий момент практически не изучены и описаны на единственном примере [33].
Экспериментальная часть
К раствору 0,100 г (0,23 ммоль) трис (2-метоксифенил)сурьмы и 0,069 г (0,45 ммоль) хлоруксусной кислоты в 25 мл тетрагидрофурана прибавляли 0,040 г (0,23 ммоль) трет бутилгидропероксида и выдерживали 24 ч при комнатной температуре. Удаляли растворитель, остаток перекристаллизовали из смеси бензол - октан (3:1 объем.). Масса образовавшихся бесцветных кристаллов бис (2-хлорацетат) трис (2-метоксифенил)сурьмы ( 1 ) с т. пл. 174 ° С составила 0,12 г (85%). ИК-спектр, v , см - 1: 3001, 2951, 1697, 1659, 1582, 1481, 1464, 1435, 1408, 1377, 1327, 1285, 1257, 1215, 1184, 1185, 1126, 1059, 1020, 931, 795, 754, 694, 575, 519, 482, 447. Найдено, %: С 47,52; Н 4,17. C 25 H 25 O 7 Cl 2 Sb. Вычислено, %: С 47,61; Н 3,97.
Аналогично получали бис (2-метоксибензоат) трис (2-метоксифенил)сурьмы ( 2 ) (т.пл. 136 ° С, 83 %, ИК-спектр, v , см - 1: 3109, 3067, 2957, 2833, 1624, 1597, 1580, 1481, 1468, 1435, 1327, 1254, 1180, 1165, 1143, 1138, 1097, 1053, 1020, 997, 849, 795, 748, 702, 684, 565, 536, 480, 440. Найдено, %: С 50,38; Н 4,82. C 37 H 35 O 9 Sb. Вычислено, %: С 50,56; Н 4,70).
Бис (2,3-дифторбензоат) трис (2-метоксифенил)сурьмы ( 3 ) (растворитель - диэтиловый эфир, т.пл. 179 ° С, 76 %, ИК-спектр, v , см - 1: 3084, 2963, 2837, 1655, 1581, 1481, 1431, 1335, 1312, 1269, 1250, 1225, 1182, 1151, 1123, 1061, 951, 833, 783, 758, 631, 571, 517, 482, 459, 442. Найдено, %: С 55,37; Н 3,63. C 35 H 27 O 7 F 4 Sb. Вычислено, %: С 55,46; Н 3,57).
Сольват бис (пентафторбензоата) трис (2-метоксифенил)сурьмы с бензолом ( 4 ) (т.пл. 115 ° С, 86 %, ИК-спектр, v , см - 1: 3065, 2941, 2837, 1688, 1649, 1582, 1522, 1499, 1479, 1435, 1329, 1279, 1252, 1180, 1163, 1126, 1105, 1057, 1015, 995, 922, 862, 825, 795, 746, 694, 573, 519, 484, 445. Найдено, %: С 50,39; Н 2,73. C 38 H 24 O 7 F 10 Sb. Вычислено, %: С 50,42; Н 2,65).
Элементный анализ проводили на анализаторе Euro EA3028-НТ.
Рентгеноструктурный анализ проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo [С.-излучение. X = 0,71073 А, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [34]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [35] и OLEX2 [36]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в табл. 1, длины связей и валентные углы – в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2416266 (1), № 2415652 (2), № 2415732 (3), № 2415648 (4), ; .
Таблица 1
|
Параметр |
1 |
2 |
3 |
4 |
|
Формула |
C 25 H 25 O 7 Cl 2 Sb |
C 37 H 35 O 9 Sb |
C 35 H 27 O 7 SbF 4 |
C 38 H 24 O 7 F 10 Sb |
|
М |
630,10 |
745,40 |
757,32 |
904,32 |
|
Сингония |
Триклинная |
Моноклинная |
Моноклинная |
Триклинная |
|
Пр. группа |
P -1 |
P 2 1 / n |
P 2 1 / n |
P -1 |
|
a , Å |
9,561(4) |
19,241(8) |
12,179(9) |
11,323(7) |
|
b, Å |
10,465(6) |
8,975(4) |
16,878(8) |
13,101(4) |
|
c, Å |
15,315(6) |
20,725(11) |
15,673(9) |
13,624(5) |
|
α, град. |
101,28(2) |
90,00 |
90,00 |
112,437(12) |
|
β, град. |
102,982(19) |
113,485(16) |
99,985(15) |
101,948(19) |
|
γ, град. |
108,150(19) |
90,00 |
90,00 |
91,20(2) |
|
V , Å3 |
1359,3(11) |
3292(3) |
3172,9(11) |
1816,3(14) |
|
Z |
2 |
4 |
4 |
2 |
|
ρ (выч.), г/см3 |
1,539 |
1,508 |
1,585 |
1,653 |
|
µ , мм–1 |
1,252 |
0,897 |
0,942 |
0,860 |
|
F (000) |
632,0 |
1520,0 |
1520,0 |
898,0 |
|
Размер кристалла (мм) |
0,43 × 0,31 × 0,24 |
0,5 × 0,35 × 0,32 |
0,53 × 0,36 × 0,17 |
0,5 × 0,47 × 0,07 |
|
Область сбора данных по 2 θ , град. |
5,7–93,66 |
5,88–65,36 |
5,8–73,02 |
6,06–60,38 |
|
Интервалы индексов отражений |
- 19 ≤ h ≤ 19, - 21 ≤ k ≤ 21, - 31 ≤ l ≤ 31 |
- 29 ≤ h ≤ 29, - 13 ≤ k ≤ 13, - 31 ≤ l ≤ 31 |
- 20 ≤ h ≤ 20, - 28 ≤ k ≤ 28, - 16 ≤ l ≤ 26 |
- 15 ≤ h ≤ 15, - 17 ≤ k ≤ 17, - 18 ≤ l ≤ 17 |
|
Измерено отражений |
103548 |
71613 |
64893 |
24210 |
|
Независимых отражений |
24228 |
11982 |
15486 |
9369 |
|
Переменных уточнения |
319 |
429 |
427 |
508 |
|
GOOF |
1,033 |
1,064 |
1,002 |
1,084 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0502, wR 2 = 0,1052 |
R 1 = 0,0437, wR 2 = 0,0759 |
R 1 = 0,0409, wR 2 = 0,0783 |
R 1 = 0,0333, wR 2 = 0,0652 |
|
R -факторы по всем отражениям |
R 1 = 0,1061, wR 2 = 0,1262 |
R 1 = 0,0795, wR 2 = 0,0870 |
R 1 = 0,0982, wR 2 = 0,0973 |
R 1 = 0,0456, wR 2 = 0,0698 |
|
Остаточная электронная плотность (min/max), e /Å3 |
1,18/ - 1,08 |
0,65/ - 0,79 |
1,07/ - 0,63 |
0,43/ - 0,62 |
Таблица 2
|
Связь d , Å \ |
Угол ω , град. |
||
|
1 |
|||
|
Sb(1)–O(5) |
2,1269(15) |
O(7)Sb(1)O(5) |
175,15(5) |
|
Sb(1)–O(7) |
2,1088(15) |
C(1)Sb(1)C(11) |
111,15(7) |
|
Sb(1)–C(1) |
2,0966(17) |
C(1)Sb(1)C(21) |
125,87(7) |
|
Sb(1)–C(11) |
2,1194(18) |
C(11)Sb(1)C(21) |
122,95(7) |
|
Sb(1)–C(21) |
2,1181(18) |
O(5)Sb(1)С(1) |
88,35(7) |
|
O(4) - С(31) |
1,212(3) |
O(5)Sb(1)С(11) |
83,12(7) |
|
O(5) - С(31) |
1,295(2) |
O(5)Sb(1)С(21) |
96,06(7) |
|
O(6) - С(33) |
1,206(2) |
O(7)Sb(1)С(1) |
86,91(6) |
|
O(7) - С(33) |
1,298(2) |
O(7)Sb(1)С(11) |
97,68(7) |
|
Sb(1)∙∙∙O(1) |
3,113(5) |
O(7)Sb(1)С(21) |
87,53(7) |
|
Sb(1)∙∙∙O(2) |
3,103(5) |
О(4)С(31)О(5) |
125,68(19) |
Окончание табл. 2
|
Связь d , Å |
Угол ω , град. |
||
|
Sb(1)∙∙∙O(3) |
3,127(6) |
О(6)С(33)О(7) |
124,96(19) |
|
Sb(1)∙∙∙O(4) |
3,167(5) |
||
|
Sb(1)∙∙∙O(6) |
3,102(5) |
||
|
2 |
|||
|
Sb(1)–O(5) |
2,1232(18) |
O(7)Sb(1)O(5) |
171,42(6) |
|
Sb(1)–O(7) |
2,1137(17) |
C(1)Sb(1)C(11) |
131,29(10) |
|
Sb(1)–C(1) |
2,115(2) |
C(1)Sb(1)C(21) |
119,48(9) |
|
Sb(1)–C(11) |
2,104(2) |
C(11)Sb(1)C(21) |
108,99(10) |
|
Sb(1)–C(21) |
2,126(2) |
O(5)Sb(1)C(1) |
91,05(8) |
|
O(4)–C(48) |
1,218(3) |
O(5)Sb(1)C(21) |
85,61(9) |
|
O(5)–C(48) |
1,301(3) |
O(5) Sb(1) C(11) |
87,90(9) |
|
O(8)–C(58) |
1,218(3) |
O(7)Sb(1)C(1) |
87,99(8) |
|
O(7)–C(58) |
1,294(3) |
C(11)Sb(1)O(7) |
86,34(8) |
|
Sb(1)∙∙∙O(4) |
3,058(5) |
O(7)Sb(1)C(21) |
102,28(9) |
|
Sb(1)∙∙∙O(8) |
3,010(5) |
О(4)С(48)О(5) |
123,3(2) |
|
Sb(1)∙∙∙O(1) |
3,058(5) |
O(7)С(58)О(8) |
122,7(2) |
|
Sb(1)∙∙∙O(2) |
3,164(5) |
||
|
Sb(1)∙∙∙O(3) |
3,202(6) |
||
|
3 |
|||
|
Sb(1)–O(4) |
2,1063(14) |
O(4)Sb(1)O(6) |
176,97(6) |
|
Sb(1)–O(6) |
2,0880(14) |
C(1)Sb(1)C(11) |
128,22(8) |
|
Sb(1)–C(1) |
2,11134(19) |
C(1)Sb(1)C(21) |
114,46(7) |
|
Sb(1)–C(21) |
2,0889(19) |
C(11)Sb(1)C(21) |
117,32(8) |
|
Sb(1)–C(11) |
2,105(2) |
O(4)Sb(1)С(1) |
88,93(7) |
|
O(4)–C(37) |
1,287(2) |
O(4)Sb(1)C(11) |
96,23(7) |
|
O(5)–C(37) |
1,204(3) |
O(4)Sb(1) C(21) |
84,16(7) |
|
O(6)–C(47) |
1,295(3) |
O(6)Sb(1)C(1) |
88,32(7) |
|
O(7)–C(47) |
1,204(3) |
O(6)S(1)C(11) |
84,48(7) |
|
Sb(1)∙∙∙O(5) |
3,190(5) |
O(6)Sb(1)C(21) |
98,14(7) |
|
Sb(1)∙∙∙O(7) |
3,233(6) |
O(4)C(37)O(5) |
124,5(2) |
|
Sb(1)∙∙∙O(1) |
3,056(5) |
O(6)C(47)O(7) |
125,5(2) |
|
Sb(1)∙∙∙O(2) |
3,019(5) |
||
|
Sb(1)∙∙∙O(3) |
3,120(6) |
||
|
4 |
|||
|
Sb(1)–O(4) |
2,1460(17) |
O(6)Sb(1)O(4) |
164,47(6) |
|
Sb(1)–O(6) |
2,1035(17) |
C(1)Sb(1)C(11) |
115,31(9) |
|
Sb(1)–C(1) |
2,109(2) |
C(1)Sb(1)C(21) |
125,10(9) |
|
Sb(1)–C(11) |
2,119(2) |
C(11)Sb(1)C(21) |
119,59(9) |
|
Sb(1)–C(21) |
2,123(2) |
O(4)Sb(1)C(1) |
83,40(8) |
|
O(4)–C(37) |
1,293(3) |
O(4)Sb(1)C(11) |
100,46(9) |
|
O(5)–C(37) |
1,208(3) |
O(4)Sb(1)C(21) |
86,70(8) |
|
O(6)–C(47) |
1,308(3) |
O(6)Sb(1)C(1) |
90,06(8) |
|
O(7)–C(47) |
1,208(3) |
O(6)Sb(1)C(11) |
95,07(0) |
|
Sb(1)∙∙∙O(5) |
3,296(5) |
O(6)Sb(1)C(21) |
85,58(8) |
|
Sb(1)∙∙∙O(7) |
3,374(6) |
O(4)C(37)O(5) |
126,7(2) |
|
Sb(1)∙∙∙O(1) |
3,079(5) |
O(6)C(47)O(7) |
127,0(2) |
|
Sb(1)∙∙∙O(2) |
3,172(5) |
||
|
Sb(1)∙∙∙O(3) |
3,126(6) |
||
Обсуждение результатов
Дикарбоксилаты триарилсурьмы получают, как правило, или по реакциям замещения, действуя на дигалогениды или дигидроксиды триарилсурьмы солями карбоновых кислот [22, 30, 37], или по реакции окислительного присоединения из триарильных соединений сурьмы, карбоновой кислоты и пероксида как окислителя [38].
Для синтеза карбоксилатов трис (2-метоксифенил)сурьмы нами был выбран окислительный метод как наиболее эффективный и менее трудоемкий, поскольку протекает в одну стадию и позволяет получить достаточно чистый продукт. В качестве окислителя был испльзован трет бутилгидропероксид, растворителем служили тетрагидрофуран или диэтиловый эфир. Нами получены бис (2-хлорацетат) трис (2-метоксифенил)сурьмы ( 1 ), бис (2-метоксибензоат) трис (2-метоксифенил)сурьмы ( 2 ), бис (2,3-дифторбензоат) трис (2-метоксифенил)сурьмы ( 3 ) и бис (пентафторбензоата) трис (2-метоксифенил)сурьмы, который был выделен в форме сольвата с бензолом ( 4 ).
(2-MeOC 6 H 4 ) 3 Sb + 2 HOC(O)R + t -BuOOH → (2-MeOC 6 H 4 ) 3 Sb[OC(O)R] 2 + t -BuOH + H 2 O
CH 2 Cl ( 1 ), C 6 H 4 (OMe-2) ( 2 ), C 6 H 3 F 2 -2,3 ( 3 ), C 6 F 5 ( 4 )
Целевые соединения после перекристаллизации из смеси бензол - октан выделяли с выходами 76 - 89 % в виде бесцветных кристаллических веществ, растворимых в ароматических углеводородах и нерастворимых в алканах.
Соединения 1 - 4 были охарактеризованы методами ИК-спектроскопии и рентгеноструктурного анализа.
Найдено, что в молекулах 1 - 4 атомы сурьмы имеют координацию искаженной тригональной бипирамиды, в аксиальных положениях которой находятся карбоксилатные лиганды (рис. 1 - 4).
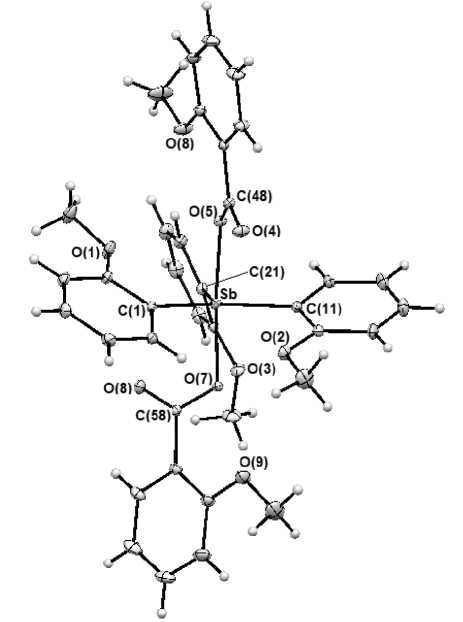
Рис. 2. Строение молекулы (2-MeOC 6 H 4 ) 3 Sb[OC(O)C 6 H 4 (OMe-2)] 2 (2)
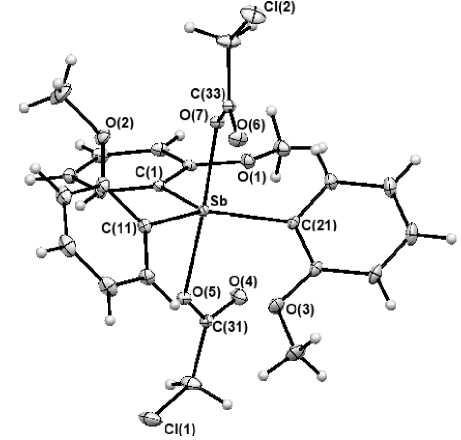
Рис. 1. Строение молекулы (2-MeOC 6 H 4 ) 3 Sb[OC(O)CH 2 Cl] 2 (1)
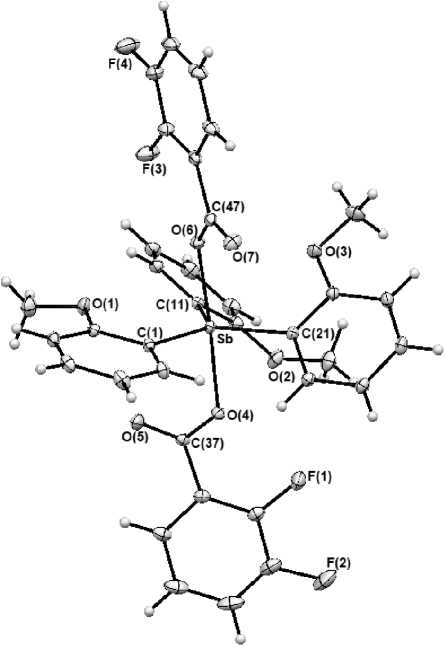
Рис. 3. Строение комплекса (2-MeOC 6 H 4 ) 3 Sb[OC(O)C 6 H 3 F 2 -2,3] 2 (3)
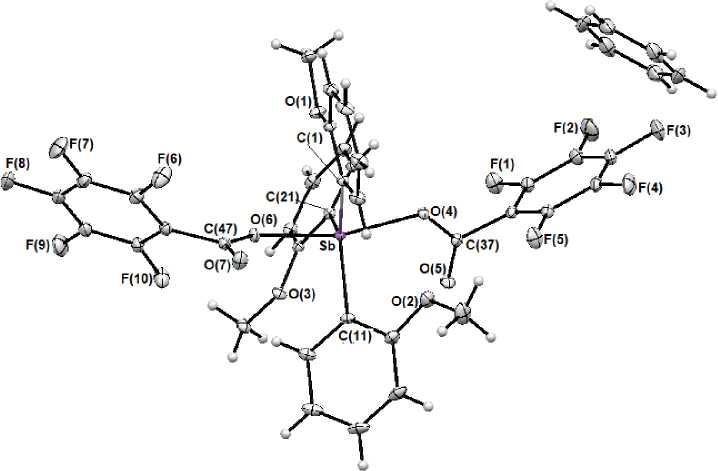
Рис. 4. Строение сольвата (2-MeOC 6 H 4 ) 3 Sb[OC(O)C 6 F 5 ] 2 ∙ ½PhH (4)
Аксиальные углы OSbO отличаются от линейного угла и составляют 175,15(5)°, 171,42(6)°, 176,97(6)°, 164,47(6)° в 1-4 соответственно. Валентные углы СSbС в экваториальной плоскости изменяются в интервалах 111,15(7)°-125,87(7)° (1), 108,99(10)°-131,29(10)° (2), 114,46(7)°-128,22(8)° (3), 115,31(9)°-125,10(9)° (4), а их суммы практически равны 360°. Выходы атомов сурьмы из экваториальной плоскости характеризуются малыми значениями: 0,019 Å, 0,059 А, 0,002 А, 0,003 А (в 1-4 соответственно). Интервалы изменения углов OSbC между эква- ториальными и аксиальными связями составляют 83,12(7)°-97,68(7)° (1), 85,61(9)°-102,28(9)° (2), 84,16(7)°-98,14(7)° (3), 83,40(8)°-100,46(9)° (4).
Расположение арильных колец относительно экваториальной плоскости во всех молекулах похоже: одно из арильных колец отклоняется от плоскости [C(1)C(11)C(21)] на угол чуть больше 10 ° (11,51 ° ( 1 ), 14,13 ° ( 3 ), 9,79 ° ( 4 ), за исключением 2 , где этот угол равен 23,71 ° ), два других арильных кольца составляют с экваториальной плоскостью большие углы (42,01 ° , 49,55 ° ( 1 ), 32,29 ° , 66,07 ° ( 2 ), 39,01 ° , 43,81 ° ( 3 ), (35,85 ° , 56,10 ° ( 4 )).
Известно, что для соединений с пентакоординированным центральным атомом возможны две конфигурации молекул: квадратная пирамида а и тригональная бипирамида б (рис. 5), энергии которых часто близки между собой, однако вторая оказывается энергетически немногим более стабильной, чем первая [39].
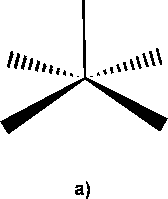
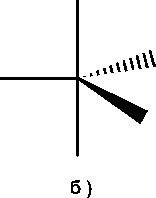
Рис. 5. Конфигурации квадратной пирамиды (а) и тригональной бипирамиды (б)
Для производных сурьмы общей формулы Ar3SbX2, где Х - электротрицательная группа, характерна, как правило, искаженная тригонально-бипирамидальная конфигурация [28]. Оценить степень искажения тригонально-бипирамидальной конфигурации и вклад в нее конфигурации квадратной пирамиды позволяет структурный параметр т, предложенный в работе [40], который определяется как отношение (а - в)/60, где а и в — величины двух наибольших углов между связями при атоме Sb (а > в). Для идеальной тетрагональной пирамиды т = 0 (а = в = 90 ° ), а в случае идеальной тригональной бипирамиды τ = 1 (аксиальный угол α = 180°, экваториальный β = 120°). Значения параметра т для исследуемых соединений 1 - 4 приведены в табл. 3.
Таблица 3
Валентные углы (град) в молекулах (2-MeOC 6 H 4 ) 3 Sb[OC(O)R] 2 и значение структурного параметра т
|
Соединение |
OSbO |
C(1)SbC(11) |
C(1)SbC(21) |
C(11)SbC(21) |
т |
|
1 |
175,15(5) |
111,15(7) |
125,87(7) |
122,95(7) |
0,82 |
|
2 |
171,42(6) |
131,29(10) |
119,48(9) |
108,99(10) |
0,67 |
|
3 |
176,97(6) |
128,22(8) |
114,46(7) |
117,32(8) |
0,76 |
|
4 |
164,47(6) |
115,31(9) |
125,10(9) |
119,59(9) |
0,65 |
В соответствии с рассчитанными значениями т , вклады тетрагонально-пирамидальной конфигурации в координационное окружение атома сурьмы в 1 - 4 составляют 18 - 35%.
Расстояния Sb-C, как и следовало ожидать, в молекулах 1 - 4 мало отличаются: 2,0966(17)-2,1194(18) А, среднее значение 2,111 А ( 1 ), 2,104(2)-2,126(2) А, 2,115 А ( 2 ), 2,0889(19)-2,1134(19) А, 2,102 А ( 3 ) и 2,109(2)-2,123(2) А, 2,117 А ( 4 ). Средние значения длин связей Sb-О в 1 - 4 равны 2,118(2) А (2,1088(15) и 2,1269(15) А), 2,118(2) А (2,1137(17) и 2,1232(18) А), 2,097(1) А (2,0880(14) и 2,1063(14) А), 2,125(2) А (2,1035(17) и 2,1460(17) А).
Известно, что карбоксилатные лиганды склонны к бидентатной координации на атом металла [28]. При этом в дикарбоксилатах триарилсурьмы лиганды, как правило, проявляют анизоби-дентатный характер связывания с высококой асимметрией координации. Лишь в редких случаях два расстояния М - О близки друг другу [7, 41, 42].
В молекулах 1-4 карбоксилатныые лиганды координированы асимметрично. В ряду 1-4 расстояния между атомом сурьмы и атомами кислорода карбонильных групп Sb---O=C увеличиваются 3,102 и 3,167 Å, 3,010 и 3,058 Å, 3,190 и 3,123 Å, 3,296 и 3,374 Å, что согласуется с возрас- танием электроноакцепторных свойств групп R в кислотах, уменьшающих донорные способности карбонильного атома кислорода.
Особеностью строения молекул 1 - 4 можно считать ориентацию карбоксильных групп относительно экваториальной плоскости. Так, в подавляющем большинстве дикарбоксилатов трифе-нилсурьмы углы между плоскостями карбоксильных групп ОСО не превышают 10 ° [28]. В 1 - 4 такие углы составляют 49,19 ° , 52,36 ° , 40,94 ° , 79,20 ° соответственно. Аналогичные большие значения указанных углов наблюдали в молекулах дикарбоксилатов трис (5-бром-2-метоксифенил)сурьмы [31 - 32], что, очевидно, обусловлено наличием метокси-групп в орто -положениях ароматических колец, которые создают стерические затруднения при ориентации карбоксилатных лигандов. Отметим, что расстояния Sb-OMe (3,103(2) - 3,127(2) А 1 , 3,058(2) - 3,202(2) А 2 , 3,019(2) - 3,120(2) А 3 , 3,079(2) - 3,172(3) А 4 ) меньше суммы ван-дер-ваальсовых радиусов атомов сурьмы и кислорода (3,58 Å [43]).
Основными межмолекулярными взаимодействиями в кристаллах 1 - 4 являются слабые водородные связи типа С - H- ' O и С - H- ' F. В кристалле 4 молекулы бензола участвуют в С - Н---Л-взаимодействиях типа «торец к плоскости», при этом расстояния между центроидами ароматических колец бензола и [С(21) - С(26)] молекулы бис (пентафторбензоата) трис (2-метоксифенил)сурьмы равны 4,89 А, а углы между плоскостями - 88,24 ° .
В ИК-спектрах дикарбоксилатов трис (2-метоксифенил)сурьмы 1 - 4 присутствуют интенсивные полосы поглощения, относящиеся к валентным колебаниям связи С=О: 1697, 1624, 1655, 1668 см–1 соответственно. По сравнению с колебаниями связи С=О в соответствующих карбоновых кислотах (1734, 1697, 1695, 1721 см-1) полоса поглощения в спектрах 1 - 4 смещена в низкочастотную область. Наличие фрагмента SbC 3 характеризуется присутствием в спектрах полос поглощения, находящихся в интервале 440–447 см–1. Наличие связей Sb–O подтверждается полосой поглощения в области 575–536 см–1.
Выводы
Окисление трис (2-метоксифенил)сурьмы трет -бутилгидропероксидом в присутствии хлоруксусной, 2-метоксибензойной, 2,3-дифторбензойной и пентафторбензойной кислот приводит к образованию дикарбоксилатов трис (2-метоксифенил)сурьмы с высокими выходами. В ИК-спектрах дикарбоксилатов трис (2-метоксифенил)сурьмы имеет место смещение полосы поглощения карбонильной группы по сравнению с аналогичной полосой в спектрах соответствующих кислот на 37 - 73 см-1. Атомы сурьмы в молекулах 1 - 4 имеют тригонально-бипирамидальную конфигурацию, искажение которой обусловлено вкладом тетрагонально-пирамидальной конфигурации (18 - 35 %). Карбоксилатные лиганды проявляют анизобидентатный характер связывания с атомом сурьмы (разница расстояний Sb - O и Sb—O=C составляет от 0,896 до 1,270 А). Особенностью строения молекул дикарбоксилатов трис (2-метоксифенил)сурьмы можно считать необычные для дикарбоксилатов триарилсурьмы большие значения углов между плоскостями карбоксильных групп, которые составляют 40,94 °- 79,20 ° . Кроме того, наличие коротких внутримолекулярных расстояний Sb—O=C и Sb-OMe позволяет записать координационное число атомов сурьмы как сумму двух координационных сфер 5+5.


