Окислительная деструкция n-аминобензолсульфамида пероксидом водорода в присутствии катионов Fe 3+
Автор: Дамбуева Дарима Викторовна
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Изучена окислительная деструкция n-аминобензолсулъфамида пероксидом водорода в водных растворах в присутствии катионов Fe 3+. Спектрофотометрическим методом показано, что окисление сульфаниламида протекает через промежуточное образование бензолсульфамида и сульфаниламидного комплекса Fe 3+. Установлено, что скорость окислительной деструкции сульфаниламида в присутствии катионов Fe 3+ возрастает до 30 раз по сравнению с некаталитическим окислением сульфаниламида. При стехиометрическом содержании H 2O 2 и содержании катионов Fe 3+ 4.5 10 -5 М конверсия сульфаниламида достигает 96% за 330 мин при рН 3.0 и 30 оС.
Окислительная деструкция, сульфаниламид, катионы fe 3+
Короткий адрес: https://sciup.org/148181818
IDR: 148181818 | УДК: 544.47:544.342
Текст научной статьи Окислительная деструкция n-аминобензолсульфамида пероксидом водорода в присутствии катионов Fe 3+
п-Аминобензолсульфамид (или сульфаниламид, стрептоцид) является структурной основой всех сульфаниламидных препаратов. Химическая структура сульфаниламида имеет вид:
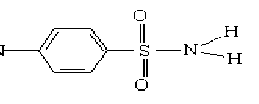
Сульфаниламидные препараты оказывают бактериостатическое и химиотерапевтическое действие при инфекциях, вызванных грамположительными и грамотрицательными бактериями, и применяются против простейших (например, токсоплазмоза), паразитов (например, возбудителей малярии) и грибовидных разрастаний [1, 2]. Кроме того, сульфаниламиды используются в ветеринарии как стимуляторы роста и сельском хозяйстве для борьбы с двудольными сорняками в посевах зерновых культур, кукурузы, льна, сои и др. [2, 3]. Благодаря своей способности растворяться в воде, сульфаниламиды и их метаболиты могут мигрировать в водной сфере и почве. Тем самым они создают угрозу для здоровья человека, повышая антибактериальную устойчивость патогенных микроорганизмов.
В литературе [4] описана деструкция сульфасалазина с концентрацией 2.51∙10-4 М пероксидом водорода в присутствии катионов Fe3+. Было определено, что конверсия сульфасалазина достигает 99,5% за 60 мин в условиях, где [H 2 O 2 ] = 16.0∙10-3 M, [Fe3+] = 2.0∙10-4 М, рН 3, 35oC. Полная деструкция сульфаниламидных соединений (сульфаметизол, сульфаметоксазол, сульфамоксол, сульфатиазол, сульфисоксазол) с концентрацией 1.0∙10-4 М была описана в системе Фентона (Fe2+/H 2 O 2 ) при рН 3, в которой применяется 30% Н 2 О 2 (9.75 М) и содержание Fe2+ составляет 4.0∙10-5 М [5]. В работе [6] была изучена реакция окисления сульфаметоксазола в системе Fe2+/H 2 O 2 при комнатной температуре, рН реакционной смеси был равен 3. Конверсия сульфаметоксазола составила 90% при концентрации Fe2+ 1.91∙10-4 М и Н 2 О 2 4.78∙10-4 М.
Целью работы являлось изучение окислительной деструкции сульфаниламида в системе Раффа (Н 2 О 2 /Fe3+).
Экспериментальная часть
В исследованиях был использован порошок сульфаниламида производства фармацевтической компании ООО «Люми» (г. Екатеринбург). Реакцию окисления сульфаниламида пероксидом водорода проводили в стеклянном термостатированном реакторе объемом 50 мл, оборудованном обратным холодильником и магнитной мешалкой. К 20 мл водного раствора сульфаниламида с концентрацией 2.9∙10-4 М приливали 1 мл раствора Fe(NO 3 ) 3 с концентрацией 1.8∙10-4 М и 0.23 мл Н 2 О 2 с концентрацией 0.45 М. Взятое количество пероксида водорода соответствовало стехиометрическому его количеству, которое необходимо для полной деструкции сульфаниламида.
C 6 H 8 O 2 SN 2 + 18H 2 O 2 → 6CO 2 + NH 4 NO 3 + H 2 SO 4 + 19H 2 O
Для достижения необходимого значения рН добавляли раствор H 2 SO 4 . Температура реакционной смеси составляла 30оС. Убыль концентрации субстрата в ходе реакции окисления определяли, измеряя оптическую плотность реакционной смеси на UV-Vis спектрофотометре Agilent 8453 (Agilent Technologies, США) при длине волны 258 нм (точность измерения ±10%).
Результаты и обсуждение
В спектре водного раствора сульфаниламида (рис. 1) наблюдаются две интенсивные полосы поглощения (п.п.), которые лежат в области 197 и 258 нм. Значение рН данного водного раствора сульфаниламида равно 6.0±0.1. Добавление раствора серной кислоты к раствору сульфаниламида до рН 3 показало, что спектры сульфаниламида при рН 6 и 3 идентичны друг другу.
На рис. 2 представлены спектры водных растворов сульфаниламида, катионов Fe3+ и их смеси. При добавлении катионов Fe3+ к раствору сульфаниламида наблюдается увеличение интенсивности п.п. в области 200 нм, что обусловлено образованием комплекса железа и сульфаниламида [1].
На рис. 3 представлены спектры электронного поглощения реакционной смеси (сульфаниламид, Fe3+, Н2О2), пробы которой были взяты в определенный момент времени и анализировались в ходе реакции окисления сульфаниламида. Интенсивная п.п. в области 190-210 нм соответствует электронным переходам в бензольном кольце [7]. Кроме того, в этой области происходит поглощение катионами Fe3+ и сульфаниламидным комплексом Fe3+. Согласно рис. 3а, в процессе окисления сульфани- ламида наблюдается снижение п.п. при 258 нм, принадлежащей переходу n→π* [8], что указывает на разрыв связи C-N. Увеличение интенсивности полосы в области 200 нм до 50 мин вызвано образованием не только металлоорганического комплекса, но и образованием промежуточного продукта – бензолсульфамида [7], после 50 мин наблюдается снижение этой полосы, что указывает на деструкцию бензолсульфамида и комплекса. Снижение интенсивности п.п. в этой области достигает 35% при [Fe3+] = 9.0∙10-6 М за 330 мин, а при увеличении концентрации катионов Fe3+ в 5 раз интенсивность полосы снижается до 75% (рис. 3б).
На рис. 4 приведены кинетические кривые конверсии сульфаниламида в присутствии катионов Fe3+. Для сравнения приведена кривая некаталитического окисления сульфаниламида. Конверсия сульфаниламида при некаталитическом окислении пероксидом водорода составила 3% за 330 мин. В то время как при добавлении катионов Fe3+ в систему наблюдается резкое снижение концентрации сульфаниламида в реакционной смеси. Кинетические кривые окисления сульфаниламида пероксидом водорода в присутствии катионов Fe3+ характеризуются наличием индукционного периода, что вызвано медленным образованием гидроксильных радикалов при взаимодействии пероксида водорода и катионов Fe3+ [9]. Далее следует активная фаза реакции, поскольку образовавшиеся радикалы быстро реагируют с сульфаниламидом.
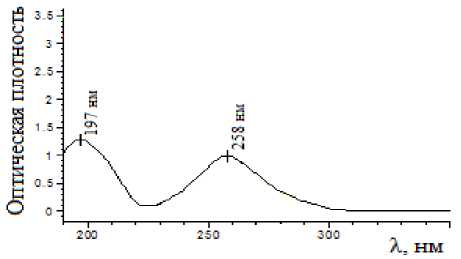
Рис. 1. Спектр водного раствора сульфаниламида при рН 6
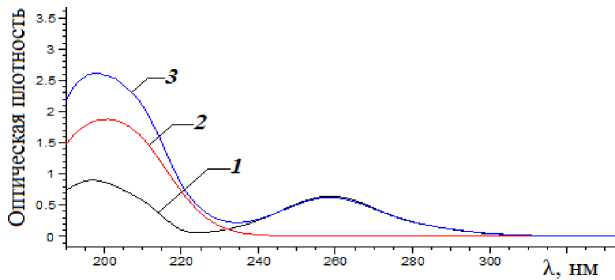
Рис. 2. Спектры водных растворов сульфаниламида и катионов Fe3+.
1 – cульфаниламид, 2 – катионы Fe3+, 3 – раствор сульфаниламида и катионов Fe3+ а б
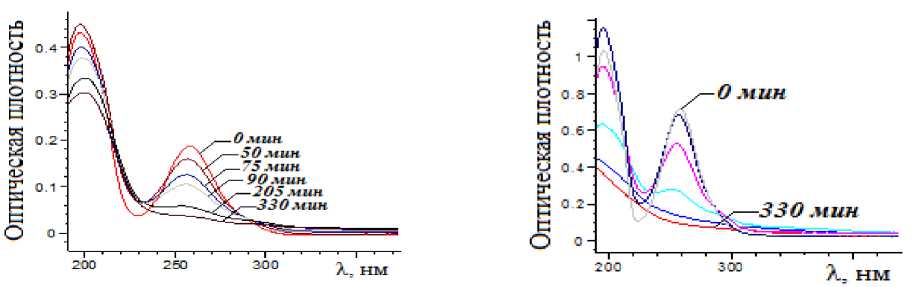
Рис. 3. Изменение спектров электронного поглощения сульфаниламида в реакции окисления пероксидом водорода в присутствии катионов Fe3+: а – [Fe3+] = 9.0∙10-6 М, б – [Fe3+] = 4.5∙10-5 М
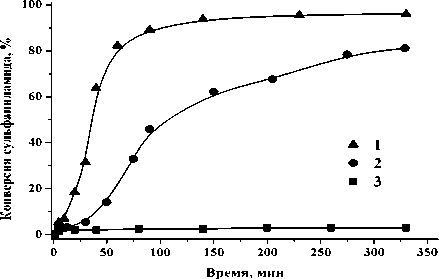
Рис. 4. Кривые конверсии сульфаниламида в окислительной деструкции сульфаниламида пероксидом водорода: 1 , 2 – в присутствии катионов Fe3+; 3 – без катионов Fe3+. Условия реакции: [сульфаниламид] = 2.9∙10-4 М, [H 2 O 2 ] = 5.23∙10-3 М, рН 3.0±0.1, 30оС: 1 – [Fe3+] = 4.5∙10-5 М, 2 – [Fe3+] = 9.0∙10-6 М
Продолжительность индукционного периода снижается с увеличением концентрации Fe3+ в реакционной смеси. Кроме того, при увеличении концентрации катионов Fe3+ до 4.5∙10-5 М конверсия сульфаниламида возрастает до 96% за 330 мин. Скорость окислительной деструкции сульфаниламида пероксидом водорода в присутствии катионов Fe3+ возрастает до 30 раз по сравнению с некаталитическим окислением сульфаниламида.
Выводы
-
1. Скорость окислительной деструкции сульфаниламида в присутствии катионов железа возрастает до 30 раз по сравнению с некаталитическим окислением.
-
2. При стехиометрическом содержании Н2О2 и содержании катионов Fe3+ 4.5∙10-5М конверсия сульфаниламида достигает 96% за 330 мин (рН 3.0±0.1, 30 оС).


