Окислительная и нитрогеназная активность бактерии o Chrobactrum sp . ИБ ДТ-5.3/2
Автор: Коршунова Татьяна Юрьевна, Четвериков Сергей Павлович, Мухаматдьярова Светлана Ринатовна, Логинов Олег Николаевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Изучена способность штамма Оchrobactrum sp. ИБ ДТ-5.3/2 к окислению нефти и ее фракций. Исследована азотфиксирующая активность бактерии и деградация углеводородов различной природы в ходе этого процесса. Показано увеличение потенциальной нитрогеназной активности почвы после ее инокуляции микроорганизмами Оchrobactrum sp. ИБ ДТ-5.3/2.
Диазотрофы, нефтедеструкторы, штамм оchrobactrum sp. иб дт-5.3/2, окислительная, нитрогеназная активность, ochrobactrum sp. иб дт-5.3/2
Короткий адрес: https://sciup.org/148202061
IDR: 148202061 | УДК: 579.84133
Текст научной статьи Окислительная и нитрогеназная активность бактерии o Chrobactrum sp . ИБ ДТ-5.3/2
В последнее время перед мировым сообществом все более остро стоит проблема утилизации экологически опасных поллютантов, а именно, соединений, отнесенных к группе стойких органических загрязнителей (СОЗ). Перечень СОЗ включает в себя 28 наименований, большинство из которых имеют техногенное происхождение, детектируются в составе компонентов природных геосистем, обладают токсичностью, биоаккумуляцией и устойчивостью к разложению [1]. Многие из этих поллютантов относятся к полициклической ароматике, галогенуглеводородам или фталатам. Последняя группа соединений вследствие интенсивного производства синтетических полимеров имеет весьма широкое распространение в объектах окружающей среды (воздухе, почве, водоемах, морской воде) [2, 3].
Наличие значительных количеств фталатов выявлено в районах интенсивной работы предприятий горнодобывающей промышленности. Данные соединения обнаружены в глинисто-солевых шламах, избыточных рассолах и отходах калийного производства (разработки Верхнекамского месторождения калийно-магниевых солей, Пермский край). Высокий уровень загрязнения отходов подобного производства обусловлен использованием в технологическом цикле обогащения калийных руд целой гаммы реагентов (оксиэтилированные жирные кислоты, нефтепродукты, диоксановые спирты и другие), продуктами трансформации которых и являются фталаты [4].
Фталаты и их метаболиты обладают гепатоток-сичными, тератогенными и канцерогенными свойствами и признаны потенциально опасными для человека и животных. Исследования показали, что данные соединения легко высвобождаются из изделий и попадают в организм человека с пищей,
через кожу и при вдыхании. Даже небольшие дозы фталатов могут приводить к изменению гормонального фона, нарушению работы печени и почек. Несмотря на это, производство продукции, содержащей фталаты, продолжается и в настоящее время [3].
Одним из эфиров фталевой кислоты, наиболее широко используемых в химической промышленности, является дибутилфталат (ДБФ). Он обладает высокой растворяющей способностью и низкой вязкостью, что обусловливает его применение для изменения свойств полимеров с целью повышения их эластичности, морозостойкости, а также понижения температуры переработки в готовые изделия. ДБФ применяется в резинотехническом производстве, а также при изготовлении искусственных пленок и кож. Большие объемы этого вещества используют предприятия, изготавливающие кабельные пластикаты, эфир целлюлозы, линолеум, лаки и искусственные смолы. Кроме этого, дибутилфталат применяется как репеллент и растворитель, имеющий высокую температуру кипения.
Разложение ДБФ может осуществляться как с помощью химических методов (гидролиз, фотолиз и т.п.), так и биологическими методами (микробная деструкция).
Известно, что период полураспада данного экотоксиканта в окружающей среде составляет от нескольких месяцев до 20 лет и основную роль в процессе разложения ДБФ выполняют бактерии-деструкторы [3].
Среди бактерий, способных осуществлять разложение фталатов (дибутилфталата), выявлены представители родов Sphingomonas, Comamonas, Pseudomonas, Arthrobacter, Rhodococcus, Gordonia, Bacillus, Delftia, Acinetobacter [3]. Метаболические пути разложения дибутилфталата сочетают два процесса: первичная биодеградация ДБФ до монобутилфталата и последующая его деструкция до орто-фталевой кислоты (о-ФК), являющейся ключевым интермедиатом. Разложение о-ФК аэробны- ми бактериями осуществляется через образование протокатеховой кислоты до основных продуктов жизнедеятельности микробной клетки (рис.) [5].
Таким образом, одним из приоритетных направлений исследований в развитии новых экобиотехнологий детоксикации опасных поллютантов является изучение бактериальной деструкции фта- латов на примере дибутилфталата (ДБФ) как широко распространенного загрязнителя [5].
Цель настоящей работы – выделение и характеристика бактерий-деструкторов орто- фталата и дибутилфталата из районов промышленных разработок Верхнекамского месторождения калийно-магниевых солей.
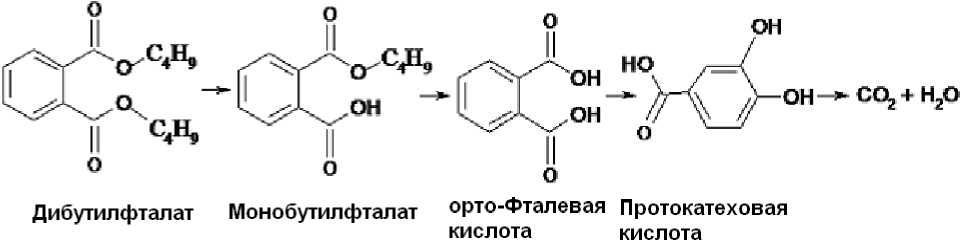
Рис. Схема бактериальной деградации дибутилфталата (по [5])
В качестве материалов для исследования были использованы образцы техногенно-минеральных образований (ТМО) из шламохранилищ соледобывающего предприятия ОАО «Уралкалий» (г. Березники, Пермский край), а также образцы почвы и грунта, отобранные около солеотвалов (г. Соликамск, Пермский край). Выделение бактерий проводили как методом прямого высева, так и методом накопительного культивирования на минеральной среде Раймонда с о -фталатом [6]. Для более подробного изучения были отобраны штаммы микроорганизмов, способных к активному росту на орто фталевой кислоте как основном интермедиате метаболического пути разложения ДБФ (рис. 1).
Оценка роста при культивировании на агаризо-ванной минеральной среде Раймонда проводилась по формированию колоний: слабый рост «+» – колонии размером менее 1 мм, средний рост «++» – колонии размером 1-2 мм, хороший рост «+++» – колонии размером более 2 мм, «–» – отсутствие роста, а также при культивировании в жидкой минеральной среде Раймонда. В качестве субстратов использовали о -ФК в концентрации 1 г/л и ДБФ в концентрации 0.2 г/л. NaCl добавляли до конечной концентрации 30 г/л.
Оптическую плотность (ОП) культуральной жидкости определяли на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при 600 нм в кювете с длиной оптического пути 10 мм.
Устойчивость бактерий к NaCl (0-12%) определяли на богатой агаризованной среде Раймонда, в составе которой присутствуют триптон (5.0 г/л) и дрожжевой экстракт (2.5 г/л).
Филогенетический анализ полученных изолятов был основан на определении нуклеотидных последовательностей гена 16S рРНК с применением набора реактивов Big Dye Terminator Cycle Sequencing Kit на автоматическом секвенаторе Genetic Analyser 3500XL («Applied Biosystems»,
США). Полученные нуклеотидные последовательности были проанализированы с использованием программ CLUSTAL W, Sequence Scanner v1.0. Поиск гомологичных последовательностей производили по базам данных GenBank [7] и EzTaxon [8].
В ходе проведенной работы из исследуемых образцов было выделено 17 штаммов бактерий, способных к активному росту на о -ФК в качестве единственного источника углерода и энергии (таб. 1). Было показано, что оптическая плотность (ОП 600 ) бактериальных культур, растущих в жидкой минеральной среде Раймонда с о -ФК, составляла от 0.2 до 0.4 о.е. Далее все 17 штаммов-деструкторов о- ФК были проверены на способность к росту на дибутилфталате в концентрации 0.2 г/л в качестве субстрата (табл. 1).
Среди исследуемых изолятов выявлены наиболее активные штаммы-деструкторы (ВО25, 2RN2– 1, 9RN1–12, 9RN3–21, 9RN9–111, 18CN2–222), различные по грампринадлежности и морфологическим признакам, но характеризующиеся эффективным ростом на о -ФК и ДБФ.
Выделенные бактерии способны к росту как при отсутствии в среде хлорида натрия, так и при его повышенной концентрации, т.е. являются галото-лерантными микроорганизмами. Большинство исследуемых штаммов растет в диапазоне концентрации NaCl от 0% до 6%. Три изолята (ВО4, ВО141, ВО33) более устойчивы к повышенной минерализации и растут в присутствии 120 г/л соли в среде культивирования.
Ранее нами был подробно исследован штамм Rhodococcus wratislavensis KT112-7, выделенный из ТМО шламохранилища предприятия БКРУ-1 ОАО «Уралкалий» (г. Березники, Пермский край). Было показано, что R. wratislavensis КТ112-7 осуществляет утилизацию высоких концентраций о -ФК (до 8 г/л) и растет на данном субстрате при содержании
Таблица 1 . Штаммы бактерий, выделенные из ТМО, почвы и грунта района солеразработок (ОАО «Уралкалий», Пермский край)
|
Штамм |
Источник выделения |
Рост на о-ФК |
Рост на ДБФ |
|
ВО1 |
ТМО, шламохранилище БКПРУ-2 (г. Березники), образец № 1, глубина отбора пробы 0,5 м |
+++ |
++ |
|
ВО4 |
+++ |
+ |
|
|
ВО9 |
+++ |
++ |
|
|
ВО11 |
+++ |
– |
|
|
ВО141 |
+++ |
– |
|
|
ВО19 |
++ |
++ |
|
|
ВО25 |
ТМО, шламохранилище БКПРУ-2 (г. Березники), образец № 2, глубина отбора пробы 0,2 м |
+++ |
+++ |
|
ВО33 |
ТМО, шламохранилище БКПРУ-2 (г. Березники), образец №3, глубина отбора пробы 0,4 м |
++ |
+++ |
|
ВО34-1 |
++ |
+++ |
|
|
ВО34-2 |
++ |
+++ |
|
|
КТ723 |
ТМО, шламохранилище БКПРУ-1 (г. Березники), образец №4, глубина отбора пробы 0,1 м |
+++ |
++ |
|
2RN2–1 |
Почва, 10 м от солеотвала (СКПРУ-2, г. Соликамск) |
+++ |
+++ |
|
9RN1–12 |
+++ |
+++ |
|
|
9RN3–21 |
+++ |
+++ |
|
|
9RN9–111 |
+++ |
+++ |
|
|
9CN1 |
Грунт, 15 м от солеотвала (СКПРУ-2, г. Соликамск) |
++ |
++ |
|
18CN2–222 |
Грунт, берег р. Черной, 30 м от солеотвала (СКПРУ-2, г. Соликамск) |
+++ |
+++ |
NaCl в среде культивирования до 75 г/л.Штамм обладает широкой субстратной специфичностью и растет на нафталине, бифениле, бензоле, толуоле, феноле, бензойной кислоте, 2,5-гидроксибензойной кислоте (ГБК), 3,4-ГБК, 4-ГБК [6]. В результате настоящего исследования было показано, что штамм KT112-7 также способен к росту и на ДБФ как единственном источнике углерода и энергии.
Все изолируемые в настоящей работе штаммы были идентифицированы на основе анализа гена 16S рРНК. Установлено, что штаммы являются представителями классов Actinobacteridae, Bacilli и Gammaproteobacteria. Среди актинобактерий выявлено пять штаммов рода Rhodococcus, четыре штамма рода Arthrobacter и один штамм рода Dietzia (таб. 2). Изоляты филогенетические близкие к спорообразующим бактериям класса Bacilli порядка Bacillales представлены двумя родами Bacillus и Exiguobacterium. Кроме того, выявлены представители класса Gammaproteobacteria, относящиеся к порядкам Oceanospirillales (род Halomonas) и Pseudomonadales (род Pseudomonas) (табл. 2).
Таблица 2 . Филогенетический анализ выделенных бактерий-деструкторов
|
Штамм |
Идентификация по гену 16S рРНК |
||
|
Типовой штамм |
Сходство, % |
Количество анализируемых нуклеотидов |
|
|
ВО1 |
Rhodococcus wratislaviensis NCIMB 13082T |
99,7 |
670 |
|
ВО4 |
Bacillus firmus NCIMB 9366T |
99.3 |
908 |
|
ВО9 |
Dietzia maris DSM 43672T |
99.8 |
887 |
|
ВО11 |
Pseudomonas xanthomarina KMM 1447T |
99 |
1434 |
|
ВО141 |
Bacillus flexus IFO 15715T |
100 |
722 |
|
ВО19 |
Arthrobacter oxydans DSM 20119T |
100 |
1233 |
|
ВО25 |
Arthrobacter nicotianae DSM 20123T |
99.1 |
1387 |
|
ВО33 |
Bacillus vietnamiensis 15-1T |
99 |
604 |
|
ВО34-1 |
Arthrobacter oxydans DSM 20119 T |
100 |
1401 |
|
ВО34-2 |
Arthrobacter oxydans DSM 20119T |
100 |
1401 |
|
КТ723 |
Rhodococcus wratislaviensis NCIMB 13082T |
99.7 |
669 |
|
2RN2–1 |
Bacillus vietnamensis 15-1T |
100 |
162 |
|
9RN1–12 |
Rhodococcus wratislaviensis NCIMB 13082T |
99.9 |
1323 |
|
9RN3–21 |
Rhodococcus wratislaviensis NCIMB 13082T |
99.9 |
1321 |
|
9RN9–111 |
Rhodococcus wratislaviensis NCIMB 13082T |
100 |
1344 |
|
9CN1 |
Exiguobacterium mexicanum 8NT |
100 |
814 |
|
18CN2–222 |
Halomonas boliviensis LC1T |
99.6 |
796 |
Таким образом, в результате проведенного исследования выделены в чистую культуру и охарактеризованы перспективные для использования в новых биотехнологиях защиты окружающей среды бактерии-деструкторы дибутилфталата – широко распространенного токсичного загрязнителя. Исследованные в настоящей работе галотолерантные штаммы-деструкторы могут применяться для биоремедиации почв и грунтов с повышенной минерализацией.
Работа выполнена в рамках научного проекта молодых ученых УрО РАН №13-4-НП-448.
-
1. URL: http://chm.pops.int/
-
2. Барштейн Р.С., Кирилович В.И., Носовский Ю.Е . Пла
стификаторы для полимеров. М.: Химия, 1982. 197 с.
-
3. Liang D.-W., Zhang T., Fang H . Phthalates biodegradation in the environment // Appl. Microbiol. Biotechnol. 2008. V. 80. P. 183-198.
-
4. Бачурин Б.А., Одинцова Т.А . Стойкие органические загрязнители в отходах горного производства // Современные экологические проблемы Севера. Апатиты: Изд-во Кольского НЦ РАН, 2006. Ч. 2. С. 7-9.
-
5. Jin D.-C., Liang R.-X. Biodegradation of Di-n-Butyl Phthalate by Rhodococcus sp. JDC-11 and Molecular Detection of 3,4-Phthalate Dioxygenase Gene // Microbiol. Biotechnol. 2010. V. 20. N 10. P. 1440-1445.
-
6. Егорова Д.О., Корсакова Е.С., Демаков В.А., Плотникова Е.Г. Деструкция ароматических углеводородов штаммом Rhodococcus wratislaviensis КТ112-7, выделенным из отходов соледобывающего предприятия // Прикладная биохимия и микробиология. 2013. Т. 49. № 3. С. 267-278.
-
7. URL: http://www.ncbi.nlm.nih.gov/
-
8. URL: http://www.eztaxon.org/
BACTERIA-DESTRUCTORS OF PERSISTENT ORGANIC POLLUTANTS – PHTHALIC ACID ESTERS, AS A BASIS FOR THE CREATION OF NEW ECOBIOTECHNOLOGY
Institute of Ecology and Genetics of Microorganisms, Ural Branch of RAS, Perm
In this article we analyzed the problem of microbial degradation of environmentally dangerous pollutants by the example of dibutyl phthalate as one of the most common pollutants, including waste potash production. From the samples of technogenic mineral formations, soil and ground of a salt-mining plant JSC "Uralkali" (Berezniki, Solikamsk, Perm krai) there were isolated active halotolerant strains-destructors of dibutyl phthalate being promising for creation a biotechnology based on microbial degradation of toxicants. Following a phylogenetic analysis of the isolated bacteria the strains-destructors were assigned to the genera Rhodococcus , Arthrobacter , Dietzia , Bacillus , Exiguobacte-rium , Halomonas and Pseudomonas .
Список литературы Окислительная и нитрогеназная активность бактерии o Chrobactrum sp . ИБ ДТ-5.3/2
- Eurosoil 2008: soil -society -environment/Eds W.H. Blum, M.H. Gerzabek, M. Vodrazka. Vienna: BOKU, 2008. 400 p.
- Сулейманов Р.Р., Габбасова И.М., Ситдиков Р.Н. Изменение свойств нефтезагрязнённой серой лесной почвы в процессе биологической рекультивации//Известия РАН. Сер. биол. 2005. № 1. С 109-115.
- Stroud J.L., Paton G.I., Semple K.T. Microbe-aliphatic hydrocarbon interactions in soil: implications for biodegradation and bioremediation//J. Appl. Microbiol. 2007. V. 102. N 5. P. 1239-1253.
- Нечаева И.А., Филонов А.Е., Ахметов Л.И. и др. Стимуляция микробной деструкции нефти в почве путем внесения бактериальной ассоциации и минерального удобрения в лабораторных и полевых условиях//Биотехнология. 2009. № 1. С. 64-70.
- Ouyang W., Liu H., Murygina V. et al. Comparison of bioaugmentation and composting for remediation of oily sludge: A field-scale study in China//Process Biochem. 2005. V. 40. N 12. P. 3763-3768.
- Aichberger H., Hasinger M., Braun R., Loibner A.P. Potential of preliminary test methods to predict biodegradation performance of petroleum hydrocarbons in soil//Biodegradation. 2005. V. 16. N 2. P. 115-125.
- Chaineau C.H., Yepremian C., Vidalie J.F. et al. Bioremediation of a crude oil-polluted soil: Biodegradation, leaching and toxicity assessments//Water, Air and Soil Pollution. 2003. V. 144. N 1. Р. 419-440.
- Ваккеров-Коузова Н.Д. Азотфиксирующая бактерия Ochrobactrum intrmedium ANKI, способная к трансформации азобензола//Прикладная биохимия и микробиология. 2007. Т. 43. № 4. С. 450-454.
- Favaloro B., Tamburro A., Trofino M.A. et al. Modulation of the glutathione S-transferase in Ochrobactrum anthropi: function of xenobiotic substrates and other forms of stress//Biochem. J. 2000. V. 346. N 2. P. 553-559.
- Van Hamme J.D., Odumeru J.A., Ward O.P. Community dynamics of a mixed-bacterial culture growing on petroleum hydrocarbons in batch culture//Can. J. Microbiol. 2000. V. 46. N 5. P. 441-450.
- Trujillo M.E., Willems A., Abril A. et al. Nodulation of Lupinus by strains of the new species Ochrobactrum lupini sp. nov.//Appl. Env. Microbiol. 2005. V. 71. N 3. P. 1318-1327.
- Коршунова Т.Ю., Мухаматдьярова С.Р., Логинов О.Н. Новый штамм бактерии рода Ochrobactrum: свойства и филогенетическое положение//Известия УНЦ РАН. 2013. № 2. С. 90-94.
- Дзержинская И.С. Питательные среды для выделения и культивирования микроорганизмов. Астрахань: Изд-во АГТУ, 2008. 348 с.
- Умаров М.М. Ассоциативная азотфиксация. М.: Изд-во Моск. ун-та, 1986. 136 с.
- Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons//Develop. Industr. Microbiol. 1961. V. 2. N 1. P. 23-32.
- Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практи кум по микробиологии: учеб. пособие для вузов. М.: Дрофа, 2004. 256 с.
- Bellenger J.P., Wichard T., Kraepiel A.M.L. Vanadium Requirements and Uptake Kinetics in the Dinitrogen-Fixing Bacterium Azotobacter vinelandii//Appl. Env. Microbiol. 2008. V. 74. N 5. P. 1478-1484.


