Окислительная модификация белков и липидов плазмы крови больных раком легкого
Автор: Белоногов Р.Н., Титова Н.М., Дыхно Ю.А., Лапешин П.В., Кудряшова Е.В., Савченко А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (34), 2009 года.
Бесплатный доступ
С целью определения уровня показателей окислительной модификации белков и липидов в плазме крови 58 больных раком легкого оценивалось содержание диеновых конъюгатов, малонового диальдегида, карбонильных производных бел- ков, среднемолекулярных пептидов, битирозина, SH-групп белков. Изменение содержания данных показателей свидетель- ствует об увеличении интенсивности свободнорадикальных процессов и варьирует в зависимости от стадии заболевания. Содержание продуктов окисления липидов возрастает при раке легкого IV стадии со смещением равновесия в сторону образования конечных продуктов липопероксидации. Также отмечен рост интенсивности окислительной модификации белков относительно контрольной группы, увеличение уровня карбонильных производных белков и снижение содержания битирозина и SH-групп белков. Уровень среднемолекулярных пептидов возрастает при II стадии заболевания и в дальней- шем практически не изменяется.
Рак легкого, перекисное окисление липидов, окислительная модификация белков
Короткий адрес: https://sciup.org/14056748
IDR: 14056748 | УДК: 616.24-006.6:616.15
Текст научной статьи Окислительная модификация белков и липидов плазмы крови больных раком легкого
Рак легкого является одной из основных причин смертности от онкологических заболеваний. Несмотря на большое количество исследований, касающихся этой проблемы, остается множество вопросов, связанных с диагностикой и лечением данной патологии. В процессе злокачественного роста происходит изменение показателей антио-кислительной активности и окислительного статуса опухоли, что может отражаться на органах и тканях организма. Данные литературы свидетельствуют, что свободнорадикальное окисление играет важную роль в процессах возникновения и развития опухоли [8]. При окислительном стрессе происходит свободнорадикальное окис- ление различных биомолекул. Причем имеются исследования, свидетельствующие, что в первую очередь окислительной модификации подвергаются молекулы белков [3, 6, 11]. Белки плазмы, подвергшиеся окислительной деструкции, имеют длительный период распада, по сравнению с продуктами перекисного окисления липидов (ПОЛ), что делает их перспективным маркером интенсивности свободнорадикального окисления [6]. Тем не менее характер и выраженность этих процессов при раке легкого практически не изучены.
Целью работы явилось определение уровня показателей окислительной модификации бел- ков и липидов в плазме крови больных раком легкого на различных стадиях заболевания.
Материал и методы
На базе Красноярского краевого онкологического диспансера обследовано 58 больных мужского пола, с диагнозом рак легкого, в возрасте 35–60 лет. У 20 больных раком легкого диагностирована II стадия процесса, у 20 – III стадия, у 18 – IV стадия заболевания. В качестве контроля было обследовано 18 здоровых лиц мужского пола. Кровь забиралась из локтевой вены в гепаринизированные пробирки, утром натощак, на следующий день после поступления больного в стационар. Плазма крови отделялась центрифугированием, после чего в ней проводилось определение показателей ПОЛ (диеновые конъюгаты, малоновый диальдегид) и окислительной модификации белков (ОМБ) (карбонильные производные, среднемолекулярные пептиды, битирозин, тиоловые группы).
Содержание диеновых конъюгатов (ДК) оценивали по интенсивности поглощения при длине волны 232 нм в гептановом экстракте липидов тканей [7]. Содержание малонового диальдегида (МДА) определяли по реакции с 2-тиобарбитуровой кислотой, в результате которой образуется окрашенный комплекс с максимумом поглощения при длине волны 532 нм [9]. Об уровне карбонильных производных белков (КПБ) судили по реакции взаимодействия окисленных аминокислотных остатков белков с 2,4-динитрофенилгидразином с образованием 2,4-динитрофенилгидразонов, которые регистрировали спектрофотометрически при длине волны 370 нм [13]. Содержание битирозина оценивалось спектрофлуориметрически (спек-трофлуориметр Aminco Bowman Series 2) при длине волны возбуждения 325 нм и при длине волны испускания 416 нм в 1/15 М фосфатном буфере, рН 7,4 [2]. О содержании среднемолекулярных пептидов (СМП) судили на основании прямой спектрометрии депротеинизированного супернатанта, полученного после осаждения белков раствором трихлоруксусной кислоты при длине волны 254 нм [4]. Определение количества восстановленных тиоловых групп белков осуществляли по взаимодействию SH-групп с 5,5'-дитио-бис-2-нитробензойной кислотой.
Оптическую плотность пробы измеряли спектрофотометрически при 412 нм.
Для всех полученных данных определяли среднее арифметическое значение (М) и ошибку средней арифметической (m). Проверку гипотезы о статистической достоверности величин исследуемых показателей несвязанных выборок проводили с помощью критерия Манна–Уитни. Статистический анализ осуществляли в пакете прикладных программ Statistica 7.0 (StatSoft Inc., 2004).
Результаты и обсуждение
У больных раком легкого (РЛ) наблюдается усиление процессов перекисного окисления липидов (рис. 1, 2). Было установлено достоверное возрастание концентрации ДК и МДА. Содержание ДК при раке легкого II стадии примерно на 97 % выше, чем в контрольной группе,
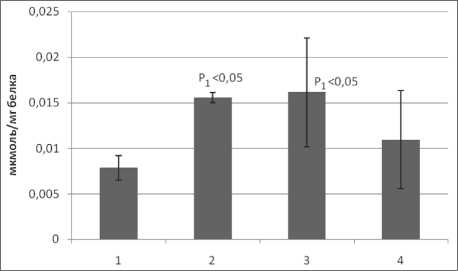
Рис. 1. Содержание диеновых конъюгатов в плазме крови больных раком легкого: 1 – контрольная группа; 2 – больные раком легкого II стадии; 3 – больные раком легкого III стадии;
3 – больные раком легкого IV стадии
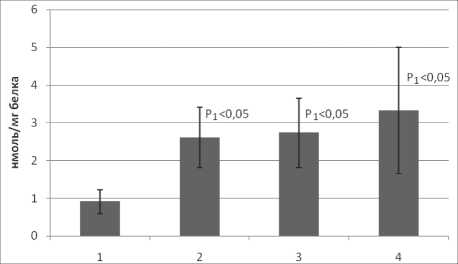
Рис. 2. Содержание МДА в плазме крови больных раком легкого: 1 – контрольная группа; 2 – больные раком легкого II стадии; 3 – больные раком легкого III стадии; 3 – больные раком легкого IV стадии
Р.Н. БЕЛОНОГОВ, Н.М. ТИТОВА, Ю.А. ДЫХНО И ДР.
уровень МДА превышает контрольные показатели на 185 %. В дальнейшем наблюдается рост интенсивности перекисных процессов, а также увеличение разброса значений данных. При РЛ IV стадии происходит некоторое уменьшение уровня ДК, что, по всей видимости, свидетельствует о смещении равновесия в направлении образования конечных продуктов липоперокси-дации, таких как МДА. При этом статистически достоверные изменения выявляются только относительно контрольных показателей.
Помимо активации процессов перекисного окисления липидов, также наблюдается увеличение интенсивности окислительной модификации белков, о чем свидетельствует возрастание содержания КПБ в плазме. Дополнительно, в качестве показателя, отражающего степень фрагментации белков, исследовался уровень среднемолекулярных пептидов (таблица). При РЛ II стадии содержание КПБ возрастает на 81 %. У больных II–III стадии эти показатели несущественно отличаются друг от друга, но при IV стадии вновь происходит значительный рост уровня КПБ, он на 107 % выше, чем при III стадии. Наряду с повышением уровня КПБ в плазме крови отмечалось увеличение концентрации среднемолекулярных пептидов, высокий уровень которых является отражением степени фрагментации белков [5]. В отличие от КПБ содержание СМП возрастало при РЛ II стадии на 85 %, затем этот показатель оставался практически на неизменном уровне, незначительно снижаясь при IV стадии процесса.
Наличие окислительного стресса также подтверждается увеличением уровня битирозина и снижением содержания восстановленных тиоловых групп в белках (рис. 3, 4). Содержание
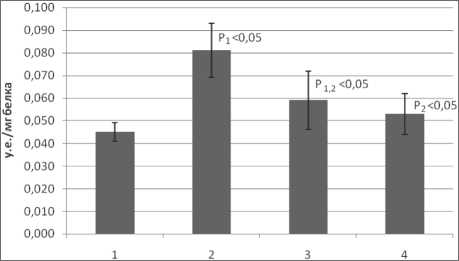
Рис. 3. Содержание битирозина в плазме крови при раке легкого: 1 – контрольная группа; 2 – больные раком легкого II стадии; 3 – больные раком легкого III стадии; 4 – больные раком легкого IV стадии
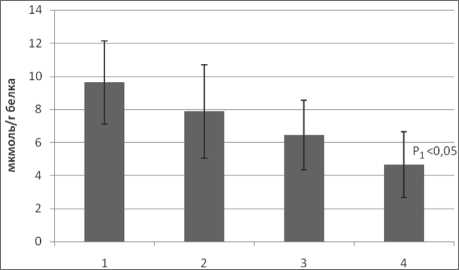
Рис. 4. Содержание тиоловых групп белков в плазме крови при раке легкого: 1 – контрольная группа; 2 – больные раком легкого II стадии; 3 – больные раком легкого III стадии;
4 – больные раком легкого IV стадии битирозина в плазме существенно возрастает при II стадии, а затем постепенно снижается при РЛ IV стадии. Динамика изменения содержания тиоловых групп аналогична таковой для битирозина.
Изменения, происходящие в плазме, характеризуют увеличение интенсивности окисли-
Таблица
Содержание карбонильных производных белков и среднемолекулярных пептидов в плазме крови больных раком легкого
|
Показатели |
Контрольная группа (n=18) |
РЛ II стадии (n=20) |
РЛ III стадии (n=20) |
РЛ IV стадии (n=18) |
|
КПБ (у.е./мг белка) |
0,014 ± 0,002 |
0,029 ± 0,013 р1<0,05 |
0,028 ± 0,011 р1<0,05 |
0,058 ± 0,011 р 1,2,3 <0,05 |
|
СМП (у.е./мг белка) |
0,196±0,008 |
0,363 ± 0,064 р1<0,05 |
0,361 ± 0,045 р1<0,05 |
0,349 ± 0,078 р1<0,05 |
Примечание: р1 – различия статистически значимы по сравнению с показателями контрольной группы; р2 – различия статистически значимы по сравнению с показателями при РЛ II стадии; р3 – различия статистически значимы по сравнению с показателями при РЛ III стадии.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2009. №4 (34)
тельного стресса в организме. Повышенный уровень продуктов ПОЛ в плазме крови в первую очередь свидетельствует об усилении окислительной модификации липопротеинов низкой плотности, в результате чего те могут становиться цитотоксичными и создавать потенциальную угрозу организму [3]. Колебания уровней различных продуктов окислительной модификации белков имеют свои особенности, что, вероятно, связано с условиями их образования. Так, битирозин образуется, главным образом, при прямом воздействии активных форм кислорода (АФК) на белковые молекулы. В то же время образование карбонильных производных белков может осуществляться как путем прямого окисления аминокислотных остатков, так и при взаимодействии с продуктами липопе-роксидации (МДА, 4-гидрокси-2-ноненалем) и гликооксидации. Их содержание может служить показателем общего окислительного стресса [10, 14]. Окисление тиоловых групп в отличие от других форм окислительной модификации белков является обратимым процессом. Обратимое окисление/восстановление может защищать белки от других, более сильных повреждающих форм окислительной модификации, например образования карбонильных производных [12]. Наличием тиоловых групп обусловлены антиоксидантные свойства альбумина. Помимо этого, SH-содержащие соединения также могут вовлекаться в ферментативное восстановление фенольных антиоксидантов [1].
Полученные результаты свидетельствуют о сложном и системном характере нарушений антиоксидантной системы при раке легкого. В ходе заболевания происходят изменения всех исследованных показателей окисления белков и липидов, которые, в свою очередь, зависят от стадии патологического процесса, причем чем больше стадия, тем сильнее выражено окислительное повреждение биологических молекул. Вероятно, такая динамика окислительных процессов связана с тем, что опухоль в процессе своего роста потребляет большое количество необходимых для этого веществ, в том числе и антиоксидантов, тем самым снижая общую антиокислительную активность крови [8]. Поскольку и содержание битирозина и тиоловых групп белков уменьшается по мере прогрессирования заболевания от II к IV стадии, можно предположить, что тиоловые группы обеспечивают защитное действие против непосредственного воздействия АФК на белки. В то же время увеличение уровня карбонильных производных при раке легкого IV стадии, по-видимому, может являться следствием усиления образования аддуктов белков с продуктами окисления других биомолекул, например липидов и углеводов [14]. Таким образом, определение различных показателей ПОЛ и ОМБ в плазме крови позволяет более полноценно охарактеризовать состояние окислительного стресса в организме больных раком легкого, что в перспективе может быть использовано и в диагностических целях.


