Окислительная модификация белков сердечной и скелетной мускулатуры крыс под влиянием субстрата синтеза оксида азота
Автор: Арапова А.И., Фомина М.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
Целью исследования явилось изучение влияния L-аргинина на окислительную модификацию белков сердца и скелетной мышцы. Исследование было выполнено на крысах-самцах линии Wistar, содержавшихся в типовых условиях вивария и разделённых на контрольную и экспериментальную группы, по 12 особей в каждой. Экспериментальные выборки включали группы с введением L-аргинина в дозе 500 мг/кг. Показатели изучали в цитоплазматической фракции гомогената миокарда и скелетной мускулатуры крыс. Окислительную модификацию белков в цитоплазматической фракции оценивали по методу R.L. Levine в модификации Е.Е. Дубининой, после осаждения нуклеиновых кислот 10%-ным раствором стрептомицина сульфата. По полученным значениям экс-тинкций строили спектр окислительной модификации белков и подсчитывали площадь под кривой, выражая значения в условных единицах на грамм белка (у.е./г белка). Оценка резервно-адаптационного потенциала производилась путем подсчета отношения общей площади под кривой карбонильных производных белков при спонтанном окислении протеинов к индуцированному по реакции Фентона, принимая общее количество динитрофенилгидразонов за 100%. Установлено, что воздействие L-аргинина вызывает снижение окислительной модификации белков в скелетной мышце крыс без изменений резервно-адаптационного потенциала; при этом в миокарде отмечено нарастание содержания карбонильных производных белков и истощение резервно-адаптационного потенциала.
Миокард и скелетная мышца крыс, аргинин, маркеры окислительной модификации белков, резервно-адаптационный потенциал
Короткий адрес: https://sciup.org/147204757
IDR: 147204757 | УДК: 577.1:547.495.9
Текст научной статьи Окислительная модификация белков сердечной и скелетной мускулатуры крыс под влиянием субстрата синтеза оксида азота
тельных повреждений, что связано с достаточно активным образованием карбонильных производных и их стабильностью [Дубинина, Пустыгина, 2008; Абаленихина, Фомина, Исаков, 2013].
Окислительная модификация белков (ОМБ) является одним из наиболее ранних проявлений поражения тканей при свободно-радикальной патологии [Губский и др., 2005]. Процесс старения заметно увеличивает рост чувствительности белков к окислению, в результате чего происходит накопление в тканях их окисленных форм. Достоверно известно, что количество окисляющихся белков в клетке обусловлено генетически и является ее постоянной фенотипической характеристикой [Еременко, Малоштан, 2014].
Накопление окисленных протеинов трактуется в качестве фактора регуляции синтеза и распада белков и активации протеолитических ферментов, которые избирательно разрушают окисленные формы. Этот механизм является проявлением антиоксидантной защиты организма, поэтому оценка степени ОМБ может считаться одним из наиболее надежных индикаторов свободно-радикального повреждения тканей, клеток и мембран [Еременко, Малоштан, 2014].
Материалы и методы исследований
Работа была выполнена на 24 конвенциональных половозрелых крысах-самцах линии Wistar массой 280-320 г, разделенных на две группы: контрольную и экспериментальную. Содержание лабораторных животных и выведение из эксперимента осуществлялось согласно «Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник» от 06.04.1993; и в соответствии с правилами, изложенными Международным Советом Медицинских Научных Обществ (CIOMS) в «Международных рекомендациях по проведению медикобиологических исследований с использованием животных» (1985 г.) и приказе МЗРФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики».
Животным экспериментальной группы внутри-желудочно вводился раствор L-аргинина («Sigma». США) на 0.9%-ном растворе NaCl в дозе 500 мг/кг [Покровский и др., 2008]. Препарат вводили 1 раз в сутки до утреннего кормления ежедневно в течение 10 дней.
Контрольная группа была сформирована из животных, сопоставимых по возрасту, массе и условиям содержания с экспериментальными особями. Животным контрольной группы вводили физиологический раствор по схеме, совпадающей с таковой для экспериментальной группы.
После обескровливания под эфирным рауш-наркозом при сохраненном дыхании и сердцебиении осуществляли извлечение сердца и скелетной мышцы передней поверхности бедра с помещением тканей в охлажденный 0.25 М раствор сахарозы. Гомогенизация участков ткани левого желудочка сердца и скелетной мышцы передней поверхности бедра осуществлялась с помощью аппарата «Potter S» (Sartorius, Германия) в охлаждённом 0.25 М растворе сахарозы в соотношении 1/10 в течение 60 сек. при скорости вращения тефлонового пестика 1500 об/мин.
Полученные гомогенаты подвергали дифференциальному центрифугированию для получения чистой цитоплазматической (неседиментируемой) фракции, в которой оценивали содержание ОМБ по методу R.L. Levine в модификации [Дубинина и др., 1995], после предварительного осаждения нуклеиновых кислот 10%-ным раствором стрептомицина сульфата.
По полученным результатам строили спектр поглощения продуктов ОМБ и подсчитывали площадь под полученной кривой [Пат., 2014]; значения выражались в условных единицах на грамм белка (у.е./г белка).
Оценка резервно-адаптационного потенциала (РАЛ) производилась путем подсчета отношения общей площади под кривой карбонильных производных белков при спонтанном окислении протеинов к индуцированному по реакции Фентона, принимая общее количество динитрофенилгидразонов за 100% [Никитина, Мухина, 2009].
Статистическая обработка анализа результатов исследования проведена согласно руководствам по медицинской статистике с использованием программы «Microsoft Office Excel 2010» и «Statistica 10.0». Проверку нормальности распределения данных осуществляли с помощью критерия Шапиро-Уилка (W-критерий). Поскольку отмечалось отсутствие согласия большинства данных с нормальным распределением, вычисляли характеристики: медиану, минимальное и максимальное значения, результаты представляли в формате Me [min; max], для оценки статистической значимости различий независимых выборок использовали ранговый критерий Манна-Уитни (U-тест).
Результаты и их обсуждение
В скелетной мышце под влиянием аргинина в дозе 500 мг/кг в экспериментальной группе животных наблюдается незначительное снижение содержания карбонильных производных нейтрального характера по сравнению с контрольными значениями (табл. 1, рис. 1). Статистически значимо уменьшается содержание альдегид-динитрофенилгидразонов (АДНФГ) нейтрального характера в ультрафиолетовой части спектра. Снижение суммарного содержания карбонильных производных белков (статистически значимое) в экспериментальной группе по отношению к контрольным показателям может свидетельствовать о запуске механизмов вторичной антиоксидантной защиты в тканях [Ду- тканях [Дубинина, Пустыгина, 2008; Абаленихина, дификации белков в ткани скелетной мышцы пе-Фомина, 2014], с подавлением окислительной мо- редней поверхности бедра.
Таблица 1
Площадь под кривой спонтанной окислительной модификации белков (у.е./г белка); Me [min; max]
|
Показатель |
SАДНФГт |
S АД НФ Tvs |
SКДНФГт |
S КДНФГ\5 |
БОМБ |
|
|
Скелетная мышца |
Контроль |
23.17 [22.34; 24.78] |
6.30 [5.78; 6.81] |
4.26 [4.26; 6.31] |
1.06 [1.05; 1.28] |
35.01 [33.43; 38.96] |
|
Эксперимент |
17.36 [14.24; 20.21] * |
4.04 [2.71; 6.31] |
4.50 [2.69; 5.85] |
0.88 [0.34; 1.34] |
27.08 [21.80; 33.15] * |
|
|
Сердечная мышца |
Контроль |
21.28 [19.58; 22.80] |
3.25 [2.28; 5.21] |
3.28 [0.99; 4.77] |
0.44 [0.42; 0.71] |
28.23 [23.79; 32.99] |
|
Эксперимент |
18.97 [18.30; 19.10] * |
6.23 [5.41; 8.02] * |
5.24 [4.79; 7.79] * |
0.89 [0.83; 1.27] * |
31.33 [29.64; 36.17] |
|
*- статистически значимые отличия от группы контроля (р<0.05).
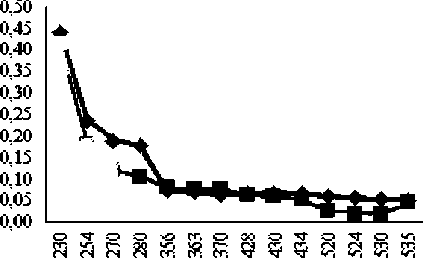
* контроль fl Аргинин
Рис. 1. Сравнительный анализ спектра поглощения продуктов спонтанной окислительной модификации белков и их компонентов в скелетной мышце контрольной и экспериментальной групп животных (у.е./г белка)
Изменения, касающиеся левого желудочка сердца крысы, характеризуются снижением АДНФГ нейтрального характера; нарастанием АДНФГ основного характера и обеих групп кетон-динитрофенилгидразонов (КДНФГ), результаты статистически значимо отличаются от контрольной группы крыс (табл. 1, рис. 2).
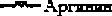
Рис. 2. Сравнительный анализ спектра поглощения продуктов спонтанной окислительной модификации белков и их компонентов в миокарде контрольной и экспериментальной групп животных (у.е./г белка)
В результате последних исследований принято альдегидные производные считать ранними маркерами ОМБ, характеризующими процесс фрагментации, а кетонные - поздними, отражающими агрегацию белков, результатом которой может оказаться нарушение их нативной конформации [Губский и др., 2005].
Образование альдегидов происходит в условиях стимуляции свободно-радикальных превращений в клетках, которые имеют место при оксидативном стрессе [Давыдов, Божков, 2014]. Ввиду уже доказанной причинно-следственной связи между карбонильным и оксидативным стрессом [Давыдов, Божков, 2014], можно предположить, что в результате воздействия субстрата синтеза оксида азота на сердце и скелетную мышцу крыс происходит статистически значимый рост показателей ранних маркеров карбонильного стресса относительно контрольной группы животных (табл. 2, рис. 3), вследствие активации образования альдегидов.
Контроль. Контроль.
15%
13%

85% 87%
Скелетная мышца.
Сердечная мышца.
19% 20%

доля АДНФГ (первичные маркеры) ■ доля КДНФГ (вторичные маркеры)
Рис. 3. Доля первичных и вторичных маркеров относительно общего содержания карбонильных производных белков
В изучаемых образцах мускулатуры крыс наблюдается уменьшение доли вторичных маркеров (КДНФГ), что может свидетельствовать о сниже- нии степени ОМБ или о повышении скорости утилизации измененного белка (вторичный антиоксидантный эффект) [Владимирский. Бородина. Аба шева. 2013]. Статистически значимое отличие от группы контроля наблюдается в ткани сердца крыс под влиянием аргинина.
Таблица 2
Суммарное содержание первичных и вторичных маркеров окислительного стресса экспериментальной и контрольной групп животных (у.е./г белка); Me [min; max]
|
Показатель/ группа |
S АДНФГиу + S АДНФГта |
S КДНФГ„ + S КДНФГ,, |
|
|
Скелетная мышца |
Контроль |
29.48 [28.12; 31.59] |
5.33 [5.31; 7.37] |
|
Эксперимент |
21.39 [17.46; 26.06] * |
5.38 [3.26; 7.09] |
|
|
Сердечная мышца |
Контроль |
24.53 [22.38; 27.50] |
3.72 [1.42; 5.48] |
|
Эксперимент |
25.21 [24.02; 27.11] |
6.13 [5.62; 9.06] * |
|
*- статистически значимые отличия от группы контроля (р<0.05).
Оценка содержания динитрофенилгидразонов при спонтанном окислении белков позволяет охарактеризовать степень окислительной деструкции белковой молекулы, а при стимулированном (ме-талл-катализируемом) окислении - описать изменения резервно-адаптационных возможностей организма [Владимирский. Бородина. Абашева. 2013]. Металл-катализируемое окисление в настоящее время рассматривают как посттранскрипционную окислительную модификацию белков [Дубинина. 2006].
Исходя из данных литературы [Давыдов. Божков. 2014]. можно сделать следующее предположение: аргинин, являясь донатором синтеза оксида азота. увеличивает степень окислительно-го/карбонильного стресса [Капелько и др.. 2008; Давыдов. Божков. 2014]. тем самым уменьшая степень РАП относительно групп контроля (рис. 4. 5).
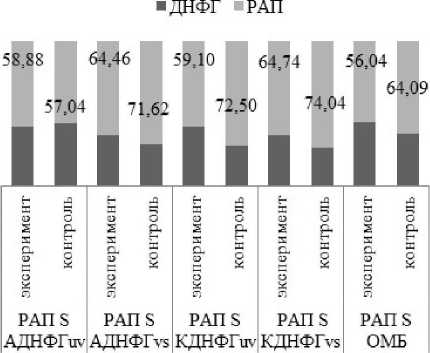
Рис. 4. Оценка резервно-адаптационного потенциала ткани скелетной мышцы аргинин/контроль
Однако в группе воздействия на сердечную мышцу аргинином (рис. 4). РАП S АДНФГ,,, незначительно статистически значимо увеличился по сравнению с контролем. Возможно, причиной та ковых изменений является дефицит нитроксида. при котором динитрозильные комплексы негемового железа (ДНКЖ). содержащие цистеин или глутатион [Шумаев. Космачевская. Топунов, 2008]. распадаются, освобождая NO из собственных депо [Капелько и др., 2008; Абаленихина. Фомина. 2014].
■ ДНФГ -РАП
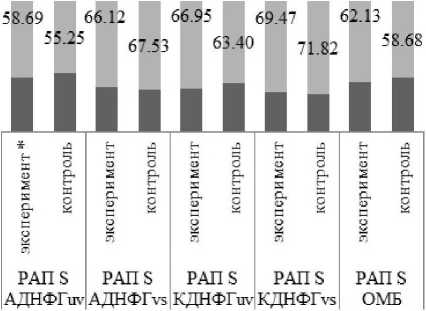
Рис. 5. Оценка резервно-адаптационного потенциала ткани сердечной мышцы аргинин/контроль
* - статистически значимые отличия от группы контроля (р<0.05)
Динитрозильные комплексы негемового железа обнаружены во многих клетках и тканях, продуцирующих оксид азота. ДНКЖ являются стабильными депо NO. в свою очередь, низкомолекулярные ДНКЖ выполняют функцию его переносчика [Граник. Григорьев. 2004]. Таким образом, динитрозильные комплексы негемового железа могут образовываться в клетках при умеренном окислительном стрессе и тем самым формировать собственный внутриклеточный пул NO как форму запасания оксида азота. Вместе с тем при снижении уровня NO окислительный стресс активирует его выход из комплексов с последующим демпфиро- ванием повреждающего действия активных форм кислорода [Капелько и др., 2008].
Заключение
Таким образом, результаты исследования демонстрируют, что применение аргинина в дозе 500 мг/кг у экспериментальных крыс вызывает снижение окислительной модификации белков в скелетной мышце за счет уменьшения образования аль-дегид-динитрофенилгидразонов, как первичных маркеров оксидативного стресса без существенных изменений резервно-адаптационного потенциала. Миокард в тех же условиях демонстрирует тенденцию к нарастанию карбонильных производных белков, в большей степени кетон-динитрофенилгидразонов, и истощению резервноадаптационного потенциала.
Список литературы Окислительная модификация белков сердечной и скелетной мускулатуры крыс под влиянием субстрата синтеза оксида азота
- Абаленихина Ю.В., Фомина М.А., Исаков С.А. Окислительная модификация белков и изменение активности катепсина L селезенки крыс в условиях моделирования дефицита синтеза оксида азота//Российский медико-биологический вестник им. академика И.П. Павлова. 2013. № 1. С. 45-49
- Абаленихина Ю.В., Фомина М.А. Влияние модуляторов синтеза оксида азота на активность и аутопро-цессинг катепсина в иммунокомпетентных органов крыс в условиях in vitro//Наука молодых (Eruditio Juvenium). 2014. № 1. С. 53-59
- Владимирский Е.В., Бородина Е.Н., Абашева Н.М. Клиническая эффективность и безопасность включения в рацион питания пациентов с кардиоваскулярной патологией диетического профилактического продукта «масло «Гармоникум с живицей»//Современные проблемы науки и образования. 2013. № 5. URL: http://www.scienceeducation.ru/ru/article/view?id=10489 (дата обращения: 15.12.2015)
- Граник В.Г., Григорьев Н.Б. Оксид азота (NO). Новый путь к поиску лекарств: монография. М.: Вузовская книга, 2004. 360 с
- Губский Ю.И. и др. Токсикологические последствия окислительной модификации белков при различных патологических состояниях (обзор литературы)//Современные проблемы токсикологии. 2005. Т. 8, № 3. С. 20-27
- Давыдов В.В., Божков А.И. Карбонильный стресс как неспецифический фактор патогенеза (обзор литературы и собственных исследований)//Журнал НАМН Украши. 2014. Т. 20, № 1. С. 25-34
- Дубинина Е.Е. и др. Окислительная модификация белков сыворотки крови человека, метод её определения//Вопросы мед. химии. 1995. Т. 41, № 1. С. 24-26
- Дубинина Е.Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические аспекты. Санкт-Петербург: Медицинская пресса, 2006. С. 276282
- Дубинина Е.Е., Пустыгина А.В. Окислительная мо дификация протеинов, ее роль при патологических состояниях//Укр. бiохiм. журн. 2008. Т. 80, № 6. С. 5-18
- Еременко Р.Ф., Малоштан Л.Н. Оценка влияния корректора белкового обмена экстракта из травы люцерны посевной на процессы окисления белков//Медицина и образование в Сибири. 2014. № 2. URL: http://ngmu.ru/cozo/mos/article/pdf.php?id=1351 (дата обращения: 15.12.2015)
- Капелько В.И. и др. Динитрозильные комплексы железа -естественные доноры оксида азота в организме//Патолопя. 2008. Т. 5, № 3. С. 76. URL: http://nbuv.gov.ua/j-pdf/pathology_2008_5_3_58.pdf (дата обращения: 15.12.2015)
- Никитина Ю.В., Мухина И.В. Изменения окислительных процессов в ткани головного мозга и крови крыс в раннем онтогенезе//Вестник Нижегородского университета им. Н.И. Лобачевского. 2009. № 6(1). C. 124-131
- Пат. 2524667 РФ, МПК G01N33/52. Способ комплексной оценки содержания продуктов окислительной модификации белков в тканях и биологических жидкостях/Фомина М.А. Абаленихина Ю.В., Фомина Н.В., Терентьев А.А. 2014. Бюл. № 21. 8 с
- Покровский М.В. и др. Эндотелиопротекторные эффекты L-аргинина при моделированиии дефицита окиси азота//Экспериментальная и клиническая фармакология. 2008. Т. 71, № 2. С. 29-31
- Шумаев К.Б., Космачевская О.В., Топунов А.Ф. Оксид азота -с гемоглобином и не только//Химия и жизнь. 2008. № 4. С. 22-25. URL: http://files.school-collection.edu.ru/dlrstore/2ef88c65-1ae6-4eb0-d808-7b39a08283b1/22-25_04_2008.pdf (дата обращения: 15.12.2015)


