Окислительная модификация белков в эритроцитах и плазме крови в динамике экспериментального рака яичников
Автор: Тузеева Антонина Юрьевна, Генинг Татьяна Петровна, Долгова Динара Ришатовна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
Исследования проведены на белых крысах с перевиваемой асцитной опухолью яичников в стационарную (n=22) и терминальную (n=22) фазы роста опухоли. Асцитная опухоль яичников перевивалась внутрибрюшинно (7∙10 7 клеток на крысу). В эритроцитах и в плазме крови в динамике экспериментального рака яичников оценили показатели окислительной модификации белков. Установлено повышенное образование карбонильных производных белков нейтрального и основного характера, что позволяет судить о накоплении продуктов окислительной деградации белковых молекул и свидетельствует о возникновении карбонильного стресса. Таким образом, одним из проявлений окислительного повреждения белков является повышение уровня карбонильных производных белков.
Рак яичников, окислительная модификация белков
Короткий адрес: https://sciup.org/14113038
IDR: 14113038 | УДК: 612.015.33:612.014462:618.11-006.6
Текст научной статьи Окислительная модификация белков в эритроцитах и плазме крови в динамике экспериментального рака яичников
Введение.* Рак яичников (РЯ) относят к агрессивным опухолям человека, склонным к рецидивированию и, как следствие, имеющим низкие показатели выживаемости больных [6, 8].
Сложность проведения экспериментов на человеке делает актуальными вопросы моделирования злокачественных опухолей на экспериментальных животных. В случае РЯ используется модель перевиваемой асцитной опухоли.
Возникновение и развитие патологических процессов в организме сопровождается избыточным образованием активных форм кислорода (АФК) в организме, приводящих к усилению процессов перекисного окисления липидов (ПОЛ) и окислительной модификации белков (ОМБ) [2, 13].
В отличие от продуктов пероксидации липидов, карбонильные производные белков эритроцитов гораздо более стабильны, способны улавливать от 50 до 75 % свободных радикалов и могут являться маркерами окислительного повреждения в тканях [2, 14]. Экспериментальные исследования показывают, что в первую очередь окислительной деградации подвергаются молекулы белков мембран. При окислении белков в них образуются альдегидные и кетоновые группы аминокислотных остатков (карбонильные группы) [1, 4, 9, 11].
Цель исследования. Оценка карбонильных групп белков в эритроцитах и в плазме крови в динамике экспериментального рака яичников.
Материалы и методы. Экспериментальные исследования проведены на белых беспородных крысах массой 180–200 г с перевиваемой асцитной опухолью (штамм опухоли яичников (ОЯ) был получен из банка штаммов РОНЦ им. Н.Н. Блохина РАМН). После предварительного пассажа на 8-й день после внутрибрюшинной перевивки от одной крысы был взят асцит и перевит животным экспериментальной группы (7∙107 опухолевых клеток в каждой дозе). Прогрессирование данного типа опухоли проходит в 3 фазы: логарифмическая (с 4-х сут после перевивки), стационарная (с 8-х сут после перевивки), терминальная (с 13-х сут после перевивки). Материалом для исследований послужили эритроциты и плазма крови животных в стационарную (n=22) и терминальную (n=22) фазы роста опухоли. Контрольную группу составили здоровые самки (n=24). Оценивали уровень ОМБ по методу Е.Е. Дубининой [2]. Результаты учитывали на спектрофотометре Genesys (Thermo Scientific, USA). При λ=346 нм оценивали альдегидные группы нейтрального характера; при λ=370 нм – ке-тонные группы нейтрального характера; при λ=430 нм – альдегидные группы основного характера и при λ=530 нм – кетонные группы основного характера. Данные в гемолизате эритроцитов пересчитывали на грамм гемоглобина (Hb), определенный стандартным гемиглобинцианидным методом (набор «АГАТ», г. Москва), в плазме крови – на 1 мг белка по методу Брэдфорда [7]. Статистиче- ская обработка материала осуществлялась с помощью программ Microsoft Excel 2010. Достоверность различий средних показателей вычисляли с использованием критерия Стьюдента. Статистические гипотезы считали подтвержденными при уровне значимости р<0,05.
Результаты и обсуждение. ОМБ играет важную роль в обмене белков в организме. Накопление окисленных белков рассматривается как один из факторов регуляции синтеза и распада белков, активации мультикатали-тических протеаз, избирательно разрушающих окисленные белки [10, 12]. Карбонильные производные белков плазмы и эритроцитов более стабильны и специфичны, что позволяет использовать их в качестве маркеров оксидативного стресса при патологических процессах [2].
Полученные нами данные свидетельствуют о выраженном повышении уровня карбонильных производных нейтрального и основного характера в эритроцитах (рис. 1) и в плазме крови (рис. 2) как в стационарную фазу роста асцитной опухоли яичников (АОЯ), так и в терминальную.
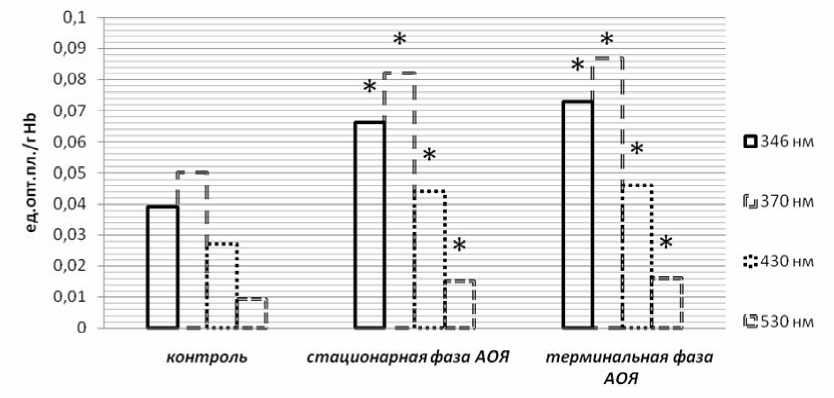
Рис. 1. Содержание продуктов ОМБ в эритроцитах в динамике экспериментального рака яичников (* р≤ 0,05 – данные, статистически значимо отличающиеся от контроля)
Из данных, представленных на рис. 1, следует, что содержание альдегидных групп нейтрального характера в гемолизате эритроцитов (λ=346 нм) статистически значимо увеличивается относительно контроля и составляет в стационарную фазу роста опухоли
0,066±0,004 ед. опт. пл./г Hb; в терминальную – 0,073±0,006 ед. опт. пл./г Hb (в контроле – 0,039±0,003 ед. опт. пл./г Hb (p 1 =0,002, p 2 =0,009)). Такая же динамика сохраняется и для кетонных групп нейтрального характера (λ=370 нм): в стационарную фазу роста
АОЯ уровень этих продуктов составил 0,082±0,005 ед. опт. пл./г Hb; в терминальную – 0,087±0,006 ед. опт. пл./г Hb против 0,050±0,003 ед. опт. пл./г Hb в контроле (p1=0,001, p2=0,009). При этом содержание продуктов ОМБ при λ=430 нм и λ=530 нм также было достоверно выше контрольных значений: при λ=430 нм в стационарную фазу – 0,044±0,003 ед. опт. пл./г Hb; в терминальную фазу – 0,046±0,005 ед. опт. пл./г Hb против 0,027±0,003 ед. опт. пл./г Hb в кон- троле (p1=0,001, p2=0,003). При λ=530 нм в стационарную и терминальную фазы уровень ОМБ составил 0,015±0,001 и 0,016±0,002 ед. опт. пл./г Hb соответственно против 0,009± ±0,001 ед. опт. пл./г Hb в контроле (p1=0,001, p2=0,001).
Таким образом, интенсивность ОМБ в динамике роста АОЯ в эритроцитах возрастает, что снижает дыхательную функцию крови, приводит к гипоксическим изменениям и усугубляет течение опухолевого процесса.
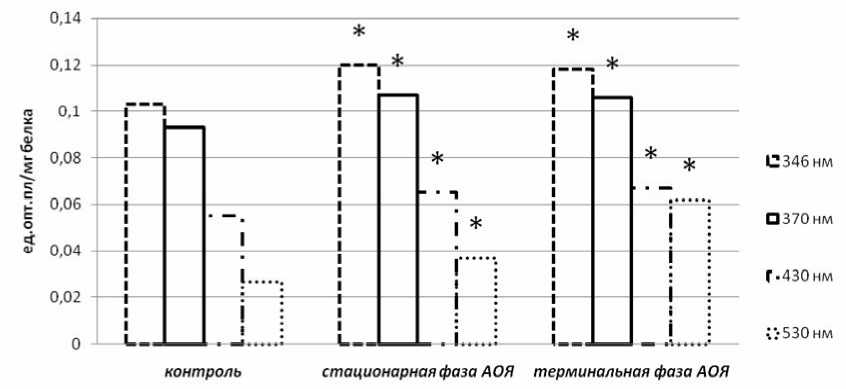
Рис. 2. Содержание продуктов ОМБ в плазме крови в динамике экспериментального РЯ (* р≤ 0,05 – данные, статистически значимо отличающиеся от контроля)
Проведенный нами сравнительный анализ окисления белков в плазме крови (рис. 2) для альдегидных групп показал, что при λ=346 нм в стационарную и терминальную фазы отмечается статистически значимое увеличение продуктов относительно контроля: 0,120±0,016 и 0,118±0,015 ед. опт. пл/мг белка соответственно против 0,103±0,006 ед. опт. пл./мг белка в контроле (p1=0,03, p2=0,02). Уровень кетонных групп нейтрального характера (λ=370 нм) в стационарную фазу роста АОЯ составил 0,107±0,014 ед. опт. пл./мг белка; в терминальную – 0,106±0,010 ед. опт. пл./мг белка; в контроле – 0,093±0,005 ед. опт. пл./мг белка (p1=0,01, p2=0,01). Установлено, что уровень карбонильных производных при λ=430 нм и λ=530 нм в стационарную и терминальную фазы также был достоверно выше контрольных значений: 0,065±0,007 и 0,067±0,001 ед. опт. пл./мг белка соответст- венно против 0,093±0,005 ед. опт. пл./мг белка в контроле (p1=0,007, p2=0,01). При λ=530 нм: 0,037±0,004 и 0,062±0,006 ед. опт. пл./мг белка соответственно против 0,027±0,002 ед. опт. пл./мг белка в контроле (p1=0,002, p2=0,005). Из данных рис. 2. следует, что содержание продуктов карбонильных производных белков в плазме крови у животных с РЯ возрастает по мере прогрессирования опухоли.
Таким образом, в динамике роста асцитной опухоли яичников в эритроцитах и в плазме крови отмечается повышенное образование карбонильных производных белков нейтрального и основного характера.
Заключение . При развитии экспериментального РЯ в плазме крови и эритроцитах возрастает количество продуктов ОМБ, что позволяет предполагать развитие карбонильного стресса.
-
1. Булгакова Е. Б. Перекисное окисление липидов мембран и природные антиоксиданты / Е. Б. Булгакова // Успехи химии. – 2006. – № 9. – С. 105–110.
-
2. Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток / Е. Е. Дубинина. – СПб. : Медицинская пресса, 2006. – 400 с.
-
3. Изменение содержания продуктов окислительной модификации белков и липидов в опухолевой ткани на разных стадиях рака легкого / Р. Н. Белоногов [и др.] // Бюл. экспериментальной биологии и медицины. – 2009. – Т. 147, № 5. – С. 562–564.
-
4. Имянитов E. H. Молекулярная патология рака легкого: клинические аспекты / Е. Н. Имяни-тов // Практическая онкология. – 2006. – Т. 7, № 3. – С. 131–136.
-
5. Применение наночастиц железа в термохимиотерапии экспериментальных опухолей / И. А. Горошинская [и др.] // Онкохирургия. – 2013. – № 1. – С. 84.
-
6. Урманчеева А. Ф. Лекарственная терапия рецидивирующего рака яичника (обзор литературы) / А. Ф. Урманчеева // Сибирский онкологический журн. – 2010. – № 3 (39). – С. 28–33.
-
7. Bradford M. M. A rapid and sensitive method for the quantitation of microgram quantities
of protein utilizing the principle of protein-dye binding / M. M. Bradford // Anal. Biochem. – 1976. – Vol. 72. – P. 248–254.
-
8. Cancer statistics, 2001 / R. T. Greenlee [et al.] // CA Cancer J. Clin. – 2001. – Vol. 1. – Р. 15–36.
-
9. Dean R. T. Biochemistry and pathology of radical-mediated protein oxidation / R. T. Dean, F. Stocker, M. Davies // Biochem. J. – 1997. – Vol. 324. – P. 1–18.
-
10. Gieche J. Oxidation and protcolysis in RAW264.7 macrophages: effects of PMA activation / J. Gieche, J. Mehlhase, A. Liclu // Biochim. Biophys. Acta. – 2001. – Vol. 1538, № 2–3. – P. 321–328.
-
11. Giulivi C. Tyrosine oxidation products: analysis and biological relevance / C. Giulivi, N. J. Tra-aseth, K. J. A. Davies // Amino acids. – 2003. – Vol. 25. – P. 227–232.
-
12. Grune Т. Degradation of oxidized proteins in mammalian cells / Т. Grune, T. Reinheckel, K. Davies // FASEB J. – 1997. – Vol. 11, № 7. – P. 526–534.
-
13. Kinnula V. L. Superoxide dismutases in malignant cells and human tumors / V. L. Kinnula, J. D. Crapo // Free Radic. Biol. Med. – 2004. – Vol. 36, № 6. – Р. 718–744.
-
14. Stadtman E. R. Protein oxidation / E. R. Sta-dtman, R. L. Levine // Annals of N.Y. Academy of Sciences. – 2000. – Vol. 899. – P. 191–208.
OXIDATIVE MODIFICATION OF PROTEINS IN THE ERYTHROCYTES AND PLASMA IN THE DYNAMICS OF EXPERIMENTAL OVARIAN CANCER
A.Yu. Tuzeeva, Т.P. Gening, D.R. Dolgova
Ulyanovsk State University
Список литературы Окислительная модификация белков в эритроцитах и плазме крови в динамике экспериментального рака яичников
- Булгакова Е. Б. Перекисное окисление липидов мембран и природные антиоксиданты/Е. Б. Булгакова//Успехи химии. -2006. -№ 9. -С. 105-110.
- Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток/Е. Е. Дубинина. -СПб.: Медицинская пресса, 2006. -400 с.
- Изменение содержания продуктов окислительной модификации белков и липидов в опухолевой ткани на разных стадиях рака легкого/Р. Н. Белоногов //Бюл. экспериментальной биологии и медицины. -2009. -Т. 147, № 5. -С. 562-564.
- Имянитов E. H. Молекулярная патология рака легкого: клинические аспекты/Е. Н. Имянитов//Практическая онкология. -2006. -Т. 7, № 3. -С. 131-136.
- Применение наночастиц железа в термохимиотерапии экспериментальных опухолей/И. А. Горошинская //Онкохирургия. -2013. -№ 1. -С. 84.
- Урманчеева А. Ф. Лекарственная терапия рецидивирующего рака яичника (обзор литературы)/А. Ф. Урманчеева//Сибирский онкологический журн. -2010. -№ 3 (39). -С. 28-33.
- Bradford M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding/M. M. Bradford//Anal. Biochem. -1976. -Vol. 72. -P. 248-254.
- Cancer statistics, 2001/R. T. Greenlee //CA Cancer J. Clin. -2001. -Vol. 1. -Р. 15-36.
- Dean R. T. Biochemistry and pathology of radical-mediated protein oxidation/R. T. Dean, F. Stocker, M. Davies//Biochem. J. -1997. -Vol. 324. -P. 1-18.
- Gieche J. Oxidation and protcolysis in RAW264.7 macrophages: effects of PMA activation/J. Gieche, J. Mehlhase, A. Liclu//Biochim. Biophys. Acta. -2001. -Vol. 1538, № 2-3. -P. 321-328.
- Giulivi C. Tyrosine oxidation products: analysis and biological relevance/C. Giulivi, N. J. Traaseth, K. J. A. Davies//Amino acids. -2003. -Vol. 25. -P. 227-232.
- Grune Т. Degradation of oxidized proteins in mammalian cells/Т. Grune, T. Reinheckel, K. Davies//FASEB J. -1997. -Vol. 11, № 7. -P. 526-534.
- Kinnula V. L. Superoxide dismutases in malignant cells and human tumors/V. L. Kinnula, J. D. Crapo//Free Radic. Biol. Med. -2004. -Vol. 36, № 6. -Р. 718-744.
- Stadtman E. R. Protein oxidation/E. R. Stadtman, R. L. Levine//Annals of N.Y. Academy of Sciences. -2000. -Vol. 899. -P. 191-208.


