Оксид азота и сульфид водорода как р38-зависимые регуляторы экспрессии генов XIAP и AVEN в опухолевых клетках линии Jurkat
Автор: Таширева Л.А., Старикова Е.Г., Новицкий В.В., Васильева О.А., Якушина В.Д., Степовая Е.А., Бельдягина Е.В., Зима А.П., Прохоренко Т.С., Осихов И.А., Saprina T.V.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (53), 2012 года.
Бесплатный доступ
Проведено исследование р38-зависимых механизмов влияния газовых трансмиттеров оксида азота и сульфида водорода на экспрессию генов XIAP и AVEN в клетках линии Jurkat. Методом ПЦР в реальном времени показано, что экспрессия генов XIAP и AVEN активна в опухолевых клетках линии Jurkat. Доноры газов оксида азота и сульфида водорода вызывали подавление экспрессии генов XIAP и AVEN в клетках Т-лимфобластной лейкемии. Изменение экспрессии указанных генов под действием газов NO и H 2S происходило с вовлечением р38 МАР киназы.
Апоптоз, оксид азота, сульфид водорода, р38 мар киназа
Короткий адрес: https://sciup.org/14056261
IDR: 14056261 | УДК: 616-091.818:546.172.6:546.221.1:576.3
Текст научной статьи Оксид азота и сульфид водорода как р38-зависимые регуляторы экспрессии генов XIAP и AVEN в опухолевых клетках линии Jurkat
Апоптоз является программированной формой клеточной гибели, посредством которой в организме происходит удаление, в том числе и определенных клонов дифференцирующихся клеток. Нарушение этого механизма регуляции клеточного гомеостаза является одним из условий опухолевого перерождения клеток. Регуляция апоптоза представляет собой сложную многокомпонентную систему баланса про- и антиапоптогенных факторов. В последние годы к числу модуляторов програм- мированной клеточной гибели относят семейство газовых трансмиттеров, состоящее из 3 газов – NO, CO и H2S [15].
Известно, что NO и H2S могут изменять реализацию программированной гибели клеток за счет влияния на функционирование основных эффекторных молекул апоптоза – каспаз, в частности, показано, что оксид азота способен ингибировать активность каспазы-3 посредством ее S-нитрозилирования [3]. До недавнего времени запуск проапоптотических реакций, следующих после активации каспаз, считался необратимым. Однако существуют протеины, способные ингибировать функции каспаз даже после их энзиматической активации. К указанным белкам относят протеины группы xIAР и белок Aven. Aven нарушает процесс самосборки комплекса Apaf1/каспаза-9 [5]. Протеины группы xIAР непосредственно ингибируют активность каспаз-3, -7 и -9 [13]. Регуляция функции белков xIAР и Aven в условиях изменения концентрации внутриклеточных газовых трансмиттеров не изучена.
Показано, что внутриклеточные газовые трансмиттеры участвуют в регуляции различных внутриклеточных процессов, в том числе за счет изменения экспрессии генов. Так, оксид азота активирует транскрипционные факторы NF-kB и АР-1, что приводит к увеличению экспрессии генов гемоксигеназы-1, белка теплового шока 70, IL-8 , ДНК-связывающего фактора c-Fos и нейроспе-цифичного белка Zif/268. Известно, что факторы транскрипции HIF1 и CREB также являются мишенями действия NO [8, 12]. Рядом авторов продемонстрировано вовлечение р38 МАРК в опосредуемую газами модуляцию клеточных функций. S. Adhkari, M. Bhatia [2] показали, что изменение содержания белков Bax и Bcl-2 при действии сульфида водорода на клетки поджелудочной железы зависит от р38 МАР киназы. В данном исследовании предпринята попытка оценить влияние стресс-активируемой р38 МАРК на экспрессию генов белков-ингибиторов каспаз xIAР и Aven в условиях изменения внутриклеточной концентрации газов оксида азота и сульфида водорода.
Материал и методы
В работе использованы клетки линии Jurkat (T-лимфобластная лейкемия), полученные из Российской коллекции клеточных культур позвоночных Института цитологии РАН (г. Санкт-Петербург). Клетки культивировали суспензионным методом в чашках Петри («Биомедикал», Россия ) в атмосфере 5 % CO2 при температуре 37ºС (СО2-инкубатор Sanyo, Япония) в полной питательной среде (90 % RPMI-1640 («Вектор-Бест», Россия), 10 % эмбриональной телячьей сыворотки («Invitrogen», США), инактивированной при 56ºС в течение 30 мин, 0,3 мг/мл L-глутамина («Вектор-Бест», Россия) и 100 мкг/мл гентамицина («INS», США)). Изменение внутриклеточной концентрации газовых трансмиттеров осуществляли с использованием донора сульфида водорода (натрий гидросульфид гидрат (NaHS) («Sigma», США)) и донора оксида азота (натрия нитропруссид (SNP) («Sigma», США)) в подобранной ранее проапоптотической концентрации 10 и 100 мМ, соответственно [1].
Для ингибирования р38 МАР-киназы к клеткам линии Jurkat добавляли селективный ингибитор р38 МАР-киназы SB 203580 в концентрации 0,2 мкМ и инкубировали в течение 20 мин. Указанные условия культивирования вызывают ингибирование активности р38 МАР-киназы на 80–95 % [10].
Для количественного определения уровня мРНК генов XIAP и AVEN использовали метод ПЦР в режиме «реального времени». Выделение тотальной РНК из клеток осуществляли сорбентноколоночным методом (QIAmp RNA Blood mini Kit, Qiagen, Германия) согласно прилагаемой инструкции. Качество всех тестируемых образцов тотальной РНК оценивалось по наличию в агарозном геле-электрофорезе двух бандов, соответствующих 18S и 28S субъединицам рРНК.
Следующим шагом синтезировали кДНК на матрице мРНК при участии обратной транскриптазы. Для этого готовили реакционную смесь: 0,5–2 мкг РНК, 100 нг статистического праймера (N9), RT-буфер (20 мМ Tris-HCl (pH=8,3), 5 мМ MgCl2, 10 мМ DTT, 100 мМ KCl, 0,4 мМ dNTP), 200 ед. акт. ДНК-зависимой РНК полимеразы (MMuLV-RT) («Promega», США).
Полученный фрагмент кДНК амплифициро-вали методом ПЦР в режиме реального времени с использованием SYBR Green I («Мolecular Probe», США) на амплификаторе Mini Opticon («Bio-Rad», США). Реакционная смесь содержала K25 буфер (×1), 0,2mM dNTP, 300 nМ праймеров, 0,5 ед. акт. SmartTaq ДНК-полимеразы блокированной антителами («Диалат», Россия), SYBRGreen I [1:25000] и 0,1–5 нг кДНК.
Праймеры, позволяющие специфично амплифи-цировать фрагменты кДНК генов, представлены в табл. 1. Для нормализации начального количества мРНК в образце и эффективности обратной транскрипции измеряли количество кДНК гена β-актин (гена «домашнего хозяйства», в относительно равной степени экспрессирующегося во всех клетках [4]). Для определения относительного количества кДНК в образце использовался метод ddCt. Результаты выражали в условных единицах (отношение относительного количества кДНК исследуемого гена к относительному количеству кДНК гена «домашнего хозяйства»).
Апоптотически измененные клетки регистрировали с помощью проточной цитофлуориметрии (FACSCantoII («Beckman Dickenson», США)) с использованием ФИТЦ-меченного аннексина V, обладающего сродством к мембранно-связанному фосфатидилсерину.
Статистический анализ проводили с использованием программного обеспечения SPSS 11.0 (SPSS, Chicago, USA). Для каждой выборки вычисляли средневыборочные характеристики. Проверку нормальности распределения количественных показателей проводили с использованием критерия Колмогорова–Смирнова. Для оценки достоверности различий независимых выборок использовали ранговый критерий Манна–Уитни. Различия считались достоверными при уровне значимости р<0,05.
Результаты и обсуждение
Молекулярные пути программированной гибели клеток контролируются генами, которые промоти-руют или ингибируют активацию каскада каспаз. Нарушение баланса между про- и антиапопто-тическими регуляторами может вносить существенный вклад в устойчивость к апоптозу. xIAP (X-связанный белок – ингибитор апоптоза) – это член семейства IAP, являющийся внутриклеточным антиапоптотическим белком. Данный протеин непосредственно ингибирует каспазу-3, -7 и -9 [13]. Кроме того, xIAP обладает E3 лигазной активностью и способен убиквитинировать каспазу-3, вызывая ее деградацию. Таким образом, xIAP действует как мощный ингибитор суицидальной программы клетки, эффективно предотвращая апоптоз, вызванный разнообразием внеклеточных стимулов, включая противоопухолевые препараты и ионизирующее излучение [9]. Воздействие доно- ров газов NO и H2S приводило к статистически значимому увеличению апоптотически-измененных клеток Т-лимфобластной лейкемии по сравнению с интактной культурой (контроль) (р<0,05) (рис. 1). При этом инкубация с 100 мМ SNP значимо уменьшала уровень мРНК гена XIAP по сравнению с контролем (р<0,05). Аналогичная тенденция была выявлена при изменении внутриклеточной концентрации сульфида водорода с использованием NaHS. Добавление указанного донора в концентрации 10 мМ к культуре клеток линии Jurkat снижало уровень мРНК гена XIAP в 25 раз по сравнению с интактными клетками Т-лимфобластной лейкемии (р<0,05) (табл. 2). Возможно, оксид азота и сульфид водорода подавляют экспрессию гена XIAP посредством S-нитрозилирования и S-сульфгидрирования транскрипционных факторов соответственно [8, 15]. Таким образом, снижение экспрессии гена XIAP, являющегося ингибитором каспаз, опосредует проапоптотический эффект газовых трансмиттеров.
Показано, что одним из элементов системы индукции апоптоза является МАР (mitogen activated protein)-киназный каскад. MAPK являются серин/ треониновыми протеинкиназами, которые могут фосфорилировать цитоплазматические и ядерные мишени [11]. Семейство МАР-киназ включает 4 небольших подсемейства протеинкиназ – p38, ERK (extracellular signal-regulated kinases), JNK/SAPK (c-jun N-terminal or stress-activated protein kinases) и BMK1 (ERK/big MAP kinase 1) [16]. Ингибирование р38-зависимых путей на фоне воздействия SNP и NaHS, как показали результаты настоящего исследования, приводило к снижению количества клеток с признаками апоптоза в культуре клеток Т-лимфобластной лейкемии по сравнению с контролем (р<0,05) (рис. 1). Предварительное инкубирование клеток линии Jurkat с селективным
Структура специфических праймеров
Таблица 1
|
Ген |
Праймеры |
Размер продукта, п.о. |
|
β-actin |
F: 5′- CTGGCACCCAGCACAATG -3′ |
72 |
|
R: 5′- AGCGAGGCCAGGATGGA -3′ |
||
|
AVEN |
F: 5′-GATTTCAGTGTCCTCCTTAG-3′ |
253 |
|
R: 5′-CCTTGCCATCATCAGTTCTC-3′ |
||
|
XIAP |
F: 5′-ATAGTGCCACGCAGTCTACAA-3′ |
101 |
|
R: 5′-AGATGGCCTGTCTAAGGCAAA-3′ |
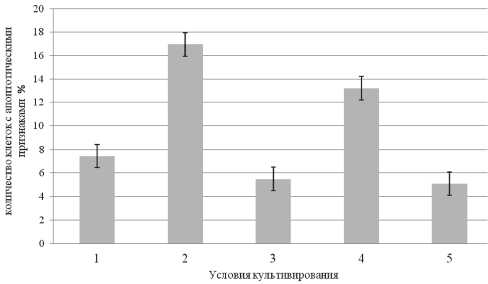
Рис. 1. Число апоптотически измененных клеток при различных условиях культивирования. Примечание: 1 – интактные клетки линии Jurkat; 2 – клетки линии Jurkat при добавлении 100 мМ SNP;
3 – клетки линии Jurkat при добавлении 100 мМ SNP и 0,2 мкМ SB203580; 4 – клетки линии Jurkat при добавлении 10 мМ NaHS;
5 – клетки линии Jurkat при добавлении 10 мМ NaHS и 0,2 мкМ SB203580
ингибитором р38 МАР киназы частично отменяло снижение экспрессии гена XIAP, вызванное обработкой клеток донором оксида азота (р<0,05), однако оставалась достоверно ниже контрольных значений (р<0,05). Совместная инкубация клеток с проапоптотической концентрацией донора сульфида водорода и 0,2 мкм SB203580 не приводила к достоверному изменению экспрессии гена XIAP по сравнению с изолированным действием газа (р>0,05) (табл. 2). Полученные данные свидетельствуют о том, что трансдукция проапоптотического сигнала в условиях изменения внутриклеточной концентрации оксида азота частично осуществляется с участием р38 МАР-киназы. Сульфид водорода является p38-независимым негативным регулятором экспрессии гена XIAP.
Известно, что другой белок Aven также способен ингибировать апоптоз, оказывая влияние на активность каспаз. Показано, что Aven ингибирует самосборку Apaf-1 и таким образом уменьшает Apaf-1-опосредованную активацию каспаз. Aven ингибирует активность каспаз в беcклеточных экстрактах и подавляет апоптоз, индуцированный комплексом Apaf-1/каспаза-9 [5]. Кроме того, экспрессия гена AVEN отдельно или в комбинации с Bcl-xL увеличивает выживаемость клеток линии CHO после воздействия апоптотических стимулов, включая истощение или полное лишение питательной среды [6]. Показано, что Aven связывается с Bcl-xL, усиливая антиапоптотические свойства последнего в ответ на каспаза-1-индуцированный апоптоз [5].
Как показали результаты настоящего исследования, при инкубировании клеток линии Jurkat с 10 мМ NaHS и 100 мМ SNP экспрессия гена АVEN значимо снижалась – в 6,5 и в 7,5 раза соответственно (р<0,05). При этом экспозиция указанных доз доноров газовых трансмиттеров приводила к усилению апоптоза клеток линии Jurkat, что подтверждает антиапоптотические свойства Аven. Выключение р38-зависимых сигнальных путей в клетках линии Jurkat с помощью селективного ингибитора приводило к статистически значимому
Таблица 2
Уровень мРНК генов XIAP и AVEN в условиях воздействия доноров газов NO и H2S и ингибитора р38 МАРК
|
Условия эксперимента |
Экспрессия гена XIAP , усл.ед. |
Экспрессия гена AVEN , усл.ед. |
|
Интактные клетки линии Jurkat |
4,97 (4,88–5,4) |
1,99 (1,63–2,0) |
|
Клетки линии Jurkat при добавлении 100 мМ SNP |
0,24 (0,21–0,27) p1<0,05 |
0,31 (0,3–0,32) p1<0,05 |
|
Клетки линии Jurkat при добавлении 100 мМ SNP и 0,2 мкМ SB203580 |
0,92 (0,73–1,35) p1<0,05 р2<0,05 |
0,45 (0,37–0,46) p1<0,05 р2<0,05 |
|
Клетки линии Jurkat при добавлении 10 мМ NaHS |
0,2 (0,19–0,21) p1<0,05 |
0,26 (0,22–0,28) p1<0,05 |
|
Клетки линии Jurkat при добавлении 10 мМ NaHS и 0,2 мкМ SB203580 |
0,17 (0,17–0,2) p1<0,05 р3>0,05 |
0,4 (0,36–0,53) p1<0,05 р3<0,05 |
Примечание: р1 – различия, статистически значимые по сравнению с интактной культурой линии Jurkat; р2 – различия, статистически значимые по сравнению с интактной культурой линии Jurkat и при воздействии 100 мМ SNP; р3 – различия, статистически значимые по сравнению с интактной культурой линии Jurkat и при воздействии 10 мМ NaHS.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2012. № 5 (53)
увеличению уровня мРНК гена АVEN по сравнению с интактной культурой Jurkat-клеток в ответ на добавление в культуральную среду как донора оксида азота, так и донора сульфида водорода (р<0,05), однако по сравнению с интактной культурой клеток Т-лимфобластного лейкоза экспрессия гена AVEN оставалась сниженной (р<0,05) (табл. 2).
Таким образом, полученные данные свидетельствуют, что газы оксид азота и сульфид водорода модулируют апоптотическую программу клеток линии Jurkat частично за счет вовлечения р38-зависимых механизмов изменения экспрессии генов XIAР и АVEN . Поскольку повышение экспрессии ингибиторов апоптоза обнаружено во многих опухолях ассоциированно с прогрессией, неблагоприятным прогнозом и устойчивостью к химиотерапии [7, 14], перспективны дальнейшие исследования газовых трансмиттеров в плане возможного использования в качестве агентов для негативного регулирования экспрессии генов XIAР и АVEN в опухолевых клетках.
Работа выполнена при поддержке Министерства образования и науки России в рамках Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России на 2009–2013 годы» (Государственное соглашение № 8302, ГК № П1311).


