Опиоидные пептиды в регуляции секреторной активности макрофагов перитонеальной полости мышей при стрессе
Автор: Гейн Сергей Владимирович, Баева Татьяна Александровна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Клиническая лабораторная диагностика
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
Установлено, что β-эндорфин и динорфин А модулируют эффекты стресса, однако направленность воздействия зависит как от вводимой дозы, так и от наличия дополнительного активационного стимула. В общем β-эндорфин и динорфин А действуют на функциональную активность перитонеальных макрофагов однонаправленно - продукцию кислородных радикалов опиоидные пептиды стимулируют (β-эндорфин несколько сильнее), а секрецию цитокинов, как про- (IL-1β), так и противовоспалительных (IL-10), преимущественно угнетают.
Бета-эндорфин, динорфин а, цитокины, макрофаги, хемилюминесценция
Короткий адрес: https://sciup.org/147227057
IDR: 147227057 | УДК: 612-017.1.018 | DOI: 10.17072/1994-9952-2019-1-109-115
Текст научной статьи Опиоидные пептиды в регуляции секреторной активности макрофагов перитонеальной полости мышей при стрессе
Стресс как типовой комплекс неспецифических защитно-приспособительных и патологических реакций организма на факторы, несущие угрозу его существованию, реализуется при обязательном участии нейроэндокринной системы, неотъемлемым звеном которой являются эндогенные опиоидные пептиды. Одна из актуальных проблем современной нейроиммунологии – регуляция опиоидными пептидами иммунологических реакций на уровне целостного организма и их роль в регуляции иммуногенеза при стрессе. В настоящее время выделяют три типа опиатных рецепторов, экспрессирующихся на клетках нервной и иммунной систем (δ-, μ-, κ-), к каждому из которых в организме имеются свои высокоафинные лиганды. Во время стресса в периферическую кровь секретируются только продукты расщепления проопиомеланокор-тинпа (АКТГ, β-эндорфин), в то время как в ЦНС после стрессорного воздействия существенным ко- лебаниям подвержены уровни как эндорфинов, так и динорфинов [Peijie et al., 2003]. При развитии общего адаптационного синдрома β-эндорфин и динорфин А оказывают тормозящее действие на гипоталамо-гипофизарную ось, угнетая секрецию кортикотропин–рилизинг–фактора (КРФ) в гипоталамусе через налоксонзависимый механизм [O`Connor, O`Halloran, Shanahan, 2000]. Существенно отличаются эффекты данных пептидов, которые они оказывают на эмоциональное состояние и поведенческие реакции. Так, эндорфины снижают возбуждение в ЦНС, потенцируют адаптацию в ответ на неоднократную экспозицию стрессом у крыс, в то время как избыток динорфинов приводит к развитию депреcсии [Bali, Randhawa, Jaggi, 2016].
Цель работы – исследование влияния динорфи-на А (1-17) и β-эндорфина на стресс-индуци-рованную продукцию активных форм кислорода
(АФК), IL-i p и IL-10 стимулированными и не стимулированными перитонеальными лейкоцитами мыши in vivo.
Материал и методы
Исследования были выполнены на белых беспородных мышах средней массой 21–23 г, которых содержали в условиях лабораторного вивария. Все эксперименты были проведены в соответствии с действующими рекомендациями и этическими нормами. β-эндорфин (Skytek laboratories, США) вводили однократно внутрибрюшинно в объеме 150 мкл в дозах 100, 0.0005 мкг/кг, динорфин А 117 (Sigma) – в дозах 1 и 0.0001 мкг/кг за 1 ч. до 2 ч. иммобилизации [Гейн и др., 2010, 2011], животные контрольной группы получали физиологический раствор в аналогичном объеме. Все животные были поделены на 6 групп: 1 – контроль, 2 – им-мобилизационный стресс, 3 – введение β-эндорфина в дозе 100 мкг/кг, 4 – введение β-эндорфина в дозе 0.0005 мкг/кг, 5 – введение β-эндорфина в дозе 100 мкг/кг с последующей иммобилизацией, 6 – введение β-эндорфина в дозе 0.0005 мкг/кг с последующей иммобилизацией. Иммобилизацию проводили в течение 2 ч. в положении лежа на спине. После иммобилизации всех животных выводили из эксперимента путем декапитации под эфирным наркозом. Перитонеальные лейкоциты, где доминирующей фракцией являются перитонеальные макрофаги, выделяли по стандартной методике [Кондратьева, Ярилин, 2004].
Продукцию АФК перитонеальными лейкоцитами оценивали с помощью реакции люминолза-висимой хемилюминисценции (ЛЗХЛ). Реакцию проводили в 96-луночных плоскодонных планшетах (“Microlite”, США), в каждую лунку которых вносили 105 клеток. Для индукции дыхательного взрыва в лунки дополнительно вносили опсонизированный зимозан (ОЗ) в концентрации 150 мкг/мл. В качестве маркёра выраженности реакции ЛЗХЛ использовали люминол (10–5 М), свечение которого неизбирательно по отношению к разным кислородсодержащим радикалам. Регистрация результатов проводилась в течение 1 ч. на многофункциональном спектрофотометре TECAN (Австрия).
Культивирование перитонеальных лейкоцитов для анализа секреции IL-1β и IL-10 осуществляли по стандартной методике. Каждая культура содержала 5 x 10 5 клеток в 0.2 мл полной культуральной среды, которую готовили ex tempore на основе среды RPMI 1640 с добавлением 10 mM HEPES, 2 mM L-глутамина, 100 мкг/мл гентамицина, меркаптоэтанола (10-3М) и 10%-ной эмбриональной телячьей сыворотки. В качестве индуктора использовали ОЗ в концентрации 150 мкг/мл. Культивирование осуществляли во влажной атмосфере с 5%
CO 2 при 37°C в течение 24 ч. Количественное определение цитокинов в супернатантах клеточных культур проводили методом твердофазного имму-ноферментного анализа с помощью иммунофер-ментных тест-систем для мышей по методике, предложенной производителем («R&D», США).
Полученный материал обрабатывали с помощью двухфакторного дисперсионного анализа для непарных данных и LSD-критерия для post-hoc сравнения.
Результаты и их обсуждение
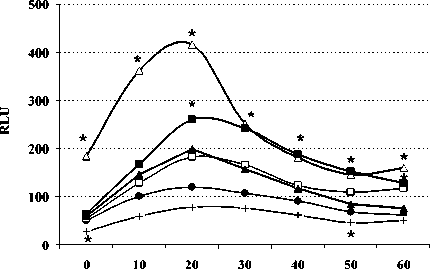
Установлено, что 2-часовой иммобилизацион-ный стресс статистически значимо снижал спонтанную продукцию АФК лейкоцитами перитонеального смыва на начальном этапе и на 50-й минуте наблюдения (рис. 1, А). Введение мышам β-эндорфина в дозе 100 мкг/кг перед иммобилизацией приводило к стимуляции уровня АФК по сравнению с животными контрольной группы с 20 по 60 мин. наблюдений. В то же время предварительное введение животным пептида в дозе 0.0005 мкг/кг с последующей иммобилизацией уровни АФК достоверно не изменяло. Изолированное введение мышам β-эндорфина в дозе 100 мкг/кг не оказывало статистически значимого эффекта на уровень АФК в спонтанных культурах, в то время как в дозе 0.0005 мкг/кг пептид стимулировал спонтанную продукцию кислородных радикалов по сравнению с контрольной группой в течение всего периода наблюдений (рис. 1, А). В стимулированных зимозаном культурах у иммобилизированных мышей секреция АФК также снижалась (рис. 1, Б).
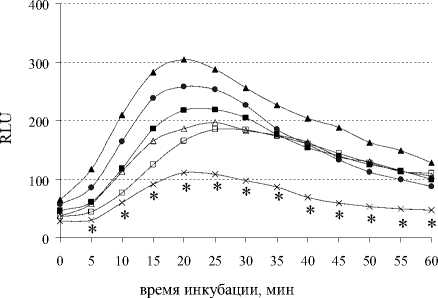
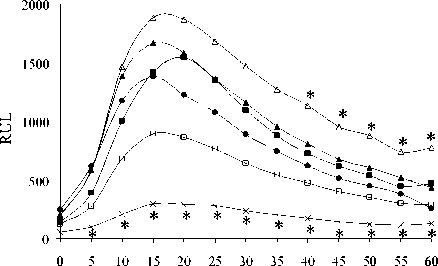
Введение животным β-эндорфина в дозе 100 мкг/кг за 1 ч. до иммобилизации эффекты стресса не модифицировало, но доза 0.0005 мкг/кг приводила к усилению продукции АФК при стрессе в первые минуты наблюдений. Изолированное введение β-эндорфина в дозе 100 мкг/кг приводило к усилению стимулированной секреции АФК только на 10 мин. наблюдений, в то время как доза 0.0005 мкг/кг выраженно активировала стимулированную продукцию АФК с 10 по 60 мин. эксперимента. Динорфин А нивелировал стрессиндуцированное угнетение респираторного взрыва в спонтанных и индуцированных культурах, помимо этого, изолированное введение животным пептида в низкой дозе 0,0001 мкг/кг усиливало продукцию АФК в зимозан-индуцированных пробах (рис. 2 А, Б).
Таким образом, введение β-эндорфина, как и динорфина А, перед воздействием стрессового фактора ослабляет угнетающие эффекты стресса на образование реактивных радикалов кислорода. В то же время необходимо отметить, что низкая доза β-эндорфина, сопоставимая с концентрацией пептида в периферической крови при стрессе оказывает самостоятельное стимулирующее влияние на микробицидный потенциал клеток. Динорфин А в низкой дозе так же усиливал интенсивность респираторного взрыва, однако, его эффект был менее выраженным, нежели у β-эндорфина.
А
время инкубации, мин
Б
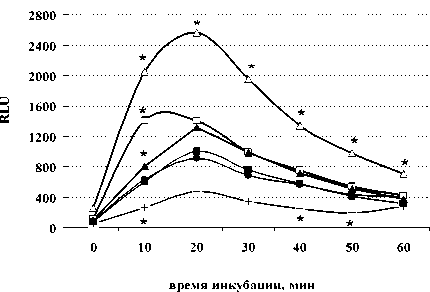
Рис. 1 . Влияние β-эндорфина и иммобилиза-ционного стресса на спонтанную (А) и стимулированную (Б) продукцию активных форм кислорода перитонеальными лейкоцитами мыши (n = 9).
По оси ординат: относительные единицы люми-нисценции (RLU). По оси абсцисс: время наб-лююдения (мин); * – р ≤ 0.05 по LSD-критерию к контрольной группе. Группы: • – контроль, + – иммобилизация, □ – β-эндорфин 100 мкг/кг, ∆ – β-эндорфин 0.0005 мкг/кг, ■ – β-эндорфин 100 мкг/кг + иммобилизация, ▲ – β-эндорфин 0.0005 мкг/кг + иммобилизация
Спонтанная и стимулированная продукция IL-1β на фоне стресса снижалась (табл. 1, 2). Во всех группах животных, получавших β-эндорфин, спонтанная продукция IL-1β также была снижена по сравнению с контрольными, но не стрессированными животными. В стимулированных культурах предварительное введение животным перед иммобилизацией β-эндорфина в дозе 100 мкг/кг эффект стресса нивелировало, в то время как введение низкой дозы β-эндорфина (0.0005 мкг/кг) - приводило к еще более выраженному снижению уровней
IL-1β. При стрессе на фоне введения динорфина А уровни спонтанной продукции IL-1β оставались низкими по отношению к животным контрольной группы, и от группы животных, подвергнутых стрессу, статистически значимых отличий не выявлено. К угнетению спонтанной продукции IL-1β приводило изолированное введение динорфина А в высокой дозе. Стимулированная продукция IL-1β угнеталась в группе животных, подвернутых стрессу на фоне высокой дозы динорфина А, по отношению к группе контроля, но не стрессированным животным. Изолированное введение ди-норфина А на стимулированную продукцию IL-1β не влияло.
А
Б
время инкубации, мин
Рис. 2 . Влияние динорфина А и иммобилиза-ционного стресса на спонтанную (А) и стимулированную (Б) продукцию активных форм кислорода перитонеальными лейкоцитами мыши (n = 9).
По оси ординат: относительные единицы люми-нисценции (RLU). По оси абсцисс: время наблюдения (мин); * – р ≤ 0.05 по LSD-критерию к контрольной группе. Группы: • - контроль, х -иммобилизация, □ – динорфина А 1 мкг/кг, ∆ – динорфина А 0.0001 мкг/кг, ■ – динорфина А 1 мкг/кг + иммобилизация, ▲ – динорфина А 0.0001 мкг/кг + иммобилизация
Продукция супрессорного цитокина IL-10 в спонтанных клеточных культурах иммобилизиро- ванных животных статистически значимо не отли- которые получали β-эндорфин, наблюдалось вы-чалась от контроля. В то же время у всех мышей, раженное снижение спонтанной продукции IL-10.
Таблица 1
Влияние динорфина А на фоне иммобилизационного стресса на спонтанную и стимулированную продукцию IL-1 β и IL-10 перитонеальными лейкоцитами мыши (n=8)
|
Группа |
Условия культивирования |
IL-1 β , пг/мл |
IL-10, пг/мл |
|
Контроль |
Без индуктора Зимозан |
140.78±45.52 262.84±60.05 |
126.09±32.59 207.24±52.85 |
|
Стресс |
Без индуктора Зимозан |
29.44±12.40* 137.08±15.14* |
146.19±36.95 292.31±64.69 |
|
Ддинорфин А 1 мкг/кг |
Без индуктора Зимозан |
55.76±8.22* 148.82±43.73 |
37.65±13.33* 87.65±18.27* |
|
Динорфин А 0,0001 мкг/кг |
Без индуктора Зимозан |
95.71±16.26 187.92±35.99 |
61.99±12.20 220.25±68.33 |
|
Стресс + динорфин А 1 мкг/кг |
Без индуктора Зимозан |
49.11±11.28* 106.18±7.36* |
78.44±13.80 117.99±22.94 |
|
Стресс + динорфин А 0,0001 мкг/кг |
Без индуктора Зимозан |
62.57±7.42* 165.79±19.74 |
64.75±12.81 165.47±51.07 |
Примечание. * – < 0,05 по сравнению с контролем.
Таблица 2
Влияние β-эндорфина на фоне иммобилизационного стресса на спонтанную и стимулированную продукцию IL-1 β и IL-10 перитонеальными лейкоцитами мыши (n=8)
|
Группа |
Условия культивирования |
IL-1 β , пг/мл |
IL-10, пг/мл |
|
Контроль |
Без индуктора Зимозан |
159.69±47.12 339.93±49.20 |
170.53±43.10 289.50±49.63 |
|
Стресс |
Без индуктора Зимозан |
46.62±16.80* 219.83±15.12* |
142.58±34.27 274.55±40.28 |
|
β -эндорфин 1 мкг/кг |
Без индуктора Зимозан |
59.86±15.16* 252.46±37.92 |
62.19±8.34* 250.85±66.70 |
|
β -эндорфин 0,0001 мкг/кг |
Без индуктора Зимозан |
40.51±1.63* 270.08±63.12 |
62.05±5.01* 490.47±109.65* |
|
Стресс + β -эндорфин 1 мкг/кг |
Без индуктора Зимозан |
55.15±12.96* 294.59±19.24 |
80.31±5.33* 323.80±78.62 |
|
Стресс + β -эндорфин 0,0001 мкг/кг |
Без индуктора Зимозан |
34.10±7.91* 91.56±7.14*# |
65.67±2.62* 84.49±10.36* |
Примечание. * – < 0,05 по сравнению с контролем.
Интересные результаты в отношении продукции IL-10 были получены в условиях стимуляция клеток ОЗ. Иммобилизация не оказывала статистически значимого эффекта на уровни IL-10 в супернатантах активированных клеток. Введение животным только β-эндорфина в дозе 0.0005 мкг/кг приводило к статистически значимому повышению уровня IL-10 в супернатантах клеточных культур. А у мышей 6-й группы, которым вводили пептид в дозе 0.0005 мкг/кг с последующей иммобилизацией, наблюдалось выраженное угнетение секреции IL-10 как по сравнению с контрольной группой, так и по сравнению с животными 4-й группы. Высокая доза β-эндорфина (100 мкг/кг) на стимулированную продукцию IL-10 влияния не оказывала. Динорфин А при введении в дозе 1
мкг/кг угнетал продукцию IL-10 как в спонтанных, так и в стимулированных культурах, введение животным динорина А на фоне стресса на продукцию IL-10 не влияло.
Заключение
Таким образом, опиоидные пептиды модулируют эффекты стресса, однако направленность воздействия зависит как от вводимой дозы, так и наличия дополнительного активационного стимула. Наиболее выраженный модулирующий эффект на фоне стресса оказывал β-эндорфин в низкой дозе (0.0005 мкг/кг), сопоставимой с физиологическими концентрациями β-эндорфина при стрессе. С определенной долей уверенности можно утверждать, что в общем β-эндорфин и динорфин А действуют на функциональную активность перитонеальных макрофагов однонаправленно – продукцию кислородных радикалов опиоидные пептиды стимулируют (β-эндорфин несколько сильнее), а секрецию цитокинов как про- (IL-1β), так и противовоспалительных (IL-10), преимущественно угнетают, несмотря на то, что взаимодействуют с различными типами опиатных рецепторов и оказывают эффекты различной направленности на поведение и эмоциональное состояние [Bali, Randhawa, Jaggi, 2016]. Исключением является физиологическая доза β-эндорфина 0.0005 мкг/кг, которая оказывала стимулирующий эффект на продукцию IL-10, что может объясняться особенностями взаимодействия пептида с µ, δ - опиоидными рецепторами [Smith, 2008], а также регуляцией β-эндорфином секреции гормонов гипоталамо-гипофизарной оси при стрессе [O`Connor, O`Halloran, Shanahan, 2000; Bilkei-Gorzo et al., 2008]. Все опиоидные пептиды перекрестно взаимодействуют с различными типами опиатных рецепторов, с той лишь разницей, что эндогенные опиоиды имеют повышенную аффинность к определенному типу рецептора, а синтетические агонисты связываются в большей степени беспорядочно [Wu et al., 2012]. Ранее нами было показано, что данная доза стимулирует антителогенез, пролиферацию и продукцию IL-4 у мышей [Гейн и др., 2011]. При развитии общего адаптационного синдрома β-эндорфин и динорфин А оказывают тормозящее действие на гипоталамо-гипофизарную ось, угнетая секрецию КРФ в гипоталамусе через налоксонзависимый механизм [O`Connor, O`Halloran, Shanahan, 2000]. Кроме того, β-эндорфин и динорфин А могут оказывать прямое действие на кору надпочечников, и направленность их эффектов зависит от экспрессии того или иного типа рецептора. Показано, что у животных, дефицитных по β-эндорфину, увеличено содержание АКТГ и кортикостерона в ответ на липополисахарид [Refojo et al., 2002]. У нокаутированных по β-эндорфину и динорфину мышей пик секреции кортикостерона при стрессе снижался, но более выра-женно у животных, нокаутированных по β-эндорфину [Bilkei-Gorzo et al., 2008]. У нестресси-рованных животных, по нашим данным, β-эндорфин в широком диапазоне доз на уровень кортикостерона в плазме крови влияния не оказывает [Баева, Гейн, 2018].
Работа выполнена в рамках государственного задания, номер государственной регистрации темы № 01201353248.
Список литературы Опиоидные пептиды в регуляции секреторной активности макрофагов перитонеальной полости мышей при стрессе
- Баева Т.А., Гейн С.В. Временной фактор в регуляции цитокиновой секреции у мышей бета-эндорфином // Патологическая физиология и экспериментальная терапия. 2018. T. 62, № 1. С. 47-53.
- Гейн С.В., Баева Т.А. Эндогенные опиоидные пептиды в регуляции функций клеток врождeнного иммунитета // Биохимия. 2011. Т. 76, № 3. С. 379-390.
- Гейн С.В., Баева Т.А., Небогатиков В.О. Влияние β-эндорфина на продукцию in vivo активных форм кислорода IL-1β, TNF-α и IL-10 перитонеальными макрофагами мышей // Доклады Академии наук. 2016. Т. 469, № 6. С. 749-752.
- Гейн С.В. и др. Участие каппа-опиатных рецепторов в регуляции пролиферативной и секреторной активности мышиных спленоцитов in vivo // Вестник Пермского университета. Сер. Биология. 2010. Вып. 1. С. 73-76.
- Гейн С.В. и др. Влияние бета-эндорфина на антителогенез, пролиферацию и секрецию Tх1/Tх2цитокинов in vivo // Бюллетень экспериментальной биологии и медицины. 2011. Т. 152, № 4. С. 526-529.
- Кондратьева И.А., Ярилин А.А. Практикум по иммунологии. М.: Академия, 2004. 272 с.
- Bali A., Randhawa P.K., Jaggi A.S. Stress and opioids: Role of opioids in modulating stress-related behavior and effect of stress on morphine conditioned place preference // Neuroscience and Biobehavioral Reviews. 2015. Vol. 51. P. 138-150.
- Bilkei-Gorzo A. et al. Control of hormonal stress reactivity by the endogenous opioid system // Psychoneuroendocrinology. 2008. Vol. 33, № 4. P. 425-436.
- Bodnar R. Endogenous opiates and behavior: 2016 // Peptides. 2018. Vol. 101. P. 167-212.
- O'Connor T.M., O'Halloran D.J., Shanahan F. The stress responseand the hypothalamic pituitaryadrenal axis: from molecule tomelancholia // Oxford J. Medicine. 2000. Vol. 93. P. 323-333.
- Peijie C. et al. Heavy load exercise induced dysfunction of immunity and neuroendocrine responses in rats // Life Sciences. 2003. Vol. 72, № 20. P. 2255-2262.
- Refojo D. et al. Increased splenocyte proliferative response and cytokine production in beta-endorphin-deficient mice // Neuroimmunol. 2002. Vol. 131. P. 126-134.
- Sitte N. et al Lymphocytes upregulate signal sequence-encoding proopiomelanocortin mRNA and betaendorphin during painful inflammation in vivo // J. Neuroimmunol. 2007. Vol. 183. P. 133-145.
- Smith M.E. Neuropeptides as signal molecules in common with leukocytes and the hypothalamic-pituitary-adrenal axis // Brain Behav Immun. 2008. Vol. 22. P. 3-14.
- Wu H. et al. Structure of the human κ-opioid receptor in complex with JDTic // Nature. 2012. Vol. 485. P. 327-332.


