Определение чувстительности к антибиотикам возбудителя псевдомоноза осетровых рыб в условиях УЗВ
Автор: Гинаятов Н.С., Залялов И.Н., Абсатиров Г.Г., Какишев М.Г.
Статья в выпуске: 2 т.230, 2017 года.
Бесплатный доступ
В данной статье приведены результаты проведенного сравнительного анализа чувствительности к антибиотикам in vitro возбудителя псевдомоноза осетровых рыб выращиваемых в установках замкнутого водоснабжения (УЗВ). А также выбран из испытуемых образцов (антибиотиков) наиболее эффективный препарат в отношении исследуемой микрофлоры. Представлено практическое предложение.
Чувствительность к антибиотикам, осетровые, псевдомоноз, возбудитель болезни, узв, iсws
Короткий адрес: https://sciup.org/14288956
IDR: 14288956 | УДК: 619:616-07:616.9-022.1:639.311:597.44
Текст научной статьи Определение чувстительности к антибиотикам возбудителя псевдомоноза осетровых рыб в условиях УЗВ
Существующий стереотип, что рыбы, выращиваемые в установках замкнутого водоснабжения (УЗВ), не подвержены к болезням, не соответствует действительности. И даже в таких конролируемых условиях, как УЗВ, регистрируются заболевания различного характера, в том числе инфекционного. Среди широко распрастраненных патологии осетровых в условиях УЗВ является псевдомоноз, наносящий значительный ущерб рыбоводческим хозяйствам [2, 3].
На сегодняшний день основным сдерживающим фактором развития данной патологии является антибиотикотерапия [1].
Представленный на фармацевтическом рынке широкий ассортимент антибиотиков еще не обеспечивает успешного лечения бактериальных инфекций без определения чувствительности возбудителя к антибиотикам in vitro , поэтому возрастает ее роль при выборе наиболее эффективного антимикробного препарата (АМП) [5, 7].
В связи с этим проведение сравнительного анализа чувствительности возбудителя псевдомоноза к различным антибиотикам in vitro явилось основной целью наших исследований.
Для достижения данной цели были по- ставлены следующие задачи:
– выявить возбудитель инфекционной патологии;
– определить их чувствительность к антибиотикам in vitro .
Материалы и методы. Практический и производственный опыт производился на базе центра аквакультуры и НИИ биотехнологии и природопользования Западно-Казахстанского аграрно-технического университета имени Жангир хана.
Материалом исследований послужили смывы из области поражения больных инфекционной патологией сибирских осетров (Acipenser baerii).
Исследованию по оценке антибиотико-чувствительности подлежат чистые культуры микроорганизмов после первичного посева образца клинического материала, в последнем случае параллельно необходимо провести идентификацию культуры [6].
Бактериологические исследования произведены по общепринятым методам. Исходный материал высевалась на среду МПА для последующего выделения чистой культуры возбудителя. Посевы культивируют в термостате в течение 24 часов при температуре 37оС.
Изучение морфологических, и тинкто-риальных признаков микроба проводилось путем микроскопии фиксированных и окрашенных по Граму препаратов, а также живых неокрашенных микроорганизмов в раздавленной капле [4]. Далее проведен посев на МПБ, чтобы приготовить бактериальную суспензию для инокуляции. Продолжительность инкубации 18 часов при 37оС.
Чувствительность бактерий к антибиотикам in vitro определяли дискодиффузионным методом, при котором в качестве носителя АМП используют бумажный диск. Стандартный инокулюм наносят пипеткой на поверхность чашки Петри со средой АГВ в объеме 1 мл, равномерно распределяют по поверхности покачиванием, после чего удалили избыток инокулюма пипеткой.
Непосредственно после аппликации дисков чашки Петри помещают в термостат кверху дном и инкубируют при температуре 37°С в течение 24 ч. Увеличение интервала времени между нанесением дисков на поверхность среды и началом инкубации приводит к «преддиффузии» АМП в агар и к увеличению диаметра зоны подавления роста, что приведет к искаженному результату.
Результат учитывают путем измерения диаметра зоны вокруг диска в миллиметрах. Чашку Петри помещают кверху дном на темную матовую поверхность, так чтобы свет падал на нее под углом 45° (учет в отраженном свете). Диаметр зон задержки роста измеряют с точностью до 1 мм.
Интерпретация результатов исследований. Наличие зон диаметром до 10 мм или полное отсутствие зон задержки роста микробов вокруг диска указывают на то, что испытуемая культура устойчива к данной концентрации антибиотика.
Наличие зон диаметром от 10 до 14 мм свидетельствует о малой чувствительности культуры к данной концентрации антибиотика.
Диаметр зоны от 15 до 25 мм – испытуемая культура чувствительна к данной концентрации антибиотика.
Если диаметр зоны подавления роста от 25 мм и более, то бактерий высокочувствительны к действию антибиотиков.
Результаты исследований. При идентификации выделенные культуры возбудителя, по бактериологическим свойствам после культивирования отмечен рост на МПА серовато-белых полупрозрачных, круглых выпуклых колоний с ровными краями.
Бактериоскопия мазков выросших культур с целью определения морфологических и тинкториальных свойств установило, что возбудитель – грамотрицательная палочка, подвижная, спор и капсулы не образует.
По результатам идентификации микроорганизма установлено это Pseudomonas dermoalba – возбудителя псевдомоноза осетровых.
При определении чувствительности возбудителя к антибиотикам in vitro образование зоны подавления роста происходит в результате диффузии АМП из носителя в питательную среду (рис. 1).
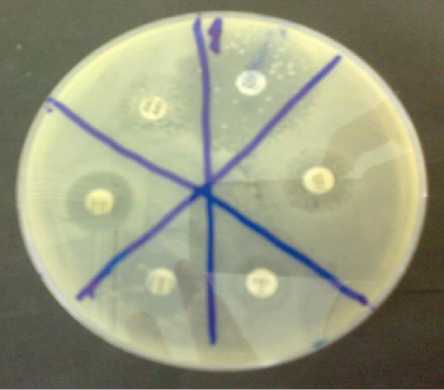
Рисунок 1 – Зоны подавления роста Pseudomonas dermoalba
Результаты проведенных исследований приведены в таблице 1.
Таблица 1 – Чувствительность Pseudomonas dermoalba к антибиотикам
|
Наименование Антибиотика |
Отношение микроорганизмов |
Содержание в диске (мкг) |
Пограничные значения диаметра зон подавления роста (мм) |
|
|
M±m |
Сv (%) |
|||
|
Доксициклин |
У |
5 |
7,30±0,35 |
14,51 |
|
Амоксициллин |
м/ч |
5 |
12±0,47 |
11,79 |
|
Энрофлоксацин |
Ч |
5 |
15,20±0,31 |
6,05 |
|
Сульфаметраксозол |
м/ч |
5 |
10,10±0,33 |
9,85 |
|
Колистин |
м/ч |
5 |
11,90±0,43 |
10,81 |
|
Ципрофлоксацин |
в/ч |
5 |
25,30±0,45 |
5,50 |
*Примечания: в/ч – высокочувствительные; ч – чувствительные; м/ч – малочувствительные; у – устойчивые микроорганизмы; М – среднее арифметическое значение; m – ошибка сред- ней; Сv – коэффициент вариабельности.
Из таблицы следует, что набольший подавляющий эффект для бактерий Pseudomonas dermoalba оказывает антимикробный препарат группы хинолонового ряда – Ципрофлоксацин . Испытуемые средства группы Доксициклин и Сульфаметраксозол показали наименьшие зоны подавления роста бактерии, что указывает на нецелесообразность применения данных препаратов при лечении рассматриваемой группы инфекций.
Заключение. Проведенные испытания показали, что возбудители псевдомоноза осетровых рыб проявляют различную чувствительность к использованным нами антибактериальным средствам.
Наиболее эффективное антибактериальное действие при псевдомонозе осетровых рыб в УЗВ оказал препарат Ципрофлоксацин, который был впоследствии рекомендован для практического использования. С учетом того, что длительное использование антибиотика приводит к повышению антибиоткорези-стентности возбудителей, следует о необхо- димости постоянного микробиологического мониторинга эффективности действия антибиотиков.
Резюме
В данной статье приведены результаты проведенного сравнительного анализа чувствительности к антибиотикам in vitro возбудителя псевдомоноза осетровых рыб выращиваемых в установках замкнутого водоснабжения (УЗВ). А также выбран из испытуемых образцов (антибиотиков) наиболее эффективный препарат в отношении исследуемой микрофлоры. Представлено практическое предложение.
Список литературы Определение чувстительности к антибиотикам возбудителя псевдомоноза осетровых рыб в условиях УЗВ
- Гинаятов, Н.С. Идентификация возбудителя инфекционной патологии осетровых рыб в условиях УЗВ/Н.С. Гинаятов, И.Н. Залялов, Г.Г. Абсатиров//Материалы международной научной конференции «Современные проблемы ветеринарной и аграрной науки и образования», посвященной 150-летию образования Государственной ветеринарной службы России, -Казань. -2016. -С.42-45;
- Гинаятов, Н.С., Микробный пейзаж в УЗВ и их чувствительность к антибиотикам in vitro/Н.С. Гинаятов, Г.Г. Абсатиров, Б.Т. Сариев//Материалы международной научно-практической конференции «Наука и образование XXI века: опыт и перспективы», -Уральск: РИО ЗКАТУ им. Жангир хана, -2015. -С. 111-114;
- Мирзоева, Л.М. Болезни рыб при индустриальном выращивании//Л.М. Мирзоева, Обзорная информация. Рыбное хозяйство. Серия Болезни гидробионтов в аквакультуре. ВНИЭРХ, 2000. -Вып.1. -С 54-58;
- Смирнова, Л.И. Микробиологическая безопасность объектов внешней среды и пищевых продуктов. Учебное пособие по санитарной микробиологии/Л.И. Смирнова, А.А. Сухинин, Е.И. Приходько, -СПб, 2013. -С.48-52.
- Страчунский, Л.С. Современная антимикробная химиотерапия/Л.С. Страчунский, С.Н. Козлов. -М.: Боргес, 2002. -206 с;
- Шелякова, О.А. Проблема резитентности Pseudomonas Aeruginosa к антибиотикам /О.А. Шелякова//Современная медицина: актуальные вопросы: Сб. ст. по матер. XVII междунар. науч.-практ. конф. -Новосибирск: СибАК, 2013. -С.150-155;
- Levy S.B. Antibacterial resistance worid wide: causes, chailenges and responses/S.B. Levy, B.A. Marshall//Nat. Med. -2004, -V 10 (Suppl. 1, 2). -Р. 122-129;


