Определение циклоспорина А в сыворотке крови для терапевтического лекарственного мониторинга
Автор: Фдорова Г.А., Подольская Е.П., Новиков А.В., Лютвинский Я.И., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии. Интерпретация данных, методология, применение
Статья в выпуске: 4 т.18, 2008 года.
Бесплатный доступ
Предложена экономичная ВЭЖХ-методика для определения циклоспорина А в сыворотке крови пациентов. Хроматографический анализ выполнен на жидкостном хроматографе Милихром А02. Для идентификации пика циклоспорина А на хроматограмме и подтверждения его гомогенности использовали спектральные отношения и сочетание ЖХ-МС в режиме прямой стыковки. Методика позволяет определять циклоспорин А во всем интервале терапевтических концентраций (100-400 нг/мл) с погрешностью не более 15 %. Результаты определения использованы для терапевтического лекарственного мониторинга циклоспорина А в онкогематологическом отделении Иркутской государственной областной детской клинической больницы.
Короткий адрес: https://sciup.org/14264568
IDR: 14264568 | УДК: 543.544.5.068.7:
Текст научной статьи Определение циклоспорина А в сыворотке крови для терапевтического лекарственного мониторинга
Для терапевтического лекарственного мониторинга циклоспорина А в клинической практике традиционно используют иммунологические методы. Метод ВЭЖХ также используют для определения циклоспорина А, но его активное применение в рутинной клинической практике ограничено по многим причинам, в том числе и из-за отсутствия удобных и экономичных методик анализа. В связи с низкой терапевтической концентрацией циклоспорина А в сыворотке крови (100– 400 нг/мл) в качестве детектора при ВЭЖХ-определении обычно используют ESI-MC [1] или ESI-MC-МС [2], что позволяет существенно повысить чувствительность определения и надежность идентификации определяемого компонента, но высокая стоимость этого оборудования делает экономически невыгодным применение МС-детектора в рутинном анализе.
При определении циклоспорина А методом ВЭЖХ с УФ-детектированием при использовании стандартного аналитического оборудования требуется концентрирование из большого объема сыворотки (1 мл) и введение внутреннего стандарта.
В связи с этим целью нашей работы явилась оптимизация существующих ВЭЖХ-методов определения циклоспорина А и создание методики, пригодной для серийного рутинного анализа.
Циклоспорин А — циклический пептид, состоящий из 11 аминокислот (рис. 1). В качестве подготовки пробы для извлечения циклоспорина А из сыворотки крови обычно используют либо жидко-жидкостную [3, 4], либо твердофазную экстракцию [2, 5] с последующим МС- реже УФ-детектированием [3–7].
Хроматографическое определение на обращен- ной фазе выполняют в двух- или трехкомпонентных подвижных фазах, состоящих из ацетонитрила, метанола и воды или буфера в режиме изокра-тического элюирования [3–7]. Температура хроматографической колонки в процессе определения варьируется от комнатной [5] до 70-80 °С [2-4, 6] и зависит от емкости используемого сорбента.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали циклоспорин А в виде фармацевтической субстанции ("Novartis"), ацетонитрил для ВЭЖХ ("Криохром", Санкт-Петербург, Россия), хлористый метилен, гексан, перхлорат лития и муравьиную кислоту — квалификация не ниже х. ч.
Хроматографический анализ выполняли на жидкостном хроматографе Милихром А02 (ЗАО "ЭкоНова", Новосибирск, Россия). Колонка 0 2 х 75 мм с Nucleosil 100-5 C18 ("Macherey-Nagel", Duren, Germany). Температура колонки 70 ° С. Элюент A: 0.2 M LiClO 4 —H 3 PO 4 , pH 3; элюент Б: МеCN. Градиент: линейный, 2500 мкл от 50 % Б до 80 % Б, 1000 мкл 80 % Б. Скорость потока 150 мкл/мин. Детектирование на длинах волн 200, 204, 210 и 214 нм. Объем пробы 50 мкл.
Масс-спектрометрическое детектирование проводили на приборе МХ-5310, оборудованном источником ионизации "электроспрей" (electrospray ionization, ESI) с ортогональным вводом ионов и времяпролетным масс-анализатором (TOF) (ESI– TOF), (ИАнП РАН, Санкт-Петербург, Россия). Запись спектра вели в режиме детектирования положительных ионов. При проведении масс-спектрометрического эксперимента в качестве подвижных фаз использовали: элюент А — 0.5 % НСООН
MeLeu9
H 3 C
H 3 C
MeLeu10
CH 3 CH 3
CH
H CH 2
MeVal11
CH 3 CH 3
CH 3 H
C
II
C
H CH 2
MeBmt1
C H
Abu2
CH 3
\ HO
HCHCH3 H CH CH3H ? CH 2
Sar 3
CH 3
H 3 CN CCONCCNCCO NCC NCH
CO H
CH 3
CH CH2INC
w
O
H
CH 3
H
O
O
H
I 2
CO
N CH
CH NCO C N CO C N C C NC CNCO C
3 H i O
CH 3 H H CH3OH CH 2 H CH H
3 CH 3 CH 3
CH 2
D-Ala 8
CH
1 3
CH
Ala7
CH 3 CH 3
Val5
CH 3 CH 3
MeLeu6
MeLeu4
Рис. 1. Структурная формула циклоспорина А в воде (pH 2.5), элюент Б — 0.5 % НСООН в ацетонитриле. Градиент линейный, 2500 мкл от 50 % Б до 80 % Б, 1000 мкл 80 % Б.
Для проведения анализа к 600 мкл сыворотки крови добавляли 600 мкл ацетонитрила для осаждения белков сыворотки и центрифугировали. 1000 мкл супернатанта переносили в другую пробирку и добавляли 1000 мкл хлористого метилена. После экстракции (5 мин) и расслоения фаз водный слой отбрасывали, а органический переносили в чистую пробирку и упаривали досуха в токе аргона. Сухой остаток, содержащий циклоспорин А, перерастворяли в 70 мкл 50 %-го водного ацетонитрила, содержащего 1 % муравьиной кислоты, добавляли 0.5 мл гексана и встряхивали 5 мин. После разделения слоев нижний слой переносили в пробирку для автосамплера и хроматографировали.
Идентификацию пика циклоспорина А на хроматограмме экстракта сыворотки крови выполняли по времени удерживания, спектральным отношениям и данным МС. Концентрацию циклоспорина А в исходной сыворотке рассчитывали по градуировочной зависимости, полученной на основе градуировочных растворов. Градуировочные растворы готовили путем добавления стандартного раствора циклоспорина А к донорской сыворотке. Далее пробы обрабатывали в соответствии с прописью методики. Градуировочная зависимость для циклоспорина А получена для 5 концентраций в интервале 50–400 нг/мл (в пересчете на исходную сыворотку, n = 5) Погрешность определения не превышала 15 % в интервале терапевтических концентраций (100–400 нг/мл).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе предложена микроколо-ночная ВЭЖХ-методика для определения циклоспорина А в сыворотке крови пациентов. Обработка образца гексаном перед его введением в хроматограф позволяет устранить мешающее влияние УФ-поглощающих гидрофобных компонентов матрицы, применение микроколоночного варианта ВЭЖХ определяет экономичность методики, а многоволновое спектрофотометрическое детектирование повышает надежность идентификации циклоспорина А.
Обычно высокогидрофобные соединения, содержащиеся в необработанной сыворотке крови, сорбируются на обращенной фазе С 18, значительно сокращая время эксплуатации хроматографической колонки. Полное удаление таких веществ из колонки возможно только при введении в состав подвижной фазы таких растворителей, как
0.8
0.6
0.4
0.2
а
A 200
0 8 16
Время, мин
0 8
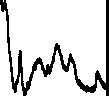
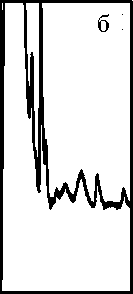
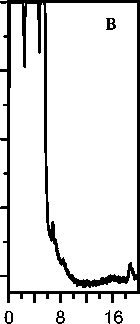
Рис. 2. Хроматограммы сыворотки крови при различных способах обработки пробы.
а — без обработки гексаном; б — после экстракции гексаном, рН 7; в — после экстракции гексаном, рН 2.5
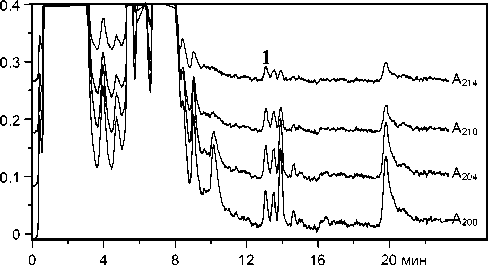
Рис. 3. Хроматограмма экстракта сыворотки крови пациента, принимающего лечение циклоспорином А (200 мг/сутки). Концентрация циклоспорина А в исходной сыворотке составляет 98 ± 10 нг/мл.
1 — циклоспорин А ацетон, гексан, хлороформ, что, как правило, неудобно, особенно при масс-спектрометрическом детектировании. Предварительная обработка пробы гексаном позволяет удалить часть таких соединений. Нами показано, что гексан извлекает из 1 мл сыворотки крови в нейтральной среде (сыворотка : гексан = 1 : 5; рНсыв.≈ 7) от 0.8 до 1.2 мг липидов, что составляет 10–20 % от их общего количества. Гексан является неденатурирующим довольно слабым экстрагентом и поэтому в данных условиях извлекает только свободные и слабосвязанные нейтральные гидрофобные соединения.
Значения спектральных отношений циклоспорина А
|
Спектральные отношения, R |
Циклоспорин А (проба) |
Циклоспорин А (стандарт) |
|
S 204 /S 200 |
0.918 |
0.938 |
|
S 210 /S 200 |
0.626 |
0.658 |
|
S 214 /S 200 |
0.520 |
0.566 |
Более полное извлечение возможно при экстракции гексаном из кислой среды (рН 2.5) после осаждения белков ацетонитрилом (рис. 2). Этот прием был нами использован при определении циклоспорина А в сыворотке крови. Регистрируемый при этом пик циклоспорина А (рис. 3) симметричен, несмотря на большой объем инжектируемой пробы (растворитель — 50 %-й ацетонитрил), и полностью отделен от сопутствующих компонентов.
При УФ-ВЭЖХ-определении циклоспорина А для повышения надежности идентификации обычно используют метод внутреннего стандарта [3, 4, 7]. К недостаткам этого приема при определении циклоспорина А можно отнести коммерческую недоступность предлагаемых стандартных соединений. Многоволновая фотометрическая детекция позволяет ввести дополнительные параметры для идентификации определяемого соединения и, таким образом, отказаться от необходимости использования внутреннего стандарта. В таблице приведены спектральные отношения, рассчитанные как отношение площадей пиков, зарегистрированных при длинах волн λ х и λ 200. Совпадение в пределах ошибки ( ± 0.05) спектральных отношений и времени удерживания пика циклоспорина А в экстракте сыворотки крови со спектральными отношениями и временем удерживания пика стандартного раствора свидетельствуют об идентичности и гомогенности пика определяемого соединения. Для подтверждения надежности определения на стадии разработки методики идентификацию пика циклоспорина А в экстрактах сыворотки крови проводили с использованием масс-спектрометрического детектирования методом ESI-TOF в режиме "on-line" (рис. 4).
Применение короткой колонки по сравнению с традиционной аналитической колонкой ∅ 4.6 × 250 мм позволяет в 10–20 раз снизить расход растворителей и во столько же раз повысить чувствительность определения. Кроме этого, режим градиентного элюирования позволяет еще вдвое снизить предел определения циклоспорина А.
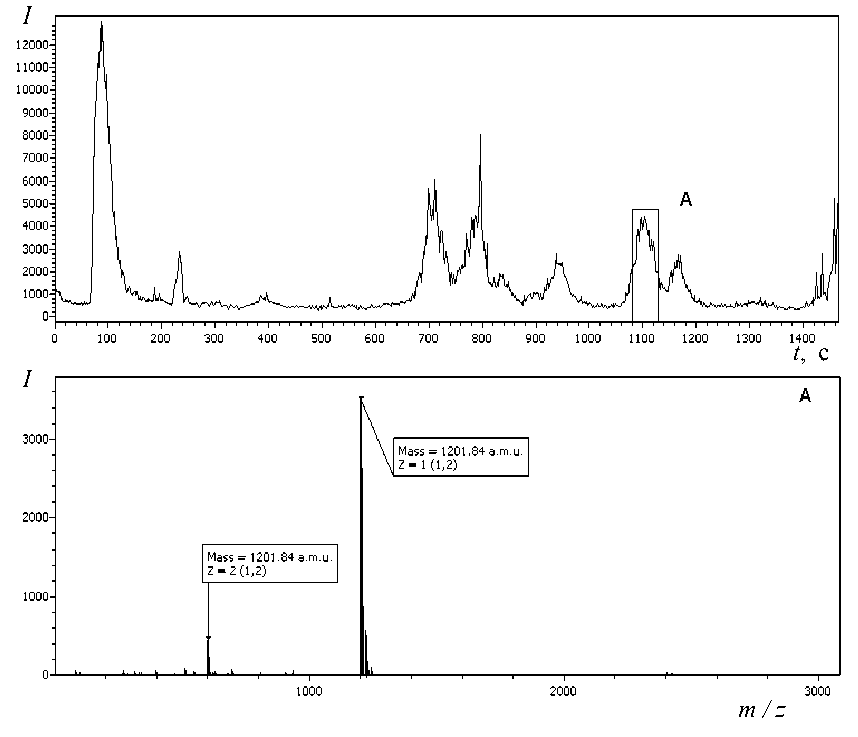
Рис. 4. Идентификация пика циклоспорина А в экстрактах сыворотки крови методом хромато-масс-спектрометрии.
А — масс-спектр, соответствующий хроматографическому пику А
Разработанная методика апробирована в клинической практике онкогематологического отделения Иркутской государственной областной детской больницы. В соответствии с Международным протоколом IPH-93-APL 2 (версия 1996) "Комбинированная иммуносупрессивная терапия приобретенных апластических анемий" при лечении требуется мониторирование циклоспорина А, концентрация которого в крови ребенка должна находиться в интервале 150–300 нг/мл.
Для определения минимальной концентрации циклоспорина А кровь из локтевой вены отбирали за 1–2 ч до утреннего приема препарата. Методика оказалась эффективна при коррекции доз циклоспорина А в процессе лечения.


