Определение хронической токсичности нового препарата "Ветом 21.77" на мышах
Автор: Рафикова Э.Р.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Трибуна молодых ученых
Статья в выпуске: 3, 2018 года.
Бесплатный доступ
Цель исследования - изучение основных токсических эффектов нового препарата «Ветом 21.77» на основе нематофагового гриба Duddingtonia flagrans, поражае-мых органов-мишеней, латентного периода развития и обратимости эффектов. Для достижения цели были поставлены задачи: ежедневно регистрировать физио-логическое состояние и прирост абсолютной массы, исследовать гематологические показатели и провести патолого-анатомическое исследование, включающее морфометрию внутренних органов мышей. Было сфор-мировано 5 групп (контрольная и 4 опытные) по 20 мы-шей в каждой. Опыт проводили на базе Научно-исследовательской ветеринарной лаборатории Агро-технопарка при Государственном университете им. Шакарима (г. Семей, Казахстан). Опытным группам «Ветом 21.77» назначали перорально в дозах 2, 5, 50 и 300 мкл/кг массы ежедневно на протяжении 6 месяцев; в контрольной группе препарат не применяли. Для учета результатов проводили ежедневный клинический осмотр, еженедельное взвешивание, регистрировали прирост абсолютной массы; изучали влияние препара-та на гематологические показатели и проводили мор-фометрию отдельных внутренних органов до исследо-вания и через 1,5; 3; 4 и 6 мес. после применения препа-рата. По результатам исследования выяснено, что при длительном использовании в дозах 2, 5, 50 и 300 мкл/кг массы «Ветом 21.77» не оказывал токсического влия-ния на организм мышей - установлена стопроцентная сохранность животных. У животных опытных групп наблюдались высокие приросты живой массы. По фи-зиологическому состоянию организма, гематологиче-ским показателям и морфометрическим параметрам изучаемых органов отклонений от нормы во всех опыт-ных группах не выявлено, что позволяет отнести «Ве-том 21.7» к IV классу токсичности - «вещества мало-опасные».
Препарат "ветом 21.77", хрониче-ская токсичность, доза, мыши, нематофаговый гриб duddingtonia flagrans
Короткий адрес: https://sciup.org/140224405
IDR: 140224405 | УДК: 619:615:636.2+619:618.14-002:636.2
Текст научной статьи Определение хронической токсичности нового препарата "Ветом 21.77" на мышах
Введение . К настоящему времени в научной литературе получил довольно обширное освещение вопрос применения хищных грибов в качестве биологических регуляторов численности личинок паразитических нематод. Работы, представленные зарубежными и отечественными исследователями, свидетельствуют о высокой нематоцидной активности некоторых видов грибов-гифомицетов в отношении гельминтов животных и птиц.
Одним из них является хищный гриб Duddingtonia flagrans , на основе которого был изготовлен микробиологический препарат, ставший предметом настоящих научноэкспериментальных исследований.
D. flagrans является перспективным инструментом биоконтроля кишечного микробиоценоза животных и птиц, так как данный гриб способен производить большое количество толстостенных, устойчивых хламидоспор, которые выживают в неблагоприятных средах, например, таких, как кишечник животного [1]. В этой связи заслуживает внимания, в частности, исследование Кампос с соавторами. Была изучена динамика прохождения конидий, хламидоспор и мицелия гриба D. flagrans через пищеварительные тракты коз. По итогам опыта было отмечено, что хламидоспоры и конидии D. flagrans продемонстрировали способность к выживанию при прохождении через пищеварительный процесс коз, с сохранением своих хищных свойств [2].
В целом лярвицидная эффективность биопрепарата была экспериментально доказана на множестве паразитических нематод различных животных: овец [3], лошадей [4], коз [5].
Цель исследований : изучение основных токсических эффектов микробиологического препарата «Ветом 21.77» на основе D. flagrans , действия препарата на поражаемые органы-мишени, а также (при установлении токсических свойств образца) латентного периода развития и обратимости эффектов.
Объекты и методы исследований . Опытный образец - препарат «Ветом 21.77», представляющий собой лиофилизированный изолят нематофагового гриба Duddingtonia flagrans на сухих иммобилизующих носителях, обладающих пребиотическими, сорбирующими и антитоксическими свойствами.
Определение хронической токсичности препарата «Ветом 21.77», согласно ГОСТ 32519-2013 [6], проводили на клинически здоровых мышах двухмесячного возраста в количестве 105 голов. Начальная масса мышей состави- ла (20 ± 0,2) г. Для проведения эксперимента было сформировано 5 групп - контрольная и 4 опытные по 20 голов в каждой. Дополнительно использовали 5 мышей для гематологического анализа, проводимого до начала исследования. В качестве группы контроля использовали мышей, которые получали стандартный лабораторный комбикорм. Мышам 1-й опытной группы «Ветом 21.77» назначали перорально, ежедневно на протяжении 6 месяцев в дозе 2; 2-й группы - 5; 3-й группы - 50; 4-й группы -300 мкл/кг массы. Ежедневно проводили клинический осмотр. Взвешивание производили до начала опыта, затем через 14 сут, 1, 5, 3, 4 и 6 мес.
Контроль за сохранностью и падежом осуществляли ежедневно. Основными критериями оценки хронической токсичности служили следующие показатели: внешний вид лабораторных мышей, поведенческие реакции, изменение абсолютной массы, абсолютный среднесуточный прирост, относительный прирост по Броди, морфологические и биохимические показатели крови, патоморфологи-ческие изменения внутренних органов. Для проведения морфометрического анализа мыши в количестве 5 голов из каждой группы подвергались эвтаназии путем декапитации и вскрытию согласно методике спустя 1,5; 3; 4 и 6 мес. от начала эксперимента.
Полученные цифровые экспериментальные данные обрабатывались с помощью U-критерия Манна-Уитни (программа StatsDirect 3.1.14). Различие считали статистически значимым при P < 0,05.
Результаты исследований . На протяжении всего периода наблюдения (6 мес.) не регистрировали гибели подопытных животных. Физиологическое состояние мышей контрольной и опытной групп на протяжении всего исследования не имело достоверных различий: мыши были клинически здоровы в течение всего эксперимента. Изменений внешнего вида, поведения, двигательной активности животных не выявлено. Данные по влиянию препарата на массу тела опытных и контрольных лабораторных животных представлены в таблице.
Абсолютная масса подопытных животных, г
|
Период наблюдения |
Группа (доза препарата, мкл/кг) |
||||
|
Контрольная (0) |
1-я опытная (2) |
2-я опытная (5) |
3-я опытная (50) |
4-я опытная (300) |
|
|
Учет результатов, взвешивание |
|||||
|
До исследования |
20,31±0,61 |
20,15±0,8 |
20,35±0,85 |
20,09±0,89 |
20,28±0,76 |
|
Через 24 ч |
20,39±0,61 |
20,29±0,79 |
20,41±0,88 |
20,18±0,9 |
20,38±0,74 |
|
На 7 сут |
22,71±0,71 |
22,82±0,61 |
22,91±0,58 |
22,98±0,67 |
23,22±0,79* |
|
На 14 сут |
24,23±0,57 |
24,26±0,78 |
24,34±0,7 |
25,31±0,61*** |
25,44±0,61*** |
|
Через 1,5 мес. |
30,43±0,95 |
30,59±0,76 |
30,79±0,71 |
31,72±0,56*** |
32,12±1,13*** |
|
Через 3 мес. |
36,21±1,0 |
36,17±0,39 |
36,76±0,73 |
39,89±0,46*** |
40,92±0,56*** |
|
Через 4 мес. |
37,34±1,09 |
37,02±0,3 |
37,61±0,3 |
41,49±0,39*** |
42,56±0,71*** |
|
Через 6 мес. |
38,56±0,77 |
38,35±0,48 |
39,84±0,51** |
43,44±0,25** |
44,32±0,67** |
Примечание. Различия достоверны на уровне значимости: *P <0,05; ** P < 0,01; *** P < 0,0001.
Из данных таблицы 1 видно, что до исследования, в сравнении с контролем, в 1-й опытной группе среднее значение массы тела было ниже на 0,8 %, в 3-й - 1,1 %, 4-й - 0,1 %, во 2-й - выше на 0,2 %.
Через 24 часа среднее значение массы тела в кон- трольной группе составило 20,39 г (на 0,4 % выше относительно исходных данных), в 1-й опытной - 20,29 г (на 0,5 % ниже контроля и на 0,7 % выше относительно исходных данных), во 2-й опытной - 20,41 г (выше на 0,1 % и 0,3 % соотв.), в 3-й опытной - 20,18 г (ниже на 1,0 % и выше на 0,5 % соотв.), в 4-й опытной – 20,38 г (на 0 % ниже и выше на 0,5 % соотв.).
Мыши 4-й опытной группы уже на 7-е сут превосходили аналогов из контроля на 2,3 % (P < 0,05). На 14-е сут статистически значимое (P < 0,0001) опережение контроля наблюдалось в 3-й (4,5 %) и 4-й (5 %) опытных группах.
Через 1,5 мес. среднее значение массы тела в контрольной группе составило 30,43 г (на 49,9 % выше исходных данных), в 1-й опытной – 30,59 г (на 0,5 % выше контроля и на 51,8 % – исходных данных), во 2-й опытной – 30,79 г (выше на 1,2 и 51,4 % соотв.), в 3-й опытной – 31,72 г (выше на 4,2 % (P < 0,0001) и на 57,9 % соотв.), в 4-й опытной – 32,12 г (выше на 5,6 (P < 0,0001) и 58,4 % соотв.).
Через 3 мес. среднее значение массы тела в контроле составило 36,21 г (на 78,3 % выше исходных данных), в 1-й опытной – 36,17 г (ниже на 0,1 % относительно контроля и на 79,5 % выше исходных данных), во 2-й опытной – 36,76 г (выше на 1,5 и 80,7 % соотв.), в 3-й опытной – 39,89 г (выше на 10,2 (P < 0,0001) и на 98,6 % соотв.), в 4-й опытной – 40,92 г (выше на 13 (P < 0,0001) и 101,8 % соотв.).
Через 4 мес. рассматриваемый показатель в контроле составил 37,34 г (на 83,9 % выше исходных данных), в 1-й опытной – 37,02 г (на 0,9 % ниже контроля и на 83,7 % выше исходных данных), во 2-й опытной – 37,61 г (выше на 0,7 и 84,9 % соотв.), в 3-й опытной – 41,49 г (выше на 11,1 (P < 0,0001) и 106,5 % соотв.), в 4-ой опытной – 42,56 г (выше на 14 (P < 0,0001) и на 109,9 % соотв.).
По истечении 6 мес. уровень статистической значимости различия между контрольной и опытными группами снизился, при этом возникнув также и во 2-й опытной группе. Таким образом, среднее значение массы тела в контроле теперь составляло 38,56 г (на 89,9 % выше относительно исходных данных), в 1-й опытной – 38,35 г (на 0,5 % ниже контроля и на 90,4 % выше относительно исходных данных), во 2-й опытной – 39,84 г (выше на 3,3 (P < 0,01) и 95,8 % соотв.), в 3-й опытной – 43,44 г (выше на 12,7 (P < 0,01) и на 116,2 % соотв.), в 4-й опытной – 44,32 г (выше на 14,9 (P < 0,01) и на 118,5 % соотв.).
Динамику увеличения абсолютной массы подопытных мышей можно наглядно рассмотреть на рисунке.
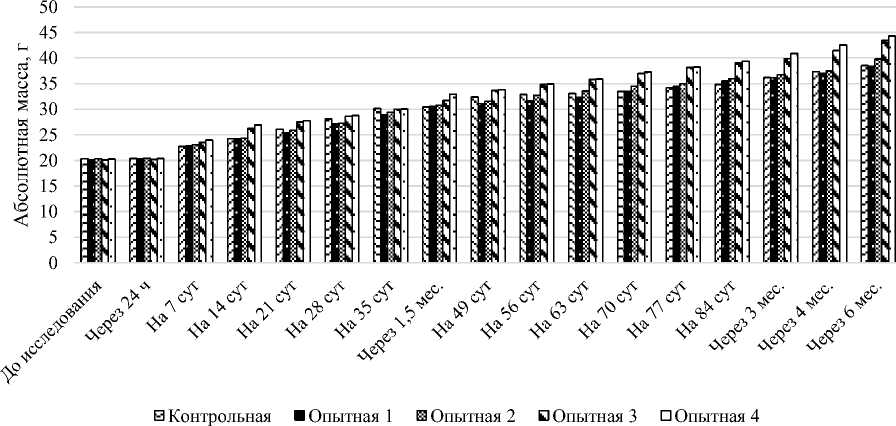
Абсолютная масса подопытных мышей за период исследования
Абсолютный среднесуточный прирост на 6 мес. исследования составил в контрольной и 1-й опытной группах 0,10 г; во 2-й – 0,11 г; в 3-й и 4-й – по 0,13 г. Относительный прирост по Броди составил в контрольной группе 15,5 %; в 1-й опытной – 15,6; во 2-й – 16,2; в 3-й – 18,4; в 4-й – 18,6 %.
С целью определения хронической токсичности были проведены гематологические исследования через 1,5; 3; 4 и 6 мес. Согласно результатам гематологического анализа, физиологические и биохимические показатели в опытных группах сохранялись в пределах физиологической нормы. В сыворотке крови мышей 4-й опытной группы содержание общего белка превышало аналогичный показатель в контрольной группе на 16,8 % (P < 0,01) через 1,5 мес. от начала опыта; на 13,3 % (P < 0,05) – через 3 мес.; на 8 % (P < 0,05) – через 4 мес. и на 3 % – через
6 мес. В группах с применением меньших дозировок данный гематологический показатель также превышал контрольное значение на протяжении всего эксперимента. Подобная прогрессия в пределах диапазона нормы (43– 64 г/л) может указывать на анаболическую направленность белкового обмена в организме опытных животных.
В концентрации сывороточного креатинина, отражающей метаболизм мышечного белка, также отмечался планомерный рост относительно аналогов из контроля, без выхода за пределы референсных значений (0,4– 0,7 мг/дл). Через 1,5 мес. различие составило в 4-й опытной группе 16,7 % (P < 0,05). Вместе с тем в содержании сывороточной мочевины статистически значимый (P < 0,05) прирост в сравнении с контролем произошел в 4-й опытной группе лишь по истечении 4 мес. эксперимента.
Влияние микробиологических препаратов на углеводный обмен грызунов до сих пор недостаточно исследовано. На протяжении настоящего исследования в отношении уровня глюкозы была отмечена относительно равномерная картина.
Число эритроцитов в крови мышей 1–4 опытных групп превышало контрольные значения соответственно на 2,3–9,3 % через 1,5 мес. с начала эксперимента; затем на 4,1–6,6 % – через 3 мес., за исключением 1-й опытной группы, где соответствующий показатель отставал от контроля на 1,6 %; спустя 4 мес. – на 0,6–6,3 %. Статистически значимые (P < 0,05) различия от контроля в указанные этапы исследования наблюдались лишь в 4-й опытной группе, как и в случае с показателем уровня гемоглобина, через 1,5 и 3 мес.
В целом, судя по полученной эритрограмме, можно предполагать, что под воздействием исследуемого препарата в крови животных происходила активация эритропоэза без видимых отклонений в системе красных кровяных телец. Наиболее выраженные изменения происходили при назначении препарата в суточной дозировке 300 мкл/кг живой массы.
В ходе опыта по истечении 1,5; 3; 4; 6 мес. лабораторные мыши всех групп в количестве по 5 голов с каждой группы были подвергнуты эвтаназии путем декапитации и вскрытию. При патолого-анатомическом исследовании внутренних органов животных изменений в их структуре не выявлено. Внутренние органы располагались анатомически правильно, жидкость в плевральной и брюшной полостях отсутствовала. Просвет трахеи и бронхов свободен, ткань легких имела розовый цвет. Слизистая оболочка, выстилающая желудок и кишечник, имела естественную серовато-розовую окраску, без видимых изъявлений и геморрагий. Капсула почки легко снималась, мозговое и корковое вещество органа у мышей были хорошо различимы на разрезе.
Таким образом, при патолого-анатомическом исследовании выяснено, что использование препарата «Ветом 21.77» не вызвало каких-либо дегенеративных, некротических и других патологических изменений в изучаемых образцах контрольной и опытной групп. Массовые коэффициенты органов находились в пределах допустимых значений норм.
Выводы
-
1. По данным проведенных исследований выяснено, что применение препарата «Ветом 21.77» в дозах 2; 5; 50 и 300 мкл/кг увеличивает прирост массы и обеспечивает 100 %-ю сохранность лабораторных животных.
-
2. Морфологические и биохимические показатели крови опытных мышей оставались в пределах физиологической нормы на протяжении всего исследования, что говорит об отсутствии негативного действия препарата на организм животных.
-
3. Исходя из полученных результатов, подтверждено, что препарат группы «Ветом 21.77» относится к IV классу токсичности – «вещества малоопасные».
Список литературы Определение хронической токсичности нового препарата "Ветом 21.77" на мышах
- Isolation and Characterization of China Isolates of Duddingtonia flagrans, a Candidate of the Nematophagous Fungi for Biocontrol of Animal Parasitic Nematodes/B. Wang, W. Liu, M. Chen M. //J. Parasitol. -2015. -Vol. 101, № 4. -P. 476-484.
- Resistance of different fungal structures of Duddingtonia flagrans to the digestive process and predatory ability on larvae of Haemonchus contortus and Strongyloides papillosus in goat feces/A. Campos, J. Araújo, M. Guimarães //Parasitol. Res. -2009. -Vol. 105, № 4. -P. 913-919.
- Ефремова Е.А., Теплякова Т.В. Влияние глубинной культуры хищного гриба Duddingtonia flagrans на численность личинок стронгилят пищеварительного тракта овец//Российский паразитологический журнал. -2010. -№ 3. -С. 33-38.
- Feeding horses with industrially manufactured pellets with fungal spores to promote nematode integrated control/J. Hernández, F. Arroyo, J. Suárez //Vet. parasitol. -2016. -Vol. 229. -P. 37-44.
- Administration of Duddingtonia flagrans chlamydospores to goats to control gastro-intestinal nematodes: dose trials/C. Paraud, H. Hoste, Y. Lefrileux //Vet. Res. -2005. -Vol. 36, № 2. -P. 157-166.
- ГОСТ 32519-2013. Методы испытаний по воздействию химической продукции на организм человека. Изучение хронической токсичности при внутрижелудочном поступлении. -M., 2014. -16 с.


