Определение коэффициента самодиффузии воды в пакете Gromacs
Автор: Булдашев Иван Владимирович, Мирзоев Александр Аминулаевич
Рубрика: Физика
Статья в выпуске: 10 (227), 2011 года.
Бесплатный доступ
Проведены молекулярно-динамическое моделирование температурных зависимостей коэффициента самодиффузии воды вблизи критической области при помощи пакета Gromacs с использованием трехточечного межчастичного SPC-потенциала и сравнение результатов моделирования с опытными данными. Показано, что выбранная методика позволяет обеспечить хорошее согласие результатов моделирования с данными других авторов и эксперимента. Показано, что температурная зависимость коэффициента самодиффузии в критической области одинаково хорошо аппроксимируется как кривыми типа Аррениуса, так и уравнением Коэна-Турнбулла.
Диффузия, вода, потенциал spc, spс potential, молекулярно-динамическое моделирование
Короткий адрес: https://sciup.org/147158669
IDR: 147158669 | УДК: 533.1
Текст научной статьи Определение коэффициента самодиффузии воды в пакете Gromacs
Вода имеет ключевое значение во многих физических процессах, поэтому изучение ее свойств является важной научной задачей на протяжении многих лет. И хотя к настоящему времени по данной тематике проведено множество исследований [1,2], некоторые вопросы все еще остаются без ответа [3]. В частности, до сих пор не закончено изучение структурных свойств воды в критической области, поэтому эта область не затрагивается во многих обзорах [4]. Целью настоящей работы является определение границ применимости потенциала SPC при моделировании поведения воды в широком температурном диапазоне критических состояний в пакете Gro macs (рис. 1). Исследуемая область выбрана с учетом возможного применения в технике, например, паросиловых установках и ВВЭР (Водо- £ водяной энергетический реактор). | Gromacs - многофункциональный па- § кет, использующий метод молекуляр- 5 ной динамики для систем, состоящих из большого числа частиц, в состав которого входит большая база полу-эмпирических парных межчастичных потенциалов для наиболее часто используемых веществ.
Температура. К
Рис. 1. Фазовая диаграмма воды, жирной линией отмечена исследуемая область
В работе проведено моделирование системы, состоящей из 216 моле- кул воды с использованием трехточечного потенциала, называемого в текущей литературе SPC [5], с периодическими граничными условиями. Модельный SPC-потенциал представляет молекулу воды в виде трех точечных зарядов: двух с зарядом qx = 0,41е (атомы водорода) и одного с 72 = “0,81е (атом кислорода), для которого кроме электростатического потенциала добавлен потенциал типа Леннарда-Джонса (сг= 3,016 А, энергия е- 15,319 кДж/моль). Приближенный характер SPC-потенциала несколько искажает равновесные параметры одиночной молекулы. В молекуле воды угол между О—Н связями и их длина составляют соответственно 6 = 104,52° и /1 = 0,9584 А против 6 = 109,47° и / = 1 Ав модели SPC.
Рис. 2. Схема модели воды потенциала SPC
Стартовая конфигурация для моделирования задавалась следующим образом: координаты атомов были равномерно распре- делены по кубической ячейке, а их начальные скорости инициализировались с помощью встроенного в пакет генератора случайных чисел, и удовлетворяли распределению Максвелла. Временной шаг моделирования был выбран равным 0,002 пс [6], а так как число шагов 20 000, то полное время моделирования составило 40 пс [7]. Тестовые прогоны показали, что для установления равновесия требуется не более 2 пс. Для моделирования системы в NPT-ансамбле использовались термостат и баростат Берендсена [8], обеспечивающие сходимость температуры и давления системы к установленным значениям То и Ро в соответствии с динамическими уравнениями:
ат _т0-т ар _р0-р at т ’ at тр где тР, т - константы времени, являющиеся входными параметрами программы моделирования.
Моделирование проводилось при постоянном давлении и температуре (в т. н. NPT-ансамбле), в диапазоне изменений давления Р от 500 бар до 3000 бар и температуры Т от 300 К до 700 К. Число молекул N сохранялось постоянным и равным 216, что как показано в работе [9] является достаточным для получения результатов с погрешностью не хуже 5 %. Дополнительные моделирования с 820 молекулами подтвердили, что погрешность действительно лежит в этих пределах. По усредненным данным определялись величины объема, давления и температуры, а также парная корреляционная функция g(r). Отклонение средних величин давления и температуры от заданных баростатом и термостатом лежит в пределах 6 %. Коэффициент самодиффузии вычислялся по формуле л (Аг2) 2Х
D =----- , где (Аг ) - средний квадрат
6т полного смещения молекулы воды за время т . Использовался метод наименьших квадратов при его определении. Полученные при моделировании результаты сопоставлялись с экспериментальными данными работ [7, 10].
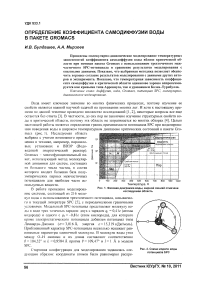
Сравнение результатов моделирования температурной зависимости коэффициента самодиффузии D воды с данными эксперимента (рис. 3) показало, что в области
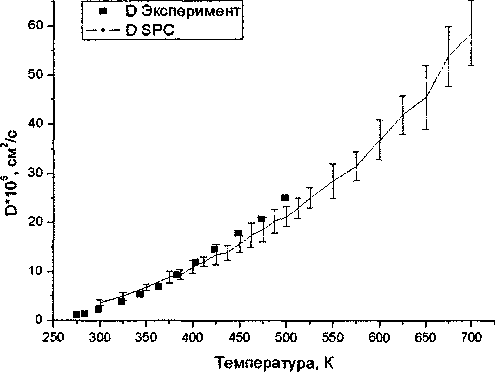
Рис. 3. Сравнение результатов моделирования температурной зависимости коэффициента самодиффузии воды с данными эксперимента [10] при Р = 1000 бар
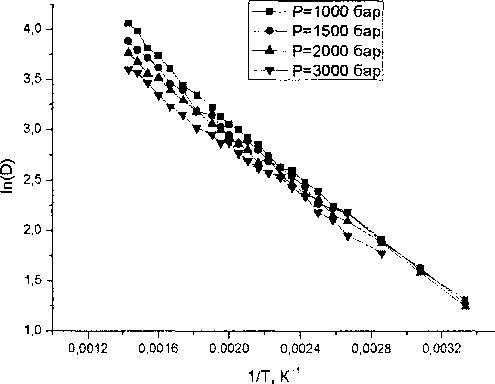
Рис. 4. Температурные зависимость коэффициента диффузии воды в координатах
Рис. 5. Аппроксимация температурной зависимости коэффициента диффузии
Физика
температур 300-450 К расхождение находится в пределах расчетной погрешности, однако в об
ласти более высоких температур моделирование несколько занижает величину D.
Существует альтернативный безакти-вационный подход к рассмотрению процессов диффузии в жидкости. Для многих из них зависимость коэффициента само-диффузии D в широком диапазоне температур описывается уравнением Арре
0,45 ч
0,40 -
0,35-
ниуса, которое при учете приложенного
давления,
D-Dq exp
имеет вид
—- [HL где Do
постоянная слабо зависящая от температуры, Ed - молярная энергия активации, 7? - универсальная газовая постоянная, VD - так называемый активационный объем. Зависимость 1п(£>) при высоком давлении, как видно из рис. 4, ведет себя
0,30-
0,25 -
0,20 -
0,15-
■ —Т=700 К
• -Т=600 К
▼- Т=500 К
Молярный объем, см3/моль
Рис. 6. Зависимость ОТ”0,763 от молярного объема, построенная по данным МД-моделирования
прямо пропорционально \(Т в диапазоне от 300 К до 700 К. Это позволяет нам выделить актива
ционные параметры:
^DP ~
dln(D)
Sln(l/r)Jp
R и Vd=-RT
dln(Z>)
ЭР
. Результаты расчета указан
ных величин приведены в табл. 1. Для сравнения там же приведены определенные экспериментально значения энергии активации при постоянном объеме Edv , которые определяются аналогично и согласно [10] слабо отличаются от величин EDP . Результаты сравнения показывают, что найденные при моделировании энергии активации находятся в неплохом согласии с данными эксперимента. При увеличении температуры, при постоянной плотности, энергия активации убывает, а при увеличении плотности, при постоянной температуре, - увеличивается. Расхождение значений энергии активации при моделировании и эксперименте, не выходит за границы допустимой погрешности, и возникает в первую очередь из-за отличий в определении EDP и Edv . Активационный объем VD меняется следующим образом: при 7=700 К - от 9,6 см3/моль при 2,5 кбар до 33,7 см3/моль при 0,95 кбар, при Т= 600 К - от 6,2 см3/моль при 2,5 кбар до 14,8 см3/моль при 0,95 кбар, что согласуется с экспериментальными данными[10].
Таблица 1
Сравнение расчетных и экспериментальных значений энергии активации
|
Моделирование |
Эксперимент |
||||
|
р, кг/м3 |
Т,К |
Edp , кДж/моль |
р, кг/м3 |
Т , К |
Edv , кДж/моль |
|
928 |
425 |
11,5 |
940 |
423 |
12,2 |
|
964 |
387 |
10,7 |
9,6 |
383 |
14,3 |
|
955 |
425 |
11,9 |
940 |
423 |
12,2 |
|
987 |
387 |
11,7 |
980 |
383 |
13,6 |
|
1016 |
350 |
11,4 |
1020 |
343 |
14,1 |
|
977 |
425 |
10,6 |
980 |
423 |
7,9 |
|
1007 |
387 |
10,1 |
1000 |
383 |
11,8 |
Существует еще одна точка зрения на природу диффузии, согласно которой основную роль играют не активационные процессы, а случайное перераспределение свободного пространства внутри жидкости [13]. При такой трактовке зависимость коэффициента диффузии от температу ры и давления имеет вид [10, 13]
В(Р) ' T-W))
D = А(Р^2 ехр
Булдашев И.В., Мирзоев А.А.
Как видно из рис. 5, указанная зависимость также прекрасно описывает температурное поведение коэффициента диффузии воды в исследуемом диапазоне состояний, как и уравнение Аррениуса. Получаемые при такой подгонке значения коэффициентов А, В, То приведены в табл. 2 для ряда значений давления.
Отметим также, что в работе [13] была теоретически выведена и подтверждена экспериментально зависимость D ос TnVm , где Vm - молярный объем вдоль изотерм в сверхкритической области. Полученные нами результаты моделирования подтверждают указанную зависимость при значении и = 0,763 в диапазоне температур 500-700 К (рис. 6).
Таблица 2
Зависимость коэффициентов А,В,ТУ от давления
|
Давление, кбар |
0,8 |
0,9 |
1,0 |
1,5 |
3 |
|
А |
2273,3 |
147,9 |
94,0 |
27,0 |
9,8 |
|
В |
11196,7 |
4833,0 |
4125,3 |
2487,8 |
1618,7 |
|
То |
-947,0 |
-460,7 |
-398,5 |
-227,6 |
-130,4 |
Таким образом, проведенное нами моделирование самодиффузии в широком температурном диапазоне вдоль нескольких изобар в сверхкритической области состояний, позволяет сделать следующие выводы:
-
а) потенциал SPC позволяет получать количественно точные значения коэффициента диффузии воды в диапазоне 300-500 К, однако в области более высоких температур приводит к заниженным оценкам указанной величины;
-
б) температурная зависимость коэффициента самодиффузии воды при различных значениях давления одинаково хорошо аппроксимируется как кривыми типа Аррениуса, так и уравнением Коэна-Турнбулла [13];
-
в) показано, что предложенная в работе [10] эмпирическая зависимость коэффициента самодиффузии DccTnym, где Vm - молярный объем, при значении п = 0,763 вдоль изотерм в сверхкритической области, выполняется и в исследованном нами диапазоне температур 500-700 К.
Список литературы Определение коэффициента самодиффузии воды в пакете Gromacs
- Malenkov, G.G. Liquid water and ices: understanding the structure and physical properties/G.G. Malenkov//J. Phys.: Condens. Matter. -2009. -V. 21. -P. 283101(35 pp.).
- Toukan, K. Molecular-dynamics study of atomic motions in water/K. Toukan, A. Rahman//Phys. Rev. B. -1985. -V. 31. -P. 2643-2648.
- Harrington, S. Liquid-Liquid Phase Transition: Evidence from Simulations/S. Harrington, R. Zhang, P.H. Poole et al. II Phys. Rev. Lett. -1997. -V. 78. -P. 2409-2412.
- Саркисов, Г.Н. Структурные модели воды/Г.Н. Саркисов//УФН. -2006. -Т. 176. -Вып. 8.-С. 833-845.
- Berendsen, H.J.C. Interaction models for water in relation to protein hydration/H.J.C. Berendsen, J.P.M. Postma, W.F. van Gunsteren et al. II Intermolecular forces. -Dordrecht: D. Reidel Publishing Company, 1981. -P. 331-342.
- Киселев, М.Г. Влияние отталкивательного взаимодействия на структурные и динамические особенности жидкой воды. Роль молекулярной поляризуемости/М.Г. Киселев, Ю.П. Пуховский, Д.В. Ивлев и др.//Журнал структурной химии. -1999. -Т. 40. -Вып. 2. -С. 296-303.
- Star, F.W. Dynamics of simulated water under pressure/F.W. Star, F. Sciortino, H.E. Stanley//Phys. Rev. E -1999. -V. 60. -P. 6757-6768.
- Berendsen, H.J.C. Molecular dynamics with coupling to an external bath/H.J.C. Berendsen, J.P.M. Postma, A. DiNola et al. II J. of Chem. Phys. -1984. -V. 81. -P. 3886-3892.
- Spoel, D. A systematic study of water models for molecular simulation: Derivation of water models optimized for use with a reaction field/D. Spoel, P.J. van Maaren, H.J.C. Berendsen//J. of Chem. Phys.-1998.-V. 108.-P. 10220-10229.
- Krynicki, K. Pressure and temperature dependence of self-diffusion in water/K. Krynicki, CD. Green, D.W. Sawyer//Faraday Discuss. Chem. Soc. -1978. -V. 66. -P. 199-208.
- Жирифалько, Л.А. Статистическая физика твердого тела/Л.А. Жирифалько; пер. с англ. А.В. Ведяева, Ю.Г. Рудого. -М.: Мир, 1975. -382 с.
- Cohen, M.H. Molecular Transport in Liquids and Glasses/M.H. Cohen, D. Turnbull//J. of Chem.Phys.-1959.-V. 31.-P. 1164-1169.
- Lamb, W.J. Self-diffusion in compressed supercritical water/W.J.Lamb, G.A.Hoffman, J. Jonas//J. of Chem. Phys. -1981. -V. 74. -P. 6875-6880.