Определение острой токсичности комплексного фитоэкстракта на белых мышах
Автор: Убеева Елена Алексанровна, Ботоева Елена Аполлоновна, Убеева Ираида Поликарповна, Николаев Сергей Матвеевич, Цыбикова Елена Николаевна
Журнал: Вестник Бурятского государственного университета. Медицина и фармация @vestnik-bsu-medicine-pharmacy
Статья в выпуске: 3-4, 2018 года.
Бесплатный доступ
При определении острой токсичности нового комплексного фитосредства, состоящего из гипекоума прямого Hypecoum erectus L., копеечника даурского Hedysarum dauricum, солодки уральской Glycyrhhiza uralensis Fischer, календулы лекарственной Calendula officinalis и шлемника байкальского Scutellaria baicalensis на белых мышах с помощью двух способов: метода Кербера и пробит-анализа, получены сходные результаты.
Комплексное растительное лекарственное средство, острая токсичность, пробит-анализ
Короткий адрес: https://sciup.org/148316809
IDR: 148316809 | УДК: 615.322
Текст научной статьи Определение острой токсичности комплексного фитоэкстракта на белых мышах
В настоящее время ввиду широкого распространения патологии печени, нередких хронических и затяжных форм вирусных гепатитов, частоты токсических медикаментозных и алкогольных повреждений особую актуальность приобретает получение гепатопротективных средств [1, 2]. Значительный успех в лечении вирусных гепатитов достигнут в последние годы с помощью новых противовирусных препаратов, но их применение требует индивидуального подхода с учетом биологических свойств вируса, генетических свойств иммунной системы пациента, функционального состояния печени, особенностей патологического процесса, токсических реакций [6, 8]. Перспективным представляется создание растительных лекарственных средств, обладающих широким спектром фармако-терапевтического воздействия, низкой токсичностью и возможностью потенцировать эффект благодаря сочетанию различных биологически активных веществ, особенно в комплексных фитосредствах [3, 4, 5].
Цель работы
Определение острой токсичности и основных токсикологических параметров нового комплексного фитосредства по методу Кербера и проведение пробит-анализа.
Материалы и методы
Работа проводилась 56 на белых мышах обоего пола с массой тела 16‒20 г. Содержание животных осуществляли в соответствии с «Правилами лабораторной практики (GLP)» и Приказа МЗ РФ № 708Н от 23.08.2010 г. «Об утверждении правил лабораторной практики». Лабораторные животные, соответствующие требованиям для включения в эксперимент, разделялись на группы с учетом пола, возраста, массы и принципа рандомизации. Экспериментальную работу проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР № 755 от 12.08.77 г.), «Правилами, принятыми в Европейской конвенции по защите позвоночных животных» (Страсбург, 1986). Протокол исследования согласован с комитетом по этике БГУ (№ 2 от 04.12.2016).
Объектом исследования являлось новое комплексное растительное средство, представляющее собой комплексный сухой экстракт. Состав фитополиэкстракта представлен сухими экстрактами травы гипекоума прямостоячего ( Hypecoum erectum L.; Papaveraceae), травы копеечника альпийского ( Hedysarum alpinum L.; Leguminosae), корней солодки уральской ( Glycyrrhiza uralensis Fisch.; Leguminosae), цветков календулы лекарственной ( Calendula officinalis L.; Compositae) и корней шлемника байкальского ( Scutellaria baicalensis Georgi; Lamiaceae) в соотношении 5:5:4:4:2.
Количественную стандартизацию средства осуществляли методом ВЭЖХ-УФ с использованием микроколоночного жидкостного хроматографа Милихром А-02 (Эконова, Новосибирск, Россия), снабженного колонкой ProntoSIL-120-5-C18 AQ (2×75 мм, ∅ 5 мкм; Metrohm AG, Herisau, Switzerland); подвижная фаза: 0.2 М LiClO 4 в 0.006 M HClO 4 (А), MeCN (В). Для разделения компонентов использован градиентный режим элюирования (0 - 40 мин 5 - 100% В, 40 - 43 мин 100% В) со скоростью 100 мкл/мин при температуре 35°С и УФ-детектировании при 270 нм. Расчет содержания соединений проводили с использованием коммерчески доступных образцов сравнения (Sigma-Aldrich). Содержание маркерных компонентов в средстве: глицирризиновая кислота 2.06±0.04%, байкалин 1.85±0.04%, протопин 1.09±0.03%, мангиферин 0.68±0.02%, сумма тифанеозида и нарциссина 0.27±0.01%.
Вычисление LD50 проводилось по методу Кербера с применением пробит-анализа. Определение острой токсичности по методу Кербера на белых мышах [7] осуществлялось при однократном внутрибрюшинном введении фитополиэкс- тракта в группах по 8 особей в диапазоне доз: от 3 000 до 6 000 мг/кг. Все испытуемые дозы фитосредства растворяли в дистиллированной воде до необходимого объема, составляющего 1,0 мл / 100 г массы животного. В дополнение к вычислению LD50 методом Кербера [7] был применен пробит-анализ, предложенный D.J. Finney [9, 10].
Результаты исследования
При определении острой токсичности в течение первых суток наблюдали поведение белых мышей, их активность, потребление пищи и воды. Для оценки токсичности комплексного фитоэкстракта рассматривали общее состояние белых мышей, характер клинических проявлений интоксикации, возможный летальный исход и морфологические изменения внутренних органов экспериментальных животных (табл. 1).
При введении группам белых мышей изучаемого комплексного фитосредства в дозах 3 000, 3 500, 4 000 мг/кг общее состояние животных в данных группах не страдало, они оставались активными, сохраняли аппетит. При введении фитополиэкстракта в дозе 4 500 мг/кг отмечалось незначительное снижение активности у трех мышей из 8 через 4 часа после введения исследуемого фитосредства, в дальнейшем признаки интоксикации наросли, два животных отказались от приема корма и в дальнейшем через12 часов погибли.
При введении изучаемого фитополиэкстракта группам животных в дозах 5 000, 5 500 мг/кг состояние мышей нарушалось в более ранние сроки ― через 3 часа: отмечалось ограничение подвижности, вялость, слабая реакция на внешние раздражители, отказ от приема корма, животные предпочитали сидеть группами рядом с водой. Через два часа после введения белым мышам исследуемого фитополиэкстракта в дозе 6 000 мг/кг у животных движения стали скованными, мыши лежали с закрытыми глазами. Через три часа животные из названной группы были полностью неподвижны. Участились акты дефекации, по истечении 5 часов после введения фитосредства помет потерял каловый характер: стал водянистым с большим количеством слизи. Гибель животных в группе с дозировкой 6 000 мг/кг наблюдалась на 6-й и 7-й час после введения. В группе с дозой 5 500 мг/кг введенного средства через 8 - 12 часов погибли три животных и далее в течение первых суток еще три животных.
Таблица 1
|
Доза, мг/кг |
3 000 |
3 500 |
4 000 |
4 500 |
5 000 |
5 500 |
6 000 |
|
|
Выжило экстракта |
8 |
8 |
8 |
6 |
4 |
2 |
0 |
|
|
Погибло мышей |
0 |
0 |
0 |
2 |
4 |
6 |
8 |
|
|
Z |
0 |
0 |
1 |
3 |
5 |
7 |
||
|
D |
500 |
500 |
500 |
500 |
500 |
500 |
||
|
Z*D |
0 |
0 |
500 |
1 500 |
2 500 |
3 500 |
||
|
Σ(Z*D)=8000 |
||||||||
Результаты определения острой токсичности фитополиэкстракта методом Кербера
D ― интервал между двумя смежными дозами;
Z ― среднее арифметическое из двух значений числа тест-объектов, у которых проявился положительный эффект при воздействии каждой из двух смежных доз;
n ― число тест-объектов в группе.
LD50 = LD100 ― Σ(Z*D)/n
LD50 = 6000 ― 8000/8 = 5000 мг/кг.
Полученные результаты, характеризующие острую токсичность комплексного фитоэкстракта, обработаны с использованием формул в среде Visual Basic в MS Excel, данные представлены в таблице 2.
Таблица 2
Оценка показателей острой токсичности методом пробит-анализа
|
D, мг/кг |
3 000 |
3 500 |
4 000 |
4 500 |
5 000 |
5 500 |
6 000 |
|
Выжило |
8 |
8 |
8 |
6 |
4 |
2 |
0 |
|
Погибло |
0 |
0 |
0 |
2 |
4 |
6 |
8 |
|
X (logD) |
3.477 |
3.544 |
3.602 |
3.653 |
3.698 |
3.740 |
3.778 |
|
Эффект в пробитах Y |
0 |
0 |
0 |
4,33 |
5,0 |
5,67 |
7,33 |
В дальнейшем данные острой токсичности комплексного фитоэкстракта (LC) подвергались программной статистической обработке с доверительным интервалом и приведены в таблице 3.
Таблица 3
Значения LD комплексного фитоэкстракта на основании пробит-анализа
|
Вероятность развития эффекта |
D, мг/кг (доза) |
CI 95% (доверительный интервал) |
|
|
0,010 |
3782,69062 |
2632,93526 |
4229,23950 |
|
0,020 |
3925,55843 |
2898,21726 |
4333,34087 |
|
0,025 |
3974,71066 |
2989,07284 |
4369,56792 |
|
0,05 |
4139,85848 |
3292,28538 |
4493,34351 |
|
0,10 |
4330,26335 |
3636,22888 |
4641,68998 |
|
0,20 |
4560,82872 |
4038,50532 |
4835,53813 |
|
0,25 |
4648,42153 |
4184,63371 |
4915,88012 |
|
0,50 |
5001,91837 |
4705,15877 |
5309,31779 |
|
0,75 |
5355,41521 |
5085,53147 |
5842,90782 |
|
0,80 |
5443,00802 |
5163,99464 |
5990,91503 |
|
0,90 |
5673,57339 |
5354,73438 |
6396,29988 |
|
0,95 |
5863,97826 |
5501,70268 |
6741,62156 |
|
0,975 |
6029,12608 |
5624,73427 |
7045,57810 |
|
0,980 |
6078,27831 |
5660,79188 |
7136,60312 |
|
0,990 |
6221,14612 |
5764,49557 |
7402,28279 |
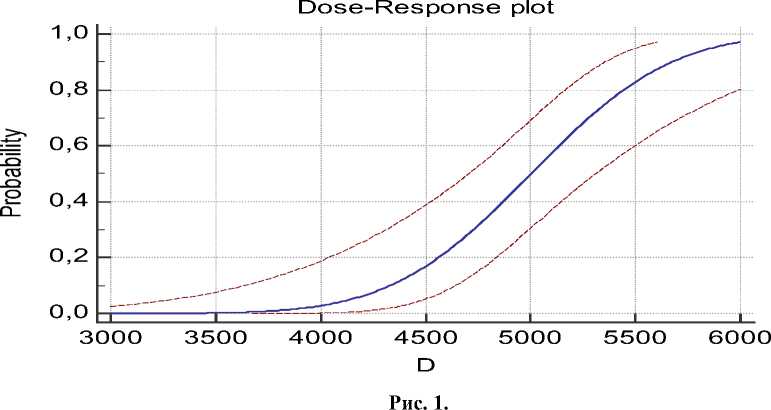
С использованием приведенных значений выполнено построение графика доза-эффект (рис. 1) с 95%-ным доверительным интервалом. В результате про-бит-анализа, проведенного с помощью введения данных в MS Excel с дальнейшим расчётом средствами Visual Basic, выяснено, что LD50 комплексного растительного лекарственного средства составляет 5 002 мг/кг. Сравнивая результаты двух методов определения LD50: методом Кербера и пробит–анализа, можно констатировать получение аналогичных результатов при изучении острой токсичности и как следствие возможность использования любого из них, так как различия не превышают 0,1% в зависимости от метода, взятого за эталон.
Выводы
Результаты проведенных исследований острой токсичности изучаемого фитополиэкстракта позволяют отнести средство к относительно безвредным веществам по действующей классификации на основании использования двух методов: Кербера и пробит-анализа [7].
Список литературы Определение острой токсичности комплексного фитоэкстракта на белых мышах
- Гастроэнтерология. Клинические рекомендации / под ред. В. Т. Ивашкина. М.: Гэотар-Медиа, 2008. 704 с.
- Инфекционные болезни: национальное руководство / под ред. Н. Д. Ющука, Ю. Я. Венгерова. М.: Гэотар-Медиа, 2010. 1056 с.
- Лесиовская Е. Е. Доказательная фитотерапия. М.: Медицина, 2014. Ч. 1. 214 с., ч. 2. 684 с.
- Никонов Г. К., Мануйлов Б. М. Основы современной фитотерапии. М.: Медицина, 2005. 520 с.
- Николаев С. М. Фитофармакотерапия и фитофармакопрофилактика заболеваний. Улан-Удэ, 2012. 286 с.
- Рекомендации по диагностике и лечению взрослых больных гепатитом С / Н. Д. Ющук и [и др.]. Изд. 3, испр. и доп. М.: Гэотар-Медиа, 2017. 96 с.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под ред. Р. У. Хабриева. М., 2012. 832 с.
- Шерлок Ш., Дули Д. Заболевания печени и желчных путей: пер. с англ. / под ред. З. Г. Апросиной, Н. А. Мухина. М.: Гэотар-мед, 2002. 864 с.
- Hayes, W. J. and C. L. Kruger(eds). Handbook of Haye’s principles and methods of toxicology. 2014. 6th Edition. New York, NY, USA: CRC Press, Boca Raton.
- Probit Analysis, 3rd ed. By D. J. Finney, Cambridge University Press, 32 E. 57th St., New York, Ny 10022, 1971. xv + 333 p.


