Определение типа растворителя в технологии производства экстрактов чая с антиоксидантной активностью
Автор: Карпова М.О., Макарова Н.В., Игнатова Д.Ф., Будылин Д.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (86), 2020 года.
Бесплатный доступ
Целью исследования стало определение типа растворителя, позволяющего максимально полно экстрагировать антиоксидантные вещества из белого, чёрного и зелёного чая (Camellia sinensis). Объектами исследования выступали экстракты трёх видов чая, полученные с использованием различных растворителей: вода, смесь вода-этанол (75% об. /25% об.), смесь вода-этанол (50% об. /50% об.), смесь вода-этанол (25% об. /75% об.) и этанол (96%). В экстрактах белого, чёрного и зелёного чая определяли общее содержание фенольных веществ, флавоноидов, антирадикальную активность по методу DPPH, восстанавливающую силу по методу FRAP. Максимальные значения общего содержания фенольных веществ обнаружены в экстракте белого чая на основе этанола и системы растворителей вода-этанол (50/50), чёрного чая при экстрагировании водой, зелёного чая с соотношением растворителей вода-этанол (50/50). Высокие показатели общего содержания флавоноидов установлены для экстракта белого чая на основе системы растворителей вода-этанол (50/50), чёрного чая при экстрагировании водой, зелёного чая, при использовании в качестве растворителя этанола. Низкая антирадикальная активность обнаружена в экстракте белого чая на основе системы растворителей вода-этанол (50/50), у чёрного чая на основе этанола, а зелёный чай показал низкие значения при экстрагировании водой. Наибольший показатель восстанавливающей силы обнаружен в экстракте белого чая на основе системы растворителей вода-этанол (25/75), у чёрного и зелёного при экстрагировании водой. Таким образом, в результате исследования экстрактов белого, чёрного и зелёного чая установлено, что при экстракции белого чая системой растворителей вода-этанол (50/50) извлекается наибольшее количество антиоксидантных веществ. Максимальное количество антиоксидантов из чёрного и зелёного чая экстрагируется при использовании в качестве растворителя воды.
Антиоксидантная активность, чай белый, чай черный, чай зеленый, фенолы, флавоноиды
Короткий адрес: https://sciup.org/140257260
IDR: 140257260 | УДК: 663.958.8 | DOI: 10.20914/2310-1202-2020-4-169-178
Текст научной статьи Определение типа растворителя в технологии производства экстрактов чая с антиоксидантной активностью
Технология экстракции подразумевает перенос соединений из твердого вещества или жидкости в другой растворитель или фазу [1]. В аналитической, химической лаборатории чаще всего используют твёрдо-жидкостную экстракцию. Соединения переходят из твердой фазы в жидкую в зависимости от растворимости. Кратким руководством по растворимости является принцип «подобное растворяет подобное», означающий, что неполярные соединения должны быть легко извлечены в неполярные растворители (и наоборот). Экстракция – это
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
технология, которая широко применяется в пищевой промышленности и в фармацевтической химии. Комплекс биологически активных веществ извлекается из исходного сырья с помощью жидкого растворителя. На скорость извлечения, выход, состав извлекаемых биологически активных веществ влияют многие факторы. Одним из основных является тип используемого растворителя.
В биологической системе активные формы кислорода (АФК) и активные формы азота (АФА), такие как супероксидные, гидроксильные и оксидные радикалы, могут повредить ДНК и привести к окислению липидов и белков в клетках. Как правило, антиоксидантная система, встречающаяся в организме человека, может удалять эти радикалы, которые сохраняют баланс между окислением и антиокислением. Тем не менее, воздействие курения сигарет, алкоголя, радиации или токсинов окружающей среды вызывает выработку избыточных АФК и АФА, которые нарушают баланс между окислением и антиокислением и приводят к некоторым хроническим и дегенеративным заболеваниям. Увеличение потребления экзогенных антиоксидантов уменьшит ущерб, вызванный окислительным стрессом, путем ингибирования инициации или распространения окислительной цепной реакции, действующей в качестве поглотителей свободных радикалов, гасителей синглетного кислорода и восстановителей [2].
Экзогенные антиоксиданты преимущественно получают из пищевых и лекарственных растений, а именно: из фруктов, овощей, круп, грибов, напитков, цветов, специи и традиционных лекарственных трав. Кроме того, отрасли, перерабатывающие побочные продукты сельского хозяйства, также являются потенциально важными источниками природных антиоксидантов. Этими природными антиоксидантами из растительного сырья являются в основном полифенолы (фенольные кислоты, флавоноиды, антоцианы, лигнаны и стильбены), каротиноиды (ксантофиллы и каротины) и витамины (витамины Е и С). Как правило, эти природные антиоксиданты, особенно полифенолы и каротиноиды, проявляют широкий спектр биологических эффектов, таких как противовоспалительное, антибактериальное, противовирусное и противоопухолевое [3].
Влияние технологии экстрагирования, уровня технологических параметров, типа используемых инновационных воздействий на антиоксидантную активность растительного сырья рассматривается в целом ряде работ [4]. Для семян бурхавии раскидистой ( Boerhavia elegana choisy ) проведены исследования
На примере айвы бенгальской ( Aegle mar-melos ) индийские ученые изучили [5] шесть типов растворителей (абсолютный метанол, абсолютный этанол, водный метанол, водный этанол, гидроспирт, вода) для максимального извлечения фенолов и флавоноидов. Для фенолов и флавоноидов это был разный тип растворителя: для фенолов – водный этанол, для флавоноидов – вода.
Для ягод шелковицы был использован [6] ряд растворителей (вода, метанол, ацетон, этанол) как индивидуально, так и в смеси друг с другом и при добавлении уксусной кислоты. Для полученных экстрактов изучены такие показатели, как общее содержание фенолов, антиоксидантная активность по DPPH, FRAP, ABTS методам. Высокие значения содержания фенольных веществ были достигнуты при использовании в качестве растворителя подкисленного метанола. Результаты анализов антиоксидантной способности (DPPH, FRAP, ABTS,) показали, что органические растворители на водной основе увеличивают антиоксидантные свойства экстрактов по сравнению с водой или чистыми органическими растворителями.
Для ягод мирта ( Myrtus communi ) изучено несколько типов растворителей (вода, горячая вода, этанол, метанол, этанол / вода, метанол / вода) с целью получения экстрактов с максимальными показателями по содержанию фенолов, восстанавливающей силы. Именно метанольные и этанольные экстракты ягод мирта или их водные аналоги приводят к решению намеченной цели [7].
На примере растения Guiera senegalensis J.F . из Западной Африки (Нигерия) [8] показано влияние природы пяти типов растворителей (вода, метанол, этанол, ацетон, хлороформ) на уровень таких показателей, как общее содержание фенолов, флавоноидов, уровень улавливания свободных радикалов DPPH, восстанавливающей силы FRAP. Самые высокие значения общего содержания флавоноидов видны при использовании в качестве растворителя ацетона, а также ацетон имел незначительные различия с другими растворителями, которые показали более высокие значения для общего содержания фенолов, FRAP и общей антиоксидантной способности.
Вода, 50%-ный метанол, этанол, 50%-ый этанол, ацетон, 50%-ный ацетон, этилацетат использовали в качестве растворителей для экстракции фенольных соединений, способных улавливать свободные радикалы на примере чёрного чая и ряда травяных композиций. Интересно отметить, что для каждого растительного объекта уровень изученных показателей колеблется в широких пределах в зависимости от типа растворителя [9].
Индонезийские ученые провели исследование экстракции листьев зелёного чая Camellia sinensis L . В качестве растворителя используется 20%-ный этанол, в качестве контролирующего параметра – общее содержание фенолов, в качестве переменных параметров выступают температура экстракции, время экстракции. Необходимо отметить, что общее содержание фенолов для листьев зелёного чая повышается с увеличением времени и температуры экстракции [10].
Малазийские учёные для процесса экстракции листьев растения Cosmos caudatus , собранного на территории Malacca (Малайзия), использовали два типа растворителя – вода и этанол. Для экстрактов изучено общее содержание фенолов, флавоноидов, антиоксидантная активность по FRAP и DPPH методам, количественное содержание галловой, хлорогеновой, кофейной, ванилиновой, п -кумариновой, синапи-новой, феруловой кислот, катехина, эпикатехиная, рутина, мирицетина, кверцетина, нарингенина кемпферола. Листья растения C. сaudatus , извлеченные с использованием воды, обладают самым мощным антиоксидантом, что предполагает их потенциальное применение в качестве полезных для здоровья функциональных ингредиентов или натуральных консервантов в пищевых и фармацевтических продуктах [11].
В традиционной медицине Малайзии для лечения ряда заболеваний, таких как диабет, ревматизм, гипертензия, используется растение Averrhoa bilimbi . Для этого растения проведено изучение влияния нескольких типов растворителей: этанол, 50%-ный этанол, метанол, 50%-ный метанол, пропанол, 50%-ый пропанол, н -гексан на уровень общего содержания фенолов, флавоноидов, степень улавливания свободных радикалов DPPH. Высший уровень фенолов из A. Bilimbi возможно получить с помощью пропанола, флавоноидов и антирадикальной активности – 50%-го метанола [12].
Подбор оптимального типа растворителя является целью работы [13] для получения экстрактов с высоким уровнем показателей общего содержания фенолов, флавоноидов, антиоксидантной активности для двух видов растений, используемых в медицине: Bucida buceras L . для лечения грибковых инфекций, Phoradendron californicum – заболеваний вен. Использовались четыре системы растворителей – ацетон, метанол, этанол, вода. Уровень
Отходы от переработки пищевого сырья являются ценными источником биологически активных веществ, в том числе с антиоксидантной активностью. В работе [14] турецких учёных осуществлён подбор оптимального растворителя (вода, метанол, этанол, ацетонитрил, ацетон, 50%-ный метанол, 50%-ный этанол, 50%-ный ацетонитрил, 50%-ный ацетон) для получения экстрактов с высокими показателями общего содержания фенолов, флавоноидов, антиоксидантной активности (ABTS, DPPH, CUPRAC методы) для растения Macadamia tetraphylla . Только два растворителя – 50%-ный метанол и 50%-ный ацетон обеспечивают высокий уровень большинства показателей.
В данном исследовании [15] доказано влияние содержания воды (50; 75 и 100%)
в трёх типах растворителей (метанол, этанол, ацетон) на уровень общего содержания фенолов, флавоноидов, антиоксидантной активности, выход экстрактов растения Limnophila aromatica . Интересно отметить, что, если для ряда показателей различия в зависимости от природы растворителя составляют несколько процентов, тогда как для других – в десятки раз.
Ученые из Бангладеша провели изучение влияния типа растворителя в процессе экстракции растения Ganoderma lucidum . В качестве растворителей использованы диэтиловый эфир, этанол, бутанол, хлороформ, ацетон или их 75%-ные водные растворы. В качестве контролируемых параметров выступают общее содержание фенолов, флавоноидов, антирадикальная активность. По результатам проведённых экспериментов авторы рекомендуют водный 75%-ный ацетон как оптимальную систему для экстракции [16].
Аналогичная методология исследования использована в работе [17]. В качестве исходного сырья выступают семена тунисских фиников, в качестве растворителей – метанол и ацетон и их 80%-ные водные растворы, в качестве контролируемых параметров – общее содержание фенолов, флавоноидов, антиоксидантная активность. Авторы считают, что решающее влияние на изученные показатели имеет полярность растворителя.
Таким образом, на основании анализа данных литературных источников, можно сделать вывод о решающем влиянии типа (природы, полярности) растворителя, используемого для экстракции, на уровень значений антиоксидантной активности, а также, что тип экстрагента в каждом конкретном случае растительного объекта должен подбираться индивидуально. Столь широкомасштабные исследования по подбору растворителя для китайского белого,
Karpova M.O. et al. Proceedings of VSUET, 2020, vol. 82, no. чёрного и зелёного чая ( Camellia sinensis ) в РФ не проводились. Целью нашего исследования был подбор оптимального растворителя для трёх видов чая.
Путем предварительных экспериментов было установлено, что содержание сухих веществ в чёрном и зелёном чае интенсивно увеличивается только в первые два часа экстрагирования. Температура экстракции 37 ° С - это оптимальная температура, которая обеспечивает сохранность всех известных биологически активных веществ в растительных объектах.
Чай является одним из самых распространенных напитков во всем мире, который производится из листьев кустарника Camellia sinensis . Общее число соединений, входящих в его состав, выделенных к началу XXI века, составляет около 300, некоторые из них ещё не идентифицированы, а биохимическая роль некоторых из них определена лишь в общих чертах. Интерес к химическому составу чая в настоящее время вызван тем, что многие вещества, содержащиеся в чае, проявляют биологическую активность и могут быть использованы для профилактики различных заболеваний [18]. Многие исследования доказали, что чай предотвращает болезнь Паркинсона, сердечно-сосудистые заболевания, рак, нарушения иммунитета и снижает уровень холестерина в крови [19].
Материалы и методы
Для исследования были выбраны китайский белый, чёрный и зелёный чай (Camellia sinensis) . Для 3-x видов чая были получены экстракты на основе 5 типов растворителей:
-
1. 100% вода;
-
2. 25% вода/75% этанол (96%);
-
3. 50% вода/50% этанол (96%);
-
4. 75% вода/25% этанол (96%);
-
5. 100% этанол (96%).
В эксперименте использовалась вода дистиллированная и спирт высшей степени очистки 96%.
Таким образом, на испытания было представлено по 5 образцов, в которых определяли показатели:
-
• Общее содержание фенольных веществ;
-
• Общее содержание флавоноидов;
-
• Антирадикальную активность по методу DPPH;
-
• Восстанавливающую силу по методу FRAP.
Получение экстракта: Чай измельчают до размеров частиц 0,5 мм. Измельченный чай в количестве 2 г переносят в стеклянную колбу с притертой крышкой и заливают 20 см3 растворителя (для каждого растворителя по 3 колбы). Экстракция чая продолжается 2 ч в термостате при температуре 37 °C. Полученный экстракт фильтруют через бумажный фильтр в колбу.
Определение общего содержания фенольных веществ в экстрактах чая проводилось на основе методики [20] с актуализацией для экстрактов чая. В экстракт чая на основе выбранного растворителя в количестве 0,25 см3 добавляют воду в количестве 4 см3, 0,25 см3
водного раствора реактива Фолина-Чокалтеу (в соотношении 1:1), 0,25 см3 раствора насыщенного карбоната натрия. Полученную смесь оставляют на 30 мин, оптическую плотность проб измеряют на спектрофотометре (КФК-3–01 «3ОМЗ») при длине волны 725 нм. По полученным значениям оптической плотности, используя калибровочную кривую, находят значения общего содержания фенольных веществ в мг галловой кислоты / 100 г. исходного сырья.
В качестве стандартного вещества для построения калибровочной кривой использована галловая кислота ХЧ (химически чистая).
Общее содержание флавоноидов в экстрактах чая исследуют фотометрическим методом. Измерения оптической плотности раствора на спектрофотометре проводят при длине световой волны 510 нм. Для обработки результатов измерений в качестве исходной методики была взята [21] с изменениями для экстрактов чая. В исследуемый экстракт чая объёмом 0,5 см3 добавляют 2,5 см3 дистиллированной воды, затем 0,15 см3 раствора нитрита натрия с концентрацией 5%, экспозиция 5 мин, прибавляют 0,3 см3 10%-го раствора хлорида алюминия, оставляют на 5 мин. Результаты общего содержания флавоноидов определяют по калибровочной кривой и выражают в мг катехина / 100 г. исходного сырья. В качестве стандартного вещества для построения калибровочной кривой использован катехин
Определение антирадикальной активности по методу DPPH экстрактов чая в изучаемых растворителях проводилось с использованием раствора 2,2-дифенил-1-пикрилгидразила (DPPH) в этаноле, имеющего насыщенную пурпурно-синюю окраску. Методика [22] была взята за базу и доработана для экстрактов чая. Из экстрактов на основе каждого типа растворителя для каждого образца чая приготавливают растворы различной концентрации, из которых наливают в пробирку 0,2 см3, добавляют 2 см3 дистиллированной воды, 2 см3 раствора DPPH. Готовые растворы оставляют в затемненном месте на 30 мин. На спектрофотометре измеряется оптическая плотность полученных растворов при длине световой волны 517 нм. Определение антирадикальной активности по методу DPPH ведется по показателю Ес50, как концентрации экстракта чая, необходимой для поглощения 50% свободных радикалов DPPH.
В качестве исходной методики для определения восстанавливающей силы по методу FRAP используют метод [23] с модификацией для экстрактов чая. Смешивают в пробирке 0,1 см3 экстракта чая, 3 см3 дистиллированной воды, 1 см3 раствора реагента FRAP и выдерживают 4 мин в термостате при температуре 37 °C. Измерение оптической плотности полученного раствора измеряют на спектрофотометре при длине световой волны 593 нм. Результаты восстанавливающей силы по методу FRAP рассчитывают по калибровочному графику в ммоль Fе2+/1 кг исходного сырья. В качестве стандартного вещества для построения калибровочной кривой использован сульфат железа.
Результаты и обсуждение
Фенолы широко распространены в природе, примеры включают тирозин, одну из стандартных аминокислот, встречающуюся в большинстве белков; адреналин (адреналин), стимулирующий гормон, вырабатываемый мозговым веществом надпочечников; серотонин, нейромедиатор в мозге; и урушиол, раздражитель, выделяемый ядовитым плющом, чтобы животные не ели его листья. Многие из более сложных фенолов, используемых в качестве ароматизаторов, получены из эфирных масел растений. Например, ванилин, основной ароматизатор ванили, выделен из ванильных бобов, и метилсалицилат, который имеет характерный мятный вкус и запах, выделен из грушанки. Другие фенолы, полученные из растений, включают тимол, выделенный из тимьяна, и эвгенол, выделенный из гвоздики. Фенолы в основном известны своим широким
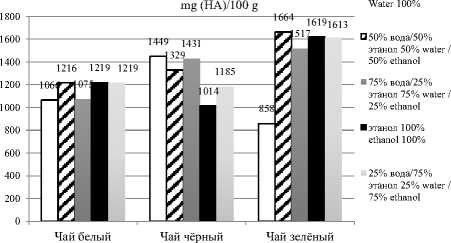
Результаты определения общего содержания фенольных веществ в экстрактах 3-x видов чая представлены на рисунке 1.
В экстрактах белого чая ( Camellia sinensis ) лидерство по содержанию фенольных веществ делят между собой экстракты на основе 100% этанола и смеси 25% вода/75% этанол. При увеличении объёмной доли спирта, добавляемого к смеси вода-этанол, значения содержания фенольных веществ уменьшается в 1,14 раза.
Самое высокое содержание фенольных веществ в чёрном чае ( Camellia sinensis ) наблюдается при его экстракции 100% водой. При возрастании крепости экстрагента значения фенольных веществ уменьшаются.
Максимальное количество фенольных веществ в экстрактах зелёного чая ( Camellia sinensis ) приходится на соотношение 50% вода/ 50% этанол. Экстракты в соотношении 100% этанол, 25% вода/75% этанол и 75% вода /25% этанол достигают в 1,1 раз меньшие значения содержания фенольных веществ. В 2 раза меньшее значение содержания фенольных веществ наблюдается в экстрактах зелёного чая на основе 100% воды.
Полученные значения содержания фенольных веществ сравнивались с данными, приведенными в статьях [25–28].
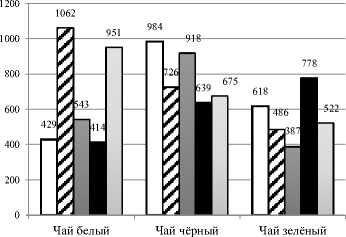
Полученные результаты определения общего содержания флавоноидов в исследуемых экстрактах чая представлены на рисунке 2.
мг (ГК)/100 г aВода 100%
White tea Black tea Green tea
Рисунок 1. Общее содержание фенольных веществ в различных экстрактах белого, чёрного и зелёного чая Figure 1. Total content of phenolic substances in various extracts of white, black and green tеа
мг (К)/100 г mg (K)/100 g
White tea Black tea Green tea
aВода 100%
Water 100%
в50% вода/50% этанол 50% water / 50% ethanol
□75% вода/25% этанол 75% water / 25% ethanol вэтанол 100% ethanol 100% a25% вода/75% этанол 25% water / 75% ethanol
Рисунок 2. Общее содержание флавоноидов в различных экстрактах белого, чёрного и зелёного чая
Figure 2. Total content of flavonoids in various extracts of white, black and green tea
Таким образом, максимальное количество фенольных веществ из белого чая, возможно, экстрагировать как неразбавленным этанолом, так и смесью вода-этанол (50/50). Смесь вода-этанол (50/50) также показывает максимальные значения содержания фенольных веществ и при экстракции зелёного чая, а для получения высоких значений у чёрного чая больше всего подойдет экстракция водой.
Флавоноиды имеют широкий спектр укрепляющих здоровье человека воздействий и являются незаменимым компонентами в различных пищевых, фармацевтических, медицинских и косметических составах. Это связано с их мощными антиоксидантными, противовоспалительными, антимутагенными, антимикробными, антиканцерогенными, сердечно-сосудистыми активностями, способностями по улавливанию от свободных радикалов и другими лекарственными свойствами в сочетании с их эффективностью модулировать основные функции клеточных ферментов [29].
Для белого чая ( Camellia sinensis ), очевидно, что экстракт на основе смеси 50% воды и 50% этанола имеет наивысший показатель содержания флавоноидов. Немного меньший результат по содержанию флавоноидов показала система растворителей вода-этанол (25/75). Практически в 2 раза меньшее количество флавоноидов экстрагируется водой, этанолом и системой 75% вода – 25% этанол.
Чёрный чай ( Camellia sinensis ) достигает наивысшее значение содержания флавоноидов при экстрагировании водой, немного меньшее значение достигается при соотношении 75% вода/25% этанол. При увеличении объема спирта, добавляемого в систему вода-спирт, значения уменьшаются в 1,5 раза.
Наибольшее значение содержания флавоноидов (Camellia sinensis) наблюдается в зелёном чая при его экстракции спиртом. При экстракции водой содержание флавоноидов в 1,3 раза меньше: 618 мг (К)/100 г. В экстрактах с различными соотношениями воды и этанола (25/75, 50/50, 75/25) наблюдается уменьшение содержания флавоноидов в 1,5 раза.
Руководствуясь соображениями снижения материальных затрат при производстве экстрактов, мы делаем вывод о перспективности использования растворителя вода-этанол (50/50) для получения экстракта белого чая с высоким содержанием флавоноидов. Для чёрного чая самым оптимальным и менее затратным растворителем является вода, тогда как для получения наибольшего значения содержания флавоноидов у зелёного чая лучше подойдет этанол.
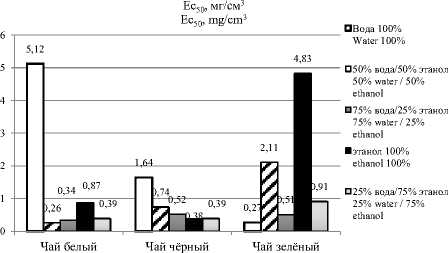
Из результатов исследования (рисунок 3) антирадикальной активности экстрактов белого чая делаем однозначный вывод, что наименьшая антирадикальная активность обнаружена у экстракта на основе смеси вода-этанол (50/50). Экстракты белого чая на растворах вода-этанол 25/75 и 75/25 проявляют свою активность в 1,6 раза выше лидера. Экстракты белого чая на основе спирта в 3,3 раза больше. Водный экстракт белого чая обладает очень большой антирадикальной активностью в 20 раз больше.
В чёрном чае ( Camellia sinensis ) наименьшее значение антирадикальной активности у экстракта на основе этанола и соотношения 25% вода / 75% этанол. Другие экстракты с различными соотношениями воды и этанола имеют показатели антирадикальной активности в 2 раза превышающие первые два значения (50% вода/50% этанол, 75% вода/25% этанол). При экстракции водой значения антирадикальной активности увеличились в 4 раза.
Наименьшее значение антирадикальной активности в экстракте зелёного чая ( Camellia sinensis ) на основе воды, при увеличении процентного содержания спирта увеличиваются и значения антирадикальной активности в экстрактах зелёного чая (75% вода/25% этанол, 50% вода/ 50% этанол, 25% вода/75% этанол, спирт 96%).
White tea Black tea Green tea
Рисунок 3. Антирадикальная активность по методу DPPH в различных экстрактах белого, чёрного и зелёного чая
Figure 3. Antiradical activity by the DPPH method in various extracts of white, black and green tea
ммоль Fe2+ /1 кг
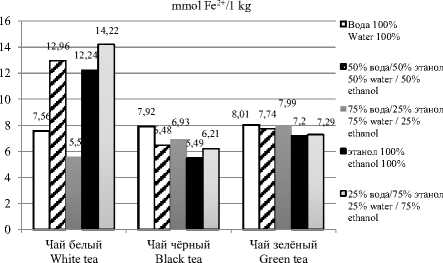
Рисунок 4. Восстанавливающая сила по методу FRAP в различных экстрактах белого, чёрного и зелёного чая
Figure 4. Restoring force by the FRAP method in various extracts of white, black and green tea
Наибольшая активность по улавливанию свободного радикала 2,2 – дифенил-1-пикрилгид-разила наблюдается у экстрактов китайского белого чая с системой растворителей 50% вода/ 50% этанол, у чёрного чая на основе этанола, у зелёного чая при использовании в качестве растворителя воды.
Ионы металлов необходимы для биологической функции, но при избытке они очень вредны. Возможный путь, по которому избыток ионов редокс-активных металлов влияет на клеточную функцию – это реакция Фентона. Переход ионов Cu+/Сu2+ и Fе2+ / Fе3+ катализирует образование реактивных гидроксильных радикалов, которые вызывают постоянную модификацию клеточных липидов, нуклеиновых кислот и белков, что приводит к серьезным окислительным повреждениям [31]. Этот показатель возможно оценить с помощью метода исследования антиоксидантной активности – восстанавливающая сила FRAP.
Наибольший показатель восстанавливающей силы для экстрактов белого чая ( Camellia sinensis ) наблюдался у соотношения растворителей 25/75 вода-этанол. Далее наблюдается понижение восстанавливающей силы в 1,2 раза от смеси 50/50 вода-этанол к полностью спиртовому экстракту. Значительное понижение восстанавливающей силы в 2 раза наблюдается при экстрагировании водой. В 3 раза меньшее значение восстанавливающей силы в экстракте белого чая на основе соотношения растворителей вода 75%/ этанол 25%.
При экстрагировании чёрного чая водой показатель принимает наибольшее значение, а при использовании в качестве растворителя 100% этанола минимальное в 1,4 раза меньше. При уменьшении объема воды, добавляемой в систему вода-спирт: значения восстанавливающей силы уменьшаются.
Экстракт зелёного чая достигает наивысшего значения восстанавливающей силы, на основе воды. При увеличении объема спирта, добавляемого в систему вода-спирт, показатели уменьшают свои значения восстанавливающей силы.
Для увеличения показателя восстанавливающей силы у белого чая нужно использовать систему 25% вода/75% этанол, а для получения высоких значений данного показателя у чёрного и зёленого чая лучше всего подходит экстрагирование водой.
Заключение
По итогам проведения исследования технологических параметров производства экстрактов белого, чёрного и зелёного чая, отличающихся используемым растворителем (100% вода, 25% вода/75% этанол (96%), 50% вода/ 50% этанол (96%), 75% вода/25% этанол (96%), 100% этанол (96%)), были получены следующие результаты:
-
1) максимальные значения общего содержания фенольных веществ обнаружены в экстракте белого и чёрного чая на основе системы растворителей вода-этанол (50/50), у зелёного при экстрагировании водой;
-
2) высокие показатели общего содержания флавоноидов установлены для экстракта белого чая на основе системы растворителей вода-этанол (50/50), для экстрактов чёрного и зелёного чая на основе воды и этанола соответственно;
-
3) низкая антирадикальная активность обнаружена в экстракте китайского белого чая на основе системы растворителей вода-этанол (50/50), у чёрного чая при соотношении растворителей вода-этанол (25/75), а зелёный чай показал низкие значения при экстрагировании водой;
-
4) наибольший показатель восстанавливающей силы обнаружен в экстракте белого чая на основе системы растворителей вода-этанол (25/75), у чёрного и зелёного при экстрагировании водой.
Таким образом, в результате исследования экстрактов белого, чёрного и зелёного чая установлено, что при экстракции белого чая системой растворителей вода-этанол (50/50) извлекается наибольшее количество антиоксидантных веществ. Максимальное количество антиоксидантов из чёрного и зелёного чая экстрагируется при использовании в качестве растворителя воды.
Работа выполнена в рамках государственного задания на фундаментальные исследования Самарского государственного технического университета № 0778-2020-0005.
Список литературы Определение типа растворителя в технологии производства экстрактов чая с антиоксидантной активностью
- Chemat F., Vian M.A. Alternative solvents for natural products extraction // Green Chem. Sustainable Technol. 2014. V. l.P. 1-315. doi: 10.1007/978-3-662-43628-8
- Xu D., Li Y., Meng X., Zhou T. et al. Natural antioxidants in foods and medicinal plants: extraction, assessment and resources//Int. J. Mol. Set. 2017. V. 18. P. 1-32. dot: 10.3390/ijmsl8010096
- Muronetz V.I., Asryants R.A., Semenyuk P.I., Mishchenko N.P. et al. Natural quinones: antioxidant and antiaggregant action towards glyceraldehyde-3-phosphate dehydrogenase // Curr. Org. Chem. 2017. V. 21. P. 2125-2133. doi: 10.2174/1385272821666170126171927
- Al-Farga A., Mohammed B., Faisal M.A., Azhari S. et al. Solvent effects on antioxidant activities and phenolic contents of the alhydwan (Boerhavia elegana choisy) seed flour // J. Food Meas. Charact. 2018. V. 12. P. 2121-2127. doi: 10.1007/sll694-018-9827-z
- Sulaiman C.T., Shahida V., Balachandran I. Effect of extraction solvent on the phytoconstituents of Aegle marmelos (L.) Correa//J. Nat. Remedies. 2015. V. 15. P. 58-64. doi: 10.1831 l/jnr/2015/498
- Yang J., Ou X., Zhang X., Zhou Z. et al. Effect of different solvents on the measurement of phenolics and the antioxidant activity of mulberry (Morus atropurpurea Roxb.) With accelerated solvent extraction // J. Food Sci. 2017. V. 82. P. 605-612. doi: 10. ill 1/1750—3841.13638
- Aksay S. Total phenolic content and antioxidant properties of various extracts of myrtle (Myrtus communis L.) berries // Cukurova J. Agnc. Food Sci. 2016. V. 31. P. 43-50.
- Kankara S.S., Go R. Influence of extraction solvent on antioxidant properties of Guiera Senegalensis J.F. Gmel (Combretaceae) leaves //Nig. J. of Basic Appl. Sci. 2016. V. 24. P. 116-125. doi: 10.4314 /njbas.v24i2.16
- Bhebhe M., Fuller T.N., Chipurura B., Muchuweti M Effect of solvent type on total phenolic content and free radical scavenging activity ofblacktea and herbal infusion//Food Anal Method. 2016. V. 9. P."l060-1067. doi: 10.1007/sl2161-015-0270-z
- Setyopratomo P. Extraction of phenolic compounds from green tea using ethanol // J. Eng. and App. Sci. 2014. V. 9. P. 1516-152
- Noriham A., Dian-Nashiela F., Kherni B., Nooraain H. et al. Influences of maturity stages and extraction solvents on antioxidant activity of Cosmos Caudatus leaves // Int. J. Res. Stud. Biosci. 2015. V. 3. P. 1-10.
- Muhamad N., Muhmed S.A., Mashitah M.Y., Gimbun J. Influence of solvent polarity and conditions on extraction of antioxidant, flavonoids and phenolic content from Averrhoa bilimbi // J. Food Sci. and Eng. 2014. V. 4. P. 255-260. doi: 10.1007 / sl3197-012-0754-4
- Iloki-Assanga S.B., Lewis-Lujan L.M., Lara-Espinoza C.L., Gil-Salido A.A. et al. Solvent effects on phytochemical constituent profiles and antioxidant activities, using four different extraction formulations for analysis of Bucida buceras L. and Phoradendron californicum //BMC Res. Notes. 2015. V. 8. P. 1-14. doi: 10.1186/sl3104-015-1388-1.
- Dailey A., Vuong Q.V. Effect of extraction solvents on recovery of bioactive compounds and antioxidant properties from macadamia {Macadamia tetraplTylla) skin waste//J. Cogent Food Agr. 2015. V. 1. P. 1-10. doi: 10.1080/23311932.2015.1115646
- Do Q.D., Angkawijaya A.E., Tran-Nguyen P.L., Huynh L.H. et al. Effect of extraction solvent on total phenol content, total flavonoid content, and antioxidant activity of Limnophila aromatica // J. Food Drug Anal. 2014. V. 22. P. 296-302. doi: 10.1016/j.jfda.2013.11.001
- Uddin M., Talukder R.I., Sarkar M.K.I., Rahman T. et al. Effect of solvents on phytochemicals content and antioxidant activity of Ganoderma lucidum II Open Mcrobiol. J. 2019. V. 13. P. 10-15. doi: 10.2174/1874285801913010010
- Thouri A., Chahdoura H., Arem A.E., Hichri A.O. et al. Effect of solvents extraction on phytochemical components and biological activities of Tunisian date seeds (Var. Korkobbi and Arechti) // BMC Complement. Altern. Med. 2017. V. 17. P. 1-10. doi: 10.1186/sl2906—017—1751-y
- Afonina S.N., Lebedeva E.N. Chemical components of tea and their influence on the organism // Adv. Curr. Nat. Sci. 2016. V. 6. P. 59-63.
- Soliman N.F. Metals Contents in Black Tea and Evaluation of Potential Human Health Risks to Consumers // Health Econ. Outcome Res. 2016. V. 2. P. 1-4. doi: 10.4172/2471-268X/1000109
- Adawia K. Comparison of the total phenol, flavonoid contents and antioxidant activity of methanolic roots extracts of Asphodelus microcarpus and Asphodeline lutea growing in Syria // Int. J. Pharmacognosy and Phytochem. Res. 2017. V. 9. P. 159-164. doi: 10.25258/phyto.v9i2.8057
- John B., Satheesh G. Total phenolics and flavonoids in selected medicinal plants from Kerala // Int. J. Pharm. Pharm. Sei. 2014. V. 6. P. 406^108.
- Ditrych M., Kordialik-Bogacka E., Czyzowska A. Antiradical and reducing potential of commercial beers // Czech. J. Food Sei. 2015. V. 33. P. 261-266. doi: 10.17221/658/2014-CJFS
- Benzie I.F.F., Devaki M. The ferric reducing/antioxidant power (FRAP) assay for non-enzymatic antioxidant capacity: concepts, procedures, limitations and applications: recent trends and applications // Meas. Ant. Act. Cap. 2017. V. 1. P. 77-106. doi: 10.1002/9781119135388.ch5
- Dzialo M., Mierziak J., Korzun U., Preisner M. et al. The potential of plant phenolics in prevention and therapy of skin disorders // Int. J. Mol. Sei. 2016. V. 17. P. 1-41.
- Eruygur N., Dincel N.G.K, Kutuk N. Modeling of total phenolic contents in various tea samples by experimental design methods // Open Chem. 2018. V. 16. P. 738-744.
- Moldovan B., Hosu A., David L., Cimpoiu C. Total phenolics, total anthocyanins, antioxidant and pro-oxidant activity of some red fruits teas//Acta Chim. Slov. 2016 V. 63. P. 213-219. doi: 10.17344/acsi.2015.1421
- Kopjar M., Tadic M., Pilizota V. Phenol content and antioxidant activity of green, yellow and black tea leaves // Chem. Biol. Technol. Agnc. 2015 V. 2. P. 1-6. doi: 10.1186/s40538-014-0028-7
- Gonbada R.A., Afzan A, Karimi E., Sinniah U.R. et al. Phytoconstituents and antioxidant properties among commercial tea (Camellia sinensis L.) clones of Iran // Elect. J. Biotechnol. 2015 V. 18, P. 433-438. doi: 10.1016/j.ejbt.2015.08.007
- Karak P. Biological activities of flavonoids: an overview // Int. J. Pharm. Sci Res. 2019. V. 10. P. 1567-1574. doi: 10.13040/1JPSR.0975-8232.10(4). 1567-74
- Nosari A.B.F.L., Lima J.F., Serra O.A., Freitas L.A.P. Improved green coffe oil antioxidant activity for cosmetical purpose by spray drying microencapsulation // Braz. J. Pharm. Sci. 2015. V. 25. P. 307-311. doi: 10.1016/j.bjp.2015.04.006
- Rakshit A., Khatua K., Shanbhag V., Combac P. et al. Cu2+ selective chelators relieve copper-induced oxidative stress in vivo // Chem. Sci. 2018. V. 9. P. 7916-7930. doi: 10.1039/c8sc04041a


