Определение вида "упругой" составляющей уравнений состояния молекулярных кристаллов
Бесплатный доступ
Представлены результаты обоснования выбора формы потенциала межмолекулярного взаимодействий, адекватно описывающего структуру взаимодействий в молекулярном кристалле нитросоединения. Показано, что энергия электростатического взаимодействия может составлять до 25 % от теплоты сублимации молекулярных кристаллов нитросоединений. Данное заключение позволило определить форму потенциала невалентных взаимодействий для построения двучленного уравнения состояния молекулярных кристаллов. Были получены замыкающие соотношения, определяющие параметры потенциала невалентных взаимодействий и упругую составляющую уравнений состояния.
Уравнение состояния, молекулярный кристалл, энергия гельмгольца, потенциал леннард-джонса, потенциал букингема, приближение дебая, приближение эйнштейна
Короткий адрес: https://sciup.org/147158940
IDR: 147158940 | УДК: 532.593+536.715 | DOI: 10.14529/mmph170207
Текст научной статьи Определение вида "упругой" составляющей уравнений состояния молекулярных кристаллов
При построении математических моделей, описывающих быстропротекающие процессы в твердых взрывчатых веществах (ВВ), особую проблему представляют замыкающие соотношения уравнений математической физики - уравнения состояния. В настоящее время для определения параметров уравнений состояния при высоких давлениях и температурах широкое распространение получили двучленные уравнения состояния, в которых внутренняя энергия и давление представляются в виде суммы тепловой и холодной составляющих [1, 2]. Холодные составляющие внутренней энергии и давления не зависят от температуры и определяются только изменением расстояний между молекулами, в то время как тепловая составляющая описывает движение отдельных атомов и молекул в целом. Все твердые ВВ относятся к молекулярным кристаллам нитросоединений, молекулы которых имеют большое число степеней свободы. Межмолекулярное взаимодействие в молекулярных кристаллах органических соединений описывается силами Ван-дер-Ваальса. Построение уравнений состояния молекулярным кристаллов нитросоединений осложняется не только тем, что молекулы имеют большое число степеней свободы, но и тем, что в кристаллах могут образовываться водородные связи, которые уже не описываются только взаимодействием Ван-дер-Ваальса.
Анализ структур органических молекулярных кристаллов показал, что молекулы в органическом молекулярном кристалле образуют плотные упаковки, когда каждый атом молекулы стремится расположиться как можно ближе к атомам соседней молекулы [3]. Принцип плотной упаковки позволил А.И. Китайгородскому [3] сформулировать идею аддитивности энергии взаимодействия как для взаимодействия молекулы с молекулой, так и для взаимодействия атома с атомом в виде модели атом-атомных потенциалов: энергия взаимодействия молекул равна сумме энергий взаимодействий атомов, составляющих молекулы. Эти потенциалы универсальны и зависят только от сорта атома. Для схемы атом-атомных потенциалов могут быть приняты различные аналитические выражения типа (6-ехр-Букингэма) или (6-12-Леннард-Джонса), произвольные параметры которых должны определяться из экспериментальных значений теплоты сублимации простых органических молекулярных кристаллов. В соответствии с моделью атом-атомных потенциалов энергия решетки молекулярного кристалла представляется суммой электростатических и Ван-дер-Ваальсовых взаимодействий в виде
U = Eвв + EЭЛ
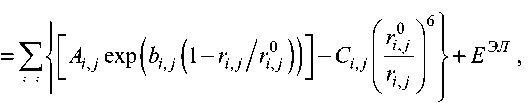
, j exp ( bi, j ( 1 - ri, j/r- j
Ci, j r ;
V i , j 7
+ E ЭЛ i, j
где A i j , b i j , rp j , C i j - параметры потенциала Букингема для атомов i и j ; r j - расстояние между атомов г и j ; U - энергия решетки молекулярного кристалла; Е - энергия невалентных Ван-дер-Ваальсовых взаимодействий; Eэл - электростатическая энергия. Энергия электростатического взаимодействия определяется наличием остаточных электрических зарядов на атомах, входящих в состав молекул.
Несмотря на широкое применение двучленных уравнений состояния, остается еще много вопросов, связанных как с формой, так и с содержанием тепловой и холодной составляющих уравнений состояния. Поэтому цели настоящего исследования можно сформулировать следующим образом:
-
1. Определение вклада энергии электростатических взаимодействий в энергию решетки молекулярного кристалла нитросоединения;
-
2. Выбор потенциала межмолекулярного взаимодействия, адекватно описывающего структуру взаимодействий в молекулярном кристалле нитросоединения;
-
3. Обоснование выбора формы потенциала межмолекулярного взаимодействия, замыкающейся на известные экспериментальные данные.
Оценка вклада электростатических взаимодействий в энергию решетки молекулярного кристалла
Модель атом-атомных потенциалов успешно применялась А.И. Китайгородским с сотрудниками для исследования свойств органических молекулярных кристаллов. Было показано, что энергия электростатических взаимодействий пренебрежимо мала по сравнению с теплотой сублимации (энергией решетки) для таких веществ, как углеводороды даже в случае молекул с большими дипольными моментами и ее можно не включать в схему атом - атомных потенциалов при проведении расчетов энергии решетки [3].
Последнее утверждение не является очевидным особенно для молекулярных кристаллов нитросоединений. Во-первых, заряды на атомах молекул нитросоединений на порядок больше зарядов на атомах обычных органических соединений, во-вторых, кристаллы нитросоединений содержат сильные водородные связи. Поэтому вопрос выбора модели атом-атомных потенциалов может быть решен только с помощью прямых расчетов энергии решетки молекулярных кристаллов нитросоединений, включающей в себя энергию Ван-дер-Ваальса и энергию электростатических взаимодействий.
Аналогично работе [4] проведем оценку вклада энергии электростатических взаимодействий в энергию решетки ряда молекулярных кристаллов нитросоединений. В качестве объектов исследования были выбраны молекулярные кристаллы нитробензола, р-динитробензола, т-динитробензола, р-нитротолуола, гексогена, р-нитроанилина, 2,4,6-тринитроанилина, 1,3,5-триамино-2,4,6-тринитробензола. Данный набор молекулярных кристаллов нитросоединений был выбран не случайно: в литературе для них имеются экспериментальные данные по теплоте сублимации и данные ренгеноструктурного анализа [4]. Для увеличения достоверности вычисления энергии электростатического взаимодействия заряды на атомах молекул нитросоединений рассчитывались в конформациях (геометрии), выбранных на основе данных ренгеноструктурного анализа, то есть соответствующих конформации молекул в кристалле. Эффективные заряды на атомах, воспроизводящие электростатический потенциал в окрестности молекулы и входящие в состав молекул перечисленных выше нитросоединений, вычислены в приближении Хартри-Фока более современными квантово-химическими методами [5], нежели это было сделано ранее в работе [4]. При вычислении энергии электростатических взаимодействий были использованы разные модификации метода Эвальда [6, 7].
Потенциалы невалентных взаимодействий Ев - в , определяющие взаимодействие Ван-дер-Ваальса, описывались универсальной кривой для каждого сорта атомов i и к в форме потенциала (6-ехр-Букингэма) [3, 4, 8].
Результаты расчетов энергии решетки молекулярных кристаллов нитросоединений и энергии электростатических взаимодействий приведены в таблице. Анализ приведенных результатов расчетов показывает, что вклад энергии электростатических взаимодействий в энергию решетки (те- плоту сублимации) молекулярных кристаллов нитросоединений является значительным, в отличие от чисто органических молекулярных кристаллов, и может достигать 20-25 % энергии решетки. Поэтому при расчетах термодинамических характеристик молекулярных кристаллов нитросоединений, необходимых для построения уравнений состояния, должна быть использована полная схема атом-атомных потенциалов [3], то есть обязательно должна включаться в расчет энергия электростатических взаимодействий.
Сравнение экспериментальных и вычисленных энергий решетки
|
Соединение |
ТТЭКСЛ 11 субл ( Т = 298 К) |
ттЭКСЛ 11 субл ( T = 0 К) |
и выч 11 субл ( Т = 0 К) |
E эл |
|
Ккал /моль |
||||
|
Нитробензол |
13,98 |
15,14 |
15,30 |
2,7 |
|
т-динитробензол |
19,40 |
20,57 |
20,60 |
6,5 |
|
р-динитробензол |
21,20 |
22,37 |
22,50 |
5,9 |
|
р-нитротолуол |
18,90 |
20,07 |
20,30 |
4,5 |
|
Гексоген |
31,11 |
32,34 |
31,29 |
7,6 |
|
р - нитроанилин |
24,10 |
25,20 |
25,30 |
6,9 |
|
Тринитроанилин |
27,71 |
28,80 |
28,20 |
7,5 |
|
1,3,5- триамино- 2,4,6-тринитробензол |
40,21 |
41,30 |
40,20 |
8,4 |
Определение формы упругой составляющей уравнений состояния молекулярных кристаллов
Вычисление упругих (невалентных межмолекулярных) составляющих внутренней энергии с учетом строения кристаллической решетки, проведенное в ряде работ [3, 4], показывает, что подобная детализация расчетов приводит к огромным затратам машинного времени, а аппроксимация энергии невалентных межмолекулярных взаимодействий Uy набором потенциалов в модели А.И. Китайгородского приводит к появлению большого количества констант, которые не всегда удается адекватно определить из имеющихся экспериментальных данных.
Следовательно, целесообразно подобрать некоторый эффективный потенциал упругого взаимодействия, который бы учитывал и особенности, полученные в результате детальных расчетов энергии упругих взаимодействий молекулярных кристаллов нитросоединений, и мог быть использован при решении задач математической физики.
Учитывая все выше сказанное, для энергии упругих взаимодействий Uy , в соответствии представлениями работы [5], должно быть принято следующее выражение:
Uy (x) = ^A- exp Гb (1 - x13)! - C-x“2 - —x4/3, (1) bpo L V 7J 2po Po где x = p0 /p - безразмерный объем; A, b, C , D - постоянные подлежащие определению. Второй и третий члены выражения (1) описывают энергию притяжения. Сравнивая вычисленную энергию решетки кристалла с его теплотой сублимации, видим их различие как раз в энергии притяжения. Это может объясняться недостаточным учетом энергии водородных связей, существующих в молекулярных кристаллах нитросоединений. Поэтому целесообразно модифицировать потенциал упругих взаимодействий (1). В силу того, что выражения, описывающие энергию притяжения в потенциале упругих взаимодействий (1), имеют минимум для x = 1, имеет смысл заменить сумму второго и третьего членов в выражении (1) одной функцией следующим образом:
Uy = — exp Г b (1 - x 1/3 Я — —x~n . (2) y b p o PL ( ) J n p o v
Потенциалы упругих взаимодействий (1) и (2) различаются тем, что показатель степени в выражении, описывающем энергию притяжения, не является фиксированным и подлежит определению из экспериментальных данных [9, 10]. Для определения констант, входящих в выражение (2), необходимо из эксперимента выбрать четыре параметра и замкнуть на них уравнения состояния при температуре T = 0.
Найдем связь между упругими составляющими внутренней энергии и давления. Известно, что термодинамические свойства вещества полностью определяются, если известен один из термодинамических потенциалов. Для молекулярных кристаллов удобно исходить из определения свободной энергии Гельмгольца F(V, T), которая наиболее простым образом связана с моделью строения вещества:
F = Uy + E о + kT l in 1 1 — exp ( — h ^a- I] , E о = 1 l H toa . (3)
a I V kT )) 2 а
Здесь Uy - энергия взаимодействия между атомами; V - удельный объем; T - температура тела; к - постоянная Планка; гоа - частоты нормальных колебаний; E 0 - энергия нулевых колебаний. Если предположить, следуя работам [11, 12], возможность использования для низкочастотной составляющей свободной энергии подхода Дебая, а для высокочастотной - подхода Эйнштейна, то выражение (3) перепишется в виде
I MT
F = Uy + E o + 3 MRT — ^ 2 in ( 1 - exp ( - £ ) ) d ^ + ( 3 N - M ) RT in 1 - exp I — E I , (4)
0 V 9 d J о V V T ))
где R - универсальная газовая постоянная; M - число низкочастотных колебаний; N - число атомов в молекуле; 3N - M - число высокочастотных колебаний; 0D - характеристическая тем пература Дебая; 0E - характеристическая температура Эйнштейна. Зная выражение для энергии
Гельмгольца, легко определить вид уравнения состояния молекулярного кристалла и теплоемкости при постоянном объеме:
dUy dEо mrtYd (V)D ( Xd ) у, „X d (h »D).,„
-
P.... " dT + V ■ Yd (V )=-■d(inV)’ -
- E = F + TS = Uy + E0 + MRTD (xD) + (3 N - M)---—E ;(6)
exp ( X e )- 1
Cv = MR f 4D (Xd )--3xD—1 + (3N - M) Rx ^p''),(7)
V exp ( X d ) - 1 1 ( exp ( xE ) - 1 )2
где xD = 0 DIT , xE = 0 EIT , y d (V ) - коэффициент Грюнайзена. В работах [11, 12] подробно описан алгоритм определения числа низкочастотных колебаний молекулярных кристаллов нитросоединений. Следуя определению коэффициента Грюнайзена [13], получим выражения для энергии нулевых колебаний E 0 и ее производной -^0-:
E 0 = ^L Н ю а =
2 а
3 N '- M'
-------к ю а
+ 3 M D ^ „^ = 3 N-M R ^ + 3 MR ^ ( V )
2 0 2 E 8 D
dE 0_ 3 MR Y d ( V )9p ( V )
^^^^^^^^^^^^^^^^^^^^^^^^^B ^^^^^^^B ^^^^^^^B ^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^^B dV 8 V
где N' - число атомов, M' - число низкочастотных колебаний в объеме V . Подставляя выражение для производной от энергии нулевых колебаний по объему (9) в выражение для давления, получаем уравнение состояния в виде р = MTyD(V)d(xd) + р0 + py , р0 = 3 MRyD (v)@п^; py =-dU . (W)
V 8 dV
В соответствии с соотношением (2) получим выражение упругого давления Py , обусловленного энергией упругих взаимодействий Uy ( x ), в следующем виде
—2
(
Py _ Ax 3 exp b 1 — x L I
1M
— Cx — ( n + 1).
Для получения более понятных с точки зрения физики выражений упругих составляющих внутренней энергии (2) и давления (11) сделаем ряд преобразований. По определению, изотермическая сжимаемость P T связана с изотермической скоростью звука cT следующим образом:
1 _cT_ Л д P ) — V
.
P T V (д V J T
Подставляя выражение (10) в правую часть равенства (12), в результате получим
Pt
— I
V ^1 MRT Y D ( V )[ 3 x D + D
_— V J — MRT Y D ( V ) у Xd + D
+ MRT Y D ( V ) - Xd + 8
V + P y I
) T
V 2 + MRT Y D '( V ) 3 xd + D
D X xD )1 ^ xD/v + — 1 ( D ) ] д v/ d v J.
T
_— v J— MRT Y D ( V ) - Xd + D
V +
V 2 +
, в в 3
+ MRT Y D ( V ) s Xd + D 8
( Xd )1 / V — MRT Y D ( V ) Г 3 -I L 8
xD
— CVD (xD ) + D
_ MRT [ Y > ( V ) + Y d ( V ) ]
— x + D 8 D
V — V ^Pr- — MRT y D ( V ) Cvd ( Xd )/ V — д V D
—
■ mrt / d ( v ) - Xd + D ( xd ) ,
где y D (V ) - производная по V от коэффициента Грюнайзена,
C VD ( x D )_ I 4 D ( x D )
^^^^^^^в
3y A
3 xD
д x D _
exp ( xD ) — 1 J ’ д V
— V Y d ( V ) .
Следовательно, выражение для определения изотермической сжимаемости можно записать следующим образом
-
1 - _ MRT [ y d ( V ) + Y d ( V ) ] P t
-
- xn + D 8 D
^^^^^^^в
-
— MRTyD (V) Cvd (Xd )/
, в вГЗ в в1
-
V — MRT / D ( V ) 8 xd + D ( xd ) — V-V ,
Проведем оценку членов, входящих в выражение для внутренней энергии (6), при стремлении температуры T к нулю. В этом случае речь идет о низкотемпературном пределе T ^ 0, xD ^^ , xE ^7 . Низкотемпературный предел для функции Дебая D (xD) можно получить, если представить интеграл, входящий в ее выражение, в виде xD e d^ _7e d^
0 exp ( e ) — 1 0 exp ( e ) — 1
^^^^^^^в
7 e d e _ П 4
x D exp ( e ) — 1 15
^^^^^^^в
7 e de xD exp(e)—1.
При низких температурах T параметр xD велик, так что второй член в последнем равенстве можно оценить, отбросив 1 в знаменателе подинтегрального выражения 7 , с,7
j e ---_ f [ e 3 exp ( — e ) l d e _ exp ( — Xd ) ( x D + 3 x D + 6 Xd + б ) .
J exp(e)—1 JL ] v xDx
Подставляя последнее выражение в функцию Дебая, получим п4 / \
D ( X D ) = -3 x
— - exp ( - xD ) ( x D + 3 x D + 6 x D + 6 )
n 0.
Проведя предельный переход в последнем члене внутренней энергии, получим
®Е exP (xE )-1
________n eE xe >■ exp ( Xe )
Для внутренней энергии E предельный переход к низким температурам можно представить следующим образом
3 N - M}RTxF
E = U + E0 + MRTD (xD) + 3-----E = exp ( xe )-1
= U + Eo + MRT— xD L15
- exp ( - x D ) ( x D + 3 x D + 6 x D + 6
+
( 3 N - M ) R e
+------;—;--n U (1) + E o .
exp ( xE ) x e >■
Энергия нулевых колебаний E 0 определена выражением (8). Для определения изотермической сжимаемости при T n 0, переходим в выражении (13) к пределу следующих функций:
Tini MRpT[yd (V) + yd (V)]3xD = 3 eDMRp[yd (V) + yd (V)], lim MRpT[yd (V) + yd (V)]D(xD ) = 0, lim MRpTyd (V) Cvd (xD ) = 0, lim MRT yd '(V)3 xD = 3 MReDYD'(V),
T n0 88
lim MRT y d ‘ ( V ) D ( x D ) = 0.
Следовательно, при T n 0 изотермическая сжимаемость определяется следующим выражением
I1
v P t ) t n0
= 3eDMRpFyD (V) + yd (V)1 -3MReDYD'(V)-VP(15)
8 L J 8d
Переходя в (15) от изотермической сжимаемости к изотермической скорости звука в соответствии с формулой (12), получим
-
V=3 eDMRp [yd (v)+YD (V)] - 3 MReDYD'( v )-v |V,(16)
где c 0 - скорость звука при T = 0 .
Полагая далее, что скорость звука при T = 0 определяется только упругими свойствами кристаллов, получим два уравнения:
4 =
V 0
^^^^^^^e
у P
0 dV ,
Y D ' ( V 0 )- Y D ( V 0 )- V Y D ( V 0 ) = 0.
-
V 0 V 0
Подставляя в правую часть равенства (17) выражение для холодного давления (11), получим при x = 1
-
- у ^ P L = -3 5 1 = - 2 Ax -5/3exp Г b (1 - x 1/3 Я - 3 Abx ~4/3exp F b (1 - x 1/3 Я +
0 d v d x 3 p L ( ) j 3 p L ( ) j
+ C ( n + 1 ) x ( n + 2 ) =- 2 A - 1 Ab + C ( n + 1 ) .
В силу того, что для x = 1 упругая составляющая внутренней энергии имеет минимум, то величина упругой составляющей давления равна нулю при x = 1, и, как следует из выражения (11), коэффициенты A и C равны. Из равенств (17) и (18) можно определить выражение для коэффициента A через скорость звука c 0 для x = 1 и T = 0 :
A = 3 c 2 Р о / ( b - 3 n - 1 )
В этом случае выражения для упругой составляющей внутренней энергии и упругой составляющей давления принимают следующий вид:
3 c 2
U y = к /к 1 й 3 n exp ( b ( 1 - x ) ) - bx (19)
bn ( b - 3 n - 1 ) L ' ' '' J
P y =
3 c 0 p 0
bn ( b - 3 n - 1 )
-2/3
exp ( b ( 1 - x 1/3 ) )
x - n + 1 )
Выводы
-
1. При проведении расчетов по определению энергии решетки молекулярных кристаллов нитросоединений необходимо применять полную схему атом-атомных потенциалов.
-
2. В работе получены выражения для упругой составляющей внутренней энергии (19) и упругой составляющей давления (20), которые наиболее простым образом определяются из известных экспериментальных данных.
-
3. Коэффициенты n и b в выражениях (19) и (20) определяются по экспериментальным ударным адиабатам молекулярных кристаллов.
Список литературы Определение вида "упругой" составляющей уравнений состояния молекулярных кристаллов
- Станюкович, К.П. Неустановившиеся движения сплошной среды/К.П. Станюкович. -М.: Наука, 1971. -756 с.
- Жарков, В.Н. Уравнения состояния при высоких температурах и давлениях/В.Н. Жарков, В.А. Калинин. -М.: Наука, 1968. -311 с.
- Китайгородский, А.И. Молекулярные кристаллы/А.И. Китайгородский. -М.: Наука, 1971. -424 с.
- Ковалев Ю.М. Энергия решетки кристаллов нитросоединений/Ю.М. Ковалев, В.А. Шляпочников//Известия Академии наук. Серия химическая. -1979. -№ 11. -С. 2601-2602.
- Кларк, Т. Компьютерная химия/Т. Кларк. -М.: Мир, 1990. -384 с.
- Хариссон, У. Псевдопотенциалы в теории металлов/У. Хариссон. -М.: Мир, 1968. -368 с.
- Рейсленд, Дж. Физика фононов/Дж. Рейсленд. -М.: Мир, 1975. -368 с.
- Mayo, S.L. Dreiding: A general force field for molecular simulation/S.L. Mayo, B.D. Olafson, W.A. Goddard//J. Phys. Chem. -1990. -Vol. 94, no. 26. -P. 8897-8909.
- Dobrats, B.M. LLNL Explosives Handbook. Properties of Chemical Explosives and Explosive Simulants/B.M. Dobrats, P.C. Crawford. -Livermore, California: University of California, 1985.
- Gibbs, T.R. Last explosive property data. Los Alamos series on dynamic material properties/T.R. Gibbs, A. Popolato. -Berkeley, Los Angeles, London: University of California Press, 1980.
- Ковалев, Ю.М. Математическое моделирование тепловой составляющей уравнения состояния молекулярных кристаллов/Ю.М. Ковалев//Вестник Южно-Уральского государственного университета. Серия: Математическое моделирование и программирование. -2013. -Т. 6, № 1. -С. 34-42.
- Ковалев, Ю.М. Определение тепловой составляющей уравнения состояния молекулярных кристаллов/Ю.М. Ковалев, А.В. Белик//Челябинский физико-математический журнал. -2013. -№ 9 (300). -С. 5-10.
- Жирифалько, Л. Статистическая физика твердого тела/Л. Жирифалько. -М.: Мир, 1975. -382 с.


