Определение времени максимального риска летального исхода и ассоциированных с ним факторов в стационаре и после выписки у больных с COVID-19
Автор: Лакман И. А., Ласынова Г. Х., Гиматова Р. Р., Гареева Д. Ф., Давтян П. А., Тимирьянова В. М., Идрисова А. И., Загидуллин Н. Ш.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.37, 2022 года.
Бесплатный доступ
В связи с достаточно специфическим течением COVID-19 актуальным представляется вопрос, на какой день после начала госпитализации следует ожидать максимальный риск летального исхода у больных как во время госпитализации, так и после выписки.Цель исследования: определение времени максимального риска летального исхода во время госпитализации пациентов с COVID-19, а также после выписки из стационара.Материал и методы. Ретроспективно были исследованы 2410 пациентов, госпитализированных с диагнозом COVID-19. Летальность до 28 дней нахождения в стационаре составила 131 пациент, а смертность после выписки из стационара в период до 28 дней после выписки - 9. Для определения времени максимального риска летального исхода после госпитализации пациентов с COVID-19, а также после выписки из стационара в период до 28 дней использовали математическую модель ускоренной жизни (AFT).Результаты. Без учета влияния патологических значений других факторов риска летальный исход у пациентов наступает на 9-11-й день от начала госпитализации. Возраст старше 60 лет, повышенные значения Д-димера, глюкозы, мочевины, креатинина, АСТ и С-реактивного белка являлись факторами риска (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Covid-19, постковидный период, максимальный риск смерти, госпитальная смертность, отдаленная смертность
Короткий адрес: https://sciup.org/149141452
IDR: 149141452 | УДК: 616.98:578.834.1-036.21]-036.869/88 | DOI: 10.29001/2073-8552-2022-37-4-38-45
Текст научной статьи Определение времени максимального риска летального исхода и ассоциированных с ним факторов в стационаре и после выписки у больных с COVID-19
Вирусная пандемия COVID-19 вызвала значительную перегрузку системы здравоохранения и привела к нарушению качества жизни, поражению легких, росту госпитализации и смертельному исходу у 1–3% пациентов [1]. Широкое распространение среди населения и высокий риск развития осложнений для новой коронавирусной инфекции сформировали интерес ученых в области разра- ботки моделей оценки риска ее неблагоприятного исхода. Существует достаточно большое число исследований, в которых сделана попытка предсказать неблагоприятный исход для пациентов, госпитализированных вследствие COVID-19 [2]. Во многом целью таких работ является выявление предикторов риска неблагоприятного исхода с последующей его стратификацией [3]. В подавляющем количестве исследований в качестве конечной точки рассматривается госпитальная смертность [4, 5]. Существуют также исследования, в которых в качестве конечного неблагоприятного события при госпитализации рассматривается перевод пациентов на неинвазивную или инвазивную вентиляцию легких [6, 7]. Есть ряд исследований, в которых строится модель предсказания летального исхода для больных, находящихся только в отделении интенсивной терапии [8]. Более того, по данным Y. Xie и соавт. [9], COVID-19 может приводить к увеличению риска летального исхода и после выписки из стационара в течение последующего года наблюдения, поэтому было бы важно проанализировать максимальные временные риски смертельного исхода и после выписки из стационара.
Во многих исследованиях при COVID-19 определяются факторы риска летального исхода, такие как возраст, пол, уровень креатинина, поражения легких, сатурация кислорода, изменения на электрокардиограмме, биомаркеры в крови и другие [10, 11]. При этом используются различные инструменты статистического моделирования: логистические регрессии [5], модели пропорциональных рисков Кокса [12] или современные инструменты, основанные на применение методов глубокого обучения (deep learning) и моделей выживаемости [13].
Несмотря на то, что получено множество моделей по стратификации рисков смерти для данных пациентов, актуальным является вопрос, на какой день после начала госпитализации следует ожидать для конкретного пациента максимальный риск летального исхода. Это актуально и в отношении планирования сроков госпитализации, даты выписки и времени нахождения в интенсивной терапии. Имеются данные о том, что максимальный риск смертельного исхода приходится на 10–20-й дни госпи- тализации, а не на первые, как, например, при инфаркте миокарда или инсультах [14]. Данный анализ возможно осуществить с помощью так называемой модели ускоренной жизни (AFT). Модель уже применялась в исследованиях, связанных с COVID-19, в основном для прогнозирования длительности госпитализации [15, 16].
Цель исследования: определение времени максимального риска летального исхода во время госпитализации пациентов с COVID-19, а также после выписки из стационара до 28 дней наблюдения в зависимости от наличия у него соответствующих факторов риска.
Материал и методы
Дизайн исследования ретроспективный неконтролируемый, сплошной, открытый (рис. 1). В нем ретроспективно были исследованы 2410 последовательных пациентов, которые были госпитализированы с диагнозом COVID-19 в COVID-госпиталь БГМУ (г. Уфа) в период с 1 мая по 31 декабря 2020 г. В исследование были включены пациенты от 18 лет и старше с подтвержденным заболеванием COVID-19 и наличием пневмонии. Критериями невключения были: хроническая болезнь почек (ХБП) IV-V стадии, актуальные (в течение последних трех лет) злокачественные новообразования, острый коронарный синдром, инсульт в остром периоде, выраженные иммунодефицитные состояния, а также хроническая сердечная недостаточность III–IV стадии по NYHA. Диагностика и лечение пациентов осуществлялись согласно рекомендациям Министерства здравоохранения Российской Федерации на тот момент времени (№ 8 от 03.09.2020 г.).
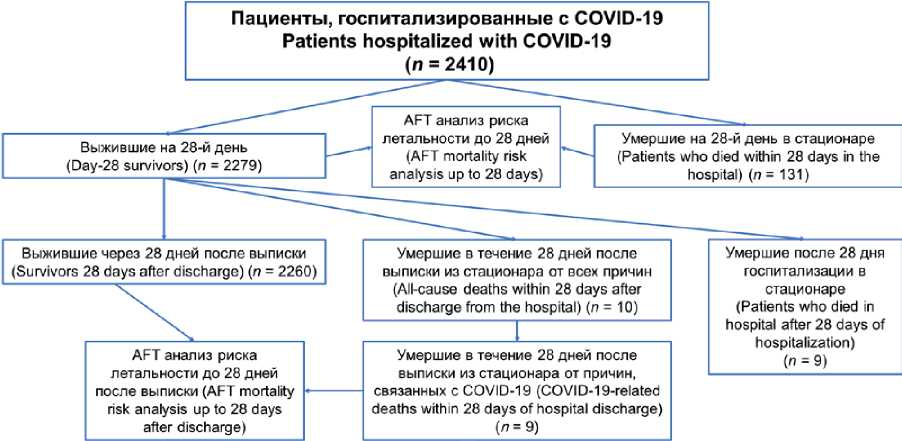
Рис. 1. Дизайн исследования
Fig. 1. Study design
Данные о пациентах собирались с помощью цифровой медицинской информационной системы «Промед», в которой на всей территории региона ведется запись, регистрация и хранение электронных данных пациентов (анамнез, лабораторные анализы, выписки, справки о смерти). Кроме того, в данной системе осуществляется регистрация обращений, госпитализаций, медицинских событий и в отдаленном периоде после госпитализации.
Для определения времени максимального риска летального исхода после госпитализации пациентов с COVID-19, а также после выписки из стационара невозможно использовать стандартные модели выживаемости, предполагающие пропорциональность рисков. Для решения подобных задач применима временная модель ускоренного отказа – модель ускоренной жизни (AFT – The Accelerated Failure Time Model) [17]:
log(Т) = χβ + σε, где Т – вектор времени выживания, учитывающий матрицу данных χ, β, – коэффициенты, подлежащие оценке методом максимального правдоподобия, σ – параметр масштаба остаточной компоненты ε, причем ε ~ F, где F – векторная стандартная функция распределения.
Для того чтобы получить достоверные результаты моделирования, необходимо подобрать закон распределения и провести процедуру параметризации таким образом, чтобы оценки коэффициентов модели при факторах риска получились бы надежными, а сама модель была пригодной к прогнозированию. Далее для модели AFT методом максимального правдоподобия рассматривали четыре варианта подбора закона распределения времени до наступления летального исхода ( Т ): логнормальное, экспоненциальное, Вейбулла, лог-логистическое, с последующим отбором наиболее подходящего из них на основе информационных критериев. В качестве информационных критериев рассматривались критерии Акайке и Шварца, в основе расчета которых использовалось значение логарифмической функции правдоподобия исследуемых моделей. Выбирали модель, значения информационных критериев для которой были бы минимальными. Все расчеты проводились с использованием статистического пакета R.
Для модели определения времени максимального риска летального исхода во время госпитализации анализировался период не более 28 дней от начала госпитализации, при этом конечной точкой исследования являлась смерть пациента, а если пациент выписывался/ умирал ранее 28 дней, то данный случай считался цензурированным нулем. Всего был 131 летальный случай в пределах 28 дней госпитализации (5,4%). Для определения времени максимального риска летального исхода после выписки из стационара в течение 28 дней рассматривали данные 2260 пациентов и наблюдали смертельный исход у 9 пациентов (0,4%). После выписки из стационара пациентов, выживших в период до 28 дней после выписки, также считали цензурированным нулем, и под процедуру цензурирования попал один случай смерти, не связанный с COVID-19 (травма). В обоих моделях в качестве факторов риска (количество переменных k = 31) рассматривали клинико-демографические, а также лабораторные данные, полученные при поступлении пациента в стационар. В исследовании под факторами риска понимали «факторы ускорения» (acceleration factors), которые определяют эффект сопутствующих переменных (ковариат) на время максимального «риска смерти». Также следует отметить, что причина смерти в стационаре определялась по результатам вскрытия, и во всех случаях COVID-19 был основной причиной смерти (медицинская помощь осуществлялась в COVID-госпитале). После выписки причиной большей части смертей была кардиоваскулярная патология (во многих случаях вскрытие не осуществлялось).
При построении моделей AFT придерживались определенной схемы исследования. На первом этапе все непрерывные факторы риска бинаризировались по принципу «0», если в пределах, и «1», если показатель выше/ ниже контрольных значений. На втором этапе строили четыре варианта унивариантных моделей для оценки значимости влияния каждого фактора на исход. При этом для дальнейшего анализа отбирались те факторы риска, у которых коэффициент в модели статистически значимо отличался от нуля при р < 0,05. На третьем этапе строились мультифакторные AFT-модели только со статистически значимыми факторами риска, отобранными на втором этапе. В данных моделях также выполнялся подбор функции распределения для периода смертельного исхода. На четвертом этапе, исходя из минимума значений информационных критериев Акайке и Шварца, выбиралась модель с наиболее походящим законом распределения, проводилась интерпретация результатов моделирования.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации и одобрено этическим комитетом Башкирского государственного медицинского университета (№ 11, 2020 г.).
Результаты и обсуждение
В таблице 1 представлены клинико-демографические параметры пациентов. Анализы пациентов представлены на момент госпитализации.
Таблица 1 . Клинико-демографические параметры пациентов
Table 1. Clinical and demographic parameters of patients
|
Параметры Parameters |
Медиана ( Q 1; Q 3) или % Median ( Q 1; Q 3) or % |
|
N |
2410 |
|
Пол, м/ж Gender, m/f |
1044 (43,3)/1366 (56,7) |
|
Возраст, лет Age, years |
59 (48; 67) |
|
Клинические исследования: Clinical studies: SpO2, % Повреждение ткани легких по данным КТ, % Lung tissue damage according to CT data, % |
97 (95; 98) 40 (28; 52) |
|
Сопутствующие заболевания: Concomitant diseases: АГ, n (%) HTN, n (%) СД, n (%) DM, n (%)) ХСН, n (%) CHF, n (%) ИБС, n (%) CHD, n (%) ХБП, n (%) CKD, n (%) ХОБЛ + БА, n (%) COPD + BA, n (%) Инсульт в анамнезе, n (%) History of stroke, n (%) |
958 (39,8) 311 (12,9) 229 (9,5) 254 (10,5) 95 (3,9) 87 (3,6) 46 (1,9) |
|
Лабораторные обследования: Laboratory examinations: Гб, г/л HGB, g/L Лейкоциты, *109 WBC, *109 Тромбоциты, *109 Platelets, *109 Эритроциты, *1012 RBC, *1012 Нейтрофилы, *109 Neutrophils, *109 Лимфоциты, *109 Lymphocytes, *109 Моноциты, *109 Monocytes, *109 Эозинофилы, *109 Eosinophils, *109 СОЭ, мм/сек ESR, mm/sec |
133 (123: 142) 5,83 (4,34; 8,29) 192 (152; 253) 4,58 (4,26: 4,94) 3,9 (2,6; 6,5) 1,11 (0,82; 1,59) 0,35 (0,19: 0,57) 0,013 (0,005; 0,033) 31 (20; 43) |
Окончание табл. 1
End of table 1
|
Параметры Parameters |
Медиана ( Q 1; Q 3) или % Median ( Q 1; Q 3) or % |
|
СРБ, ммоль/л СRР, mmol/L Общий белок, г/л Protein, g/L Глюкоза, ммоль/л Glucose, mmol/L КФК, Ед/л CPK, Units/L Мочевина, ммоль/л Urea, mmol/L Креатинин, нг/мл Creatinine, ng/mL Д-димеры, нг/мл D-dimers, ng/mL МНО INR Тромбопластин, с Thromboplastin, sec Натрий, ммоль/л Sodium, mmol/L Калий, ммоль/л Potassium, mmol/L Общий билирубин, мкмоль/л Total bilirubin, mmol/L Железо сыворотки, мкмоль/л Serum iron, mmol/L АСТ, Ед/л AST, Units/L АЛТ, Ед/л ALT, Units/L Ферритин, мкг/л Ferritin, mcg/L |
27,4 (6; 60,4) 41,9 (38,8; 45,4) 5,76 (4,69; 7,55) 111,5 (63; 225) 5,5 (4,4: 7,11) 90,7 (81, 103) 231 (0; 430) 1,02 (0,96; 1,11) 13,8 (13,1; 14,9) 143 (141; 144) 4,2 (3,9: 4,5) 8 (6,1; 11,5) 8,3 (4,8; 13, 8) 28,8 (21,6; 41,3) 28,8 (19,6; 45,1) 379 (191; 500) |
|
Конечные точки: Endpoints: Госпитальная смертность, n (%) Hospital mortality, n (%) Постгоспитальная 28-дневная смертность, n (%) Post-hospital 28-day mortality, n (%) |
131 (5,4) 9 (0,4) |
Примечание: КТ – компьютерная томография, АГ – артериальная гипертония, СД – сахарный диабет, ХСН – хроническая сердечная недостаточность, ИБС – ишемическая болезнь сердца, ХБП – хроническая болезнь почек, ХОБЛ + БА – хроническая обструктивная болезнь почек + бронхиальная астма, Гб – гемоглобин, СОЭ – скорость оседания эритроцитов, СРБ – С-реактивный белок, КФК – креатинфосфокиназа, МНО – международное нормализованное отношение, АСТ – аспартатаминотрансфераза, АЛТ – аланинаминотрансфераза. Note: CT – computed tomography, HTN – hypertension, DM – diabetes mellitus, CHF – chronic heart failure, CHD – coronary heart disease, CKD – chronic kidney disease, COPD + BA – chronic obstructive pulmonary disease + bronchial asthma, HGB – hemoglobin, WBC – white blood cell count, RBC – red blood cells, ESR – erythrocyte sedimentation rate, CRP – C-reactive protein, CPK – creatine phosphokinase, INR – international normalized ratio, AST – aspartate aminotransferase, ALT – alanine aminotransferase.
Параметризация унивариантных моделей при подборе различных функций распределения для времени выживания Т позволила получить следующие результаты: коэффициенты при факторах риска при оценке моделей с учетом различных вариантов законов распределения практически не отличались; статистически значимое изолированное влияние при уровне значимости p < 0,001 оказывали факторы риска: возраст > 60 лет, Д-димер > 250 нг/мл, МНО 0,82–1,18, активированное частичное тромбопластиновое время 11–16 с, лейкоциты < 4-9 х 109 Ед/л, гемоглобин < 120 г/л, тромбоциты < 150 х 109 Ед/л, лимфоциты < 1,2 х 109 Ед/л, нейтрофилы < 2 или > 5,5 х 109 Ед/л, K + < 3,4 ммоль/л, Na+< 135 ммоль/л, общий белок > 64 г/л, глюкоза > 6,3 ммоль/л, мочевина > 7,3 ммоль/л, креатинин > 115 мкмоль/л для женщин и 120 мкмоль/л для мужчин, АСТ > 35 Ед/л, КФК > 175 Ед/л, СРБ > 10 мг/л, а при уровне значимости p < 0,05 – женский пол, эритроциты < 3,8 х 1012 Ед/л, СОЭ > 20 мм/ч, общий билирубин > 17,1 мкмоль/л, железо сыворотки < 11 мкмоль/л, ферритин < 10 мкг/л или > 250 мкг/л.
Далее были построены AFT-модели с подбором варианта распределения со статистически значимыми факторами риска, отобранными на предыдущем этапе. Факторы риска, которые в мультифакторных моделях были незначимы при p > 0,05, были удалены. В таблице 2 представлены значения информационных критериев Акайке и Шварца, а также значения функции правдоподобия для мультифакторных моделей с подбором функции распределения с соответствующим ей р -уровнем.
Так как наименьшее значение информационных критериев наблюдалось для модели AFT с распределением Вейбулла, то она и была принята за базовую модель. Результаты оценки сведены в таблицу 3, где указаны значения коэффициента (дней максимального риска) при факторах риска со стандартной ошибкой ( SE ), значением Z -статистики и p -уровнем.
Без учета влияния патологических значений факторов риск смерти у пациентов наступает на 9–11-й день от начала госпитализации («свободный член», см. табл. 3). Каждый из перечисленных в таблице 3 факторов риска укорачивает время до летального исхода в среднем на день, кроме общего белка, который, наоборот, удлиняет. Например, если пациент старше 60 лет, у него белок в сыворотке крови > 64 г/л, глюкоза > 6,3 ммоль/л, СРБ > 10 мг/л, то для него максимальный риск смерти будет на 8–11-й день от начала госпитализации.
Таблица 2 . Сравнение метрик качества многофакторных моделей AFT
Table 2. Comparison of quality metrics of multivariate AFT models
|
Модель AFT, Распределение AFT Model, Distribution |
Информационные критерии Information criteria |
Значение функции правдоподобия (L) The value of the likelihood function |
р -уровень (L) p -level (L) |
|
|
Акайке AIC |
Шварца BIC |
|||
|
Лог-логистическое Log-logistic |
1589,9 |
1676,6 |
–779,9 |
<0,001 |
|
Вейбулла Weibull |
1586,4 |
1665,8 |
–786,2 |
<0,001 |
|
Экспоненциальное Exponential |
1596,7 |
1654,6 |
–788,3 |
<0,001 |
|
Логнормальное Lognormal |
1598,1 |
1673,3 |
–786,1 |
<0,001 |
Примечание:
Note: AIC – Akaike information criterion, BIC – Bayesian information criterion (or Schwarz information criterion), AFT model – accelerated failure time model.
Таблица 3 . Результаты AFT-модели с распределением Вейбулла по определению периода максимального риска смерти во время госпитализации пациентов с COVID-19
Table 3. Results of the AFT model with Weibull distribution for determining the period of maximum risk of death during hospitalization of patients with COVID-19
|
Факторы риска Risk factor |
Коэффициент ± SE Coefficient ± SE |
Z -статистика Z |
р -уровень p -level |
|
Свободный член Intercept |
10,28 ± 0,81 |
12,69 |
<0,001 |
|
Возраст старше 60 лет Age over 60 years |
–0,89 ± 0,24 |
–3,67 |
<0,001 |
|
Д-димер > 250 нг/мл D-dimer > 250 ng/mL |
–1,19 ±0,25 |
–4,66 |
<0,001 |
|
Нейтрофилы < 2 или > 5,5 × 109 Ед/л Neutrophils < 2 or > 5.5 × 109 units/L |
–1,01 ± 0,22 |
–4,58 |
<0,001 |
|
Уровень белка > 64 г/л Protein > 64 g/L |
0,99 ± 0,23 |
4,33 |
<0,001 |
|
Глюкоза > 6,3 ммоль/л Glucose > 6.3 mmol/L |
–0,97 ± 0,24 |
–4,07 |
<0,001 |
|
Мочевина >7,3 ммоль/л Urea > 7.3 mmol/L |
–1,09 ± 0,25 |
–4,4 |
<0,001 |
|
Креатинин > 115 для женщин и >120 мкмоль/л для мужчин Creatinine > 115 for women and >120 mmol/L for men |
–0,88 ± 0,22 |
–3,95 |
<0,001 |
|
АСТ > 35 Ед/л AST > 35 Units/L |
–0,83 ± 0,20 |
–4,14 |
< 0,001 |
|
С-реактивный белок > 10 мг/л C-reactive protein > 10 mg/L |
–0,99 ± 0,33 |
–2,97 |
0,003 |
Примечание: АСТ – аспартатаминотрансфераза.
Note: AFT model – accelerated failure time model, AST – aspartate aminotransferase.
Полученные результаты соответствуют исследованию G. Thiruvengadam и соавт. [17], в котором также на основе AFT-моделирования выявлены факторы, увеличивающие срок госпитализации, такие как креатинин > 140 мкмоль/л, Д-димер > 0,55 мг/мл, отношение нейтрофилы/ лимфоциты > 3, возраст старше 60 лет. W. Liang и соавт. показали влияние соотношения нейтрофилов к лейкоцитам на повышенный риск смерти при госпитализации с COVID-19. Также показано, что сахарный диабет и ХБП увеличивают риск летального исхода при госпитализации, что согласуется с полученными нами результатами [5]. В исследовании Y. Allenbach и соавт. также продемонстрировано, что повышенный уровень СРБ увеличивает риск смерти в период до 14 дней от начала госпитализации (ОШ = 1,63) [6].
Аналогичным образом была получена модель AFT с логнормальным распределением для оценки риска летального исхода в период 28 дней после выписки из стационара по поводу лечения COVID-19 (табл. 4).
Как видно, без учета влияния факторов максимальный риск смерти у пациентов, переболевших COVID-19, наступает на 13–25-й день после выписки из стационара. При этом если уровень креатинина был при поступлении выше 120 мкмоль/л, то время до смерти в среднем укорачивалось на 5 дней (6–22 дней), а если уровень МНО был больше нормы, то это уменьшало данный период в среднем на 3 дня (8–23-й день).
Таблица 4. AFT-модель с распределением Вейбулла по определению времени максимального риска смерти в период 28 дней после выписки пациентов с COVID-19
Table 4. The AFT model with Weibull distribution for determining the time of maximum risk of death in the period of 28 days after discharge of patients with COVID-19
|
Факторы риска Risk factors |
Коэффициент ± SE Coefficient ± SE |
Z -статистика Z |
р -уровень p -level |
|
Свободный член Intercept |
18,88 ± 5,76 |
3,28 |
0,001 |
|
Креатинин > 115 для женщин и > 120 мкмоль/л для мужчин Creatinine > 115 for women and > 120 mmol/L for men |
–4,79 ± 2,27 |
–2,11 |
0,035 |
|
МНО 0,821,18 INR 0.821.18 |
–3,01 ± 1,65 |
–1,83 |
0,068 |
Примечание: МНО – международное нормализованное отношение.
Note: AFT model – accelerated failure time model, INR – international normalized ratio.
Данные результаты косвенно согласуются с исследованием L.J. Motloch и соавт. [18] о том, что в случае нарушения со стороны системы свертываемости крови, прямая антикоагулянтная терапия в постковидный период (до года) позволяют существенно сократить риск летального исхода.
Заключение
Проведенный анализ показал, что на этапе госпитализации больного с COVID-19, а также после его выписки можно прогнозировать критические дни для наступления летального исхода с учетом наличия или отсутствия определенных факторов риска. Данные результаты могут позволить эффективно планировать сроки госпитализации и период нахождения в интенсивной терапии, определиться с датами выписки для конкретного больного. Модели выживаемости в период до 28 дней после выписки из стационара полезны с точки зрения ведения больного в постгоспитальный период и определения тактики профилактических мероприятий.
Ограничения исследования
Проведенное исследование являлось одноцентровым. Также в рассматриваемый период сбора информации о пациентах, госпитализированных с COVID-19 с 1 мая по 31 декабря 2020 г., менялись протоколы лечения, утвержденные Министерством здравоохранения Российской Федерации.
Список литературы Определение времени максимального риска летального исхода и ассоциированных с ним факторов в стационаре и после выписки у больных с COVID-19
- Shi Sh., Qin M., Shen B., Cai Y., Liu T., Yang F. et al. Association of саг^ас injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020;5(7):802-810. DOI: 10.1001/jamac-ardio.2020.0950.
- Figliozzi S., Masci P.G., Ahmadi N., Tondi L., Koutli E., Aimo A. et al. Predictors of adverse prognosis in COVID-19: A systematic review and meta-anal-ysis. Eur. J. Clin. Invest. 2020;50(10):e13362. DOI: 101111/eci.3362.
- Chowdhury M.E.H., Rahman T., Khandakar A., Al-Madeed S., Zughai-er S.M., Doi S.A.R. et al. An early warning tool for predicting mortality risk of COVID-19 patients using machine learning. Cognit. Comput. 2021;1-16. DOI: 10.1007/s12559-020-09812-7.
- Yadaw A.S., Li Y.C., Bose S., Iyengar R., Bunyavanich S., Pandey G. Clinical features of COVID - 19 mortality: development and validation of a clinical prediction model. Lancet Digit. Health. 2020;2(10):e516-e525. DOI: 10.1016/S2589-7500(20)30217-X.
- Bushman D., Davidson A., Pathela P., Greene S.K., Weiss D., Reddy V. et al. Risk factors for death among hospitalized patients aged 21-64 years diagnosed with COVID-19-ew York City, March 13 - April 9, 2020. J. Racial. Ethn. Health Disparities. 2021;9(4):1584-1599. DOI: 10.1007/ s40615-021-01098-1.
- Allenbach Y., Saadoun D., Maalouf G., Vieira M., Hellio A., Bod-daert J. et al. Development of a multivariate prediction model of intensive care unit transfer or death: A French prospective cohort study of hospitalized COVID-19 patients. Observational Study. PLoS One. 2020;15(10):e0240711. DOI: 10.1371/journal.pone.0240711.
- Лакман И.А., Мусин Т.И., Галиуллина А.Р., Багманова З.А., Гуме-ров Р.М., Давтян П.А. и др. Факторы риска перевода больных с COVID-9 на искусственную вентиляцию легких в ретроспективном нерандомизированном исследовании. Вестник Российской академии медицинских наук. 2022;77(1):33-42. DOI: 10.15690/vramn1673. Lakman I.A., Musin T.I., Galiullina A.R., Bagmanova Z.A., Gume-rov R.M., Davtyan P.A. et al. Risk factors for switching patients with covid-19 to artificial ventilation lungs in a retrospective nonrandomized study. Annals of the Russian Academy of Medical Sciences. 2022;77(1):33-42. (In Russ.). DOI: 10.15690/vramn1673.
- Grasselli G., Greco M., Zanella A., Albano G., Antonelli M., Bellani G. et al. Risk factors associated with mortality among patients with COVID-19 in intensive care units in Lombardy, Italy. JAMA Intern. Med. 2020;180(10):1345-1355. DOI: 10.1001/jamainternmed.2020.3539.
- Xie Y., Xu E., Bowe B., Ziyad A.-A. Long-term cardiovascular outcomes of COVID-19. Nat. Med. 2022;28:583-590. DOI: 10.1038/s41591-022-01689-3.
- Motloch L.J., Jirak P., Gareeva D., Davtyan P., Gumerov R., Lakman I. et al. Cardiovascular biomarkers for prediction of in-hospital and 1-year post-discharge mortality in patients with COVID-19 pneumonia. Front. Med. 2022;9:906665. DOI: 10.3389/fmed.2022.906665.
- Parohan M., Yaghoubi S., Seraji A., Javanbakht M.H., Sarraf P., Djala-li M. Risk factors for mortality in patients with Coronavirus disease 2019 (COVID-19) infection: A systematic review and meta-analysis of observational studies. Aging Male. 2020;23(5):1416-1424. DOI: 10.1080/13685538.2020.1774748.
- Dong Y.M., Sun J., Li Y.X., Chen Q., Liu Q.Q., Sun Zh. et al. Development and Validation of a Nomogram for Assessing Survival in Patients With COVID-19 Pneumonia. Clin. Infect. Dis. 2021;72(4):652-660. DOI: 10.1093/cid/ciaa963.
- Atlam M., Torkey H., Fishawy N.E., Salem H. Coronavirus disease 2019 (COVID-19): Survival analysis using deep learning and Cox regression model. Pattern Anal. Appl.2021;24(3):993-1005. DOI: 10.1007/s10044-021-00958-0.
- Liang W., Liang H., Ou L., Chen B., Chen A., Li C. et al. Development and validation of a clinical risk score to predict the occurrence of critical illness in hospitalized patients with COVID-19. JAMA Intern. Med. 2020;180(8):1081-1089. DOI: 10.1001/jamaint-ernmed.2020.2033.
- Vekaria B., Overton C., Wisniowski A., Ahmad S., Aparicio-Castro A., Curran-Sebastian J. et al. Hospital length of stay for COVID-19 patients: Data-driven methods for forward planning. BMC Infect. Dis. 2021;21(1):700. DOI: 10.1186/s12879-021-06371-6.
- Thiruvengadam G., Ramanujam R., Marappa L. Modeling the recovery time of patients with coronavirus disease 2019 using an accelerated failure time model. J. Int. Med. Res. 2021;49(8):3000605211040263. DOI: 10.1177/03000605211040263.
- Chiou S.H., Kang S., Yan J. Fitting accelerated failure time models in routine survival analysis with R package aftgee. Journal of Statistical Software. 2014;61(11):1-23. DOI: 10.18637/jss.v061.i11.
- Motloch L.J., Jirak P., Moritz M., Fiedler L., Davtyan P.A., Lakman I.A. et al. Early antithrombotic post-discharge therapy using prophylactic DOAC or dipyridamole improves long-term survival and cardiovascular outcomes in hospitalized COVID-19 survivors. Front. Cardiovasc. Med. 2022;9:916156. DOI: 10.3389/fcvm.2022.916156.


