Оптимизация клинико-инструментальной диагностики церебрального ангиоспазма при аневризматическом субарахноидальном кровоизлиянии
Автор: Чеканова О.В., Скрябин В.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Опыт регионов
Статья в выпуске: 4-2 т.23, 2008 года.
Бесплатный доступ
Развитие церебрального ангиоспазма, резко осложняющее течение заболевания, продолжает оставаться важной проблемой у пациентов после разрыва артериальных аневризм и встречается в 44,8% случаев (N. Dorsch, 1991). Долгое время «золотым стандартом» диагностики ангиоспазма и его причин считалась церебральная ангиография. С появлением в арсенале практического здравоохранения менее инвазивных методов визуализации (МР-АГ, КТ-АГ) возникает необходимость оптимизации существующих диагностических протоколов. В представленное исследование включены данные 129 пациентов с верифицированным аневризматическим субарахноидальным кровоизлиянием, поступивших на лечение в нейрохирургический центр ГКБ №40 г. Екатеринбурга с января 2004 по январь 2006 гг. С учетом имеющегося опыта обсуждается практическая ценность различных методов диагностики церебрального ангиоспазма на разных этапах течения заболевания. Цель представленной работы - оценить вклад КТ-АГ, ЦАГ и ТКУЗДГ в диагностику ангиоспазма при аневризматическом САК и предложить алгоритм их использования на разных этапах заболевания
Церебральный ангиоспазм, аневризматическое субарахноидальное кровоизлияние, клинико-инструментальная диагностика
Короткий адрес: https://sciup.org/14918976
IDR: 14918976 | УДК: 616.13-007.64:
Текст научной статьи Оптимизация клинико-инструментальной диагностики церебрального ангиоспазма при аневризматическом субарахноидальном кровоизлиянии
В диагностике артериальных аневризм и ангиоспазма при аневризматическом субарахноидальном кровоизлиянии в качестве «золотого стандарта» долгое время использовалась рентгеновская церебральная ангиография и ее разновидности: дигитальная субтракционная ангиография или трехмерная ротационная ангиография. Но, по мнению большинства авторов, катетеризационная ангиография продолжает оставаться манипуляцией, сопряженной с реальным риском тромбоэмболических осложнений, интималь-ных или тотальных расслоений сосудистой стенки [1].
Летальность при церебральной ангиографии составляет 0,01% [2], риск развития стойкого неврологического дефицита – от 0,1% до 1,0% [1, 4, 5].
К безусловным достоинствам этого метода относится высокая разрешающая способность и естественное распространение рентгеноконтрастного вещества в просвете сосуда с возможностью покадровой съемки процесса его прохождения по сосудистому руслу.
По мнению Свистова Д.В. и соавт. (2002), которые провели ретроспективный анализ 1201 ангиографии; 16,8% аналоговых и 2,1% цифровых ангиографических исследований завершились неудачно: ожидаемое диагностическое заключение либо не было получено в должном объеме, либо досталось ценой осложнений. Приведенные данные в целом соответствуют мировой статистике. И, по мнению авторов, подобные результаты в свете возможностей современного минимально инвазивного диагностического комплекса более не позволяют рассматривать катетеризационную ангиографию в качестве универсального «золотого стандарта» диагностики сосудисто-мозговой патологии [6].
В зарубежных изданиях в течение последних 810 лет опубликованы результаты множества исследований, сравнивающих диагностические возможности КТ-ангиографии, МР-ангиографии, транскраниальной ультразвуковой допплерографии (ТКУЗДГ)
и дигитальной субтракционной ангиографии (ДСА) в определении церебрального вазоспазма у пациентов с острым субарахноидальным кровоизлиянием на 5-е–10-е сутки от начала развития заболевания.
К несомненным достоинствам КТ-ангиографии следует отнести малоинвазивность, возможность проведения у тяжелых больных, высокое пространственное разрешение, возможность получения трехмерных моделей, интракраниальных сосудов, неограниченное число проекций, короткое время исследования, отсутствие артефактов от кровотока, меньшую стоимость контрастных веществ (по сравнению с МРТ), возможность обследования больных с противопоказаниями для МРТ.
Метод дает возможность получить важную для нейрохирурга информацию о размерах, направлении и форме тела аневризмы, ее анатомических взаимоотношениях, шейке, прилежащих артериях, наличии и распространенности ангиоспазма.
КТ-ангиография, по мнению ряда авторов, обладает лучшими по сравнению с МР-ангиографией разрешающими способностями в диагностике артериальных аневризм [12, 13] и превосходит ДСА и МР-ангиографию в диагностике небольших (диаметром 3-10 мм) и гигантских (более 25 мм) артериальных аневризм [13, 14, 15].
МР-ангиография имеет значительное совпадение с данными ДСА при диагностике спазма относительно средней и передней мозговой артерий, и более скромное относительно ВСА.
Чувствительность метода составила 92%, специфичность – 98%, положительное и отрицательное предсказательное значение метода – 92% и 98% соответственно. Специфичность была одинаково высока для всех локализаций спазма (95-99%). Чувствительность была выше для ПСА (100%) и ниже для ВСА (25%) и СМА (56%) [8].
Транскраниальная ультразвуковая допплерография в силу своей относительной простоты и широкой распространенности теоретически могла бы служить скрининг-методом для выявления ангиоспазма. Однако, согласно опубликованным в литературе данным, высокой специфичностью (99%) и чувствительностью (67%) этот метод обладает только для СМА. Положительное и отрицательное предсказательные значения метода составляют для СМА 97% и 78% соответственно. Относительно других артерий сведения о точности исследования и полезности метода в диагностике ангиоспазма отсутствуют [9].
К достоинствам ультразвукового исследования относятся безвредность, возможность выполнения у постели больного (а также в амбулаторных условиях), возможность мониторирования вазоспазма у пациентов с аневризматическим субарахноидальным кровоизлиянием во время операции и в послеоперационном периоде.
Недостатками являются: значительное время исследования (20-60 минут, в то время как непо- средственно сканирование при КТ-ангиографии занимает 30-60 секунд); невозможность проведения исследования примерно у 12% больных из-за непроницаемости костных «окон») [10]; «высокая зависимость получаемых результатов от опыта врача исследователя» (high operator-dependent) [11], т.к. даже небольшие отклонения в технике исследования могут привести к существенным изменениям в силе регистрируемого ультразвукового сигнала.
Целью представленной работы является оптимизация клинико-инструментальной диагностики церебрального ангиоспазма при аневризматическом субарахноидальном кровоизлиянии.
МАТЕРИАЛ И МЕТОДЫ
В исследование включены данные 129 пациентов с верифицированным аневризматическим субарахноидальным кровоизлиянием, поступивших на лечение в нейрохирургический центр ГКБ № 40 г. Екатеринбурга в период с января 2004 по январь 2006 гг. Объем обследования включал на догоспитальном этапе КТ головного мозга и/или люмбальную пункцию, в некоторых случаях –выполнялась МРТ головного мозга и МР-ангиография. Всем исследуемым больным проводилась КТ-ангиография на базе отделения лучевой диагностики ГБ№ 41 и динамический мониторинг с помощью транскраниальной допплерографии. Среди пациентов было 66 мужчин и 63 женщины в возрасте от 13 до 69 лет. Тяжесть состояния при поступлении по шкале Hunt-Hess у большинства больных – 1 до 3 баллов. Время от начала развития САК до поступления – от 1 суток.
В течение 1-3 суток от начала развития субарахноидального кровоизлияния поступили 55 пациентов, в течение 4-7 суток – 21, в течение 8-14 суток – 13, в течение 15-21 суток – 3 и позднее 22 суток – 37 пациентов.
КТ-ангиография в течение 1-3 суток от начала развития САК была выполнена у 43 больных.
Оперативное вмешательство было проведено у 108 пациентов (клипирование – у 102, укутывание мышцей – у 3 и эндоваскулярная эмболизация отсоединяемыми микроспиралями Cordis – у 3).
В течение 1-3 суток от начала развития САК были прооперированы 17 пациентов, в течение 4-7 суток – 23, в течение 8-14 суток – 14, 15-21 суток –12, свыше 22 суток – 42 пациента.
В группу неоперированных вошел 21 пациент. Мотивом для отказа от оперативного вмешательства служили: тяжесть состояния пациента, наличие тяжелой сопутствующей соматической патологии, невозможность клипирования аневризмы из-за ее топографо-анатомических особенностей. Все эти пациенты получали 3Н-или 2Н-терапию в условиях РАО и ПИТ.
Критерии включения в исследование:
-
1) все пациенты с субарахноидальным кровоизлиянием, подтвержденным КТ головного мозга без
-
контраста или результатами анализа ликвора, полученного при люмбальной пункции;
-
2) все пациенты с разорвавшимися аневризмами, обнаруженными с помощью КТ, МРТ и МР-АГ;
-
3) все пациенты с неврологическими симптомами или данными анамнеза, указывающими на наличие АА.
Критерии исключения:
-
1) пациенты, которые ранее прошли ЦАГ в других медицинских центрах;
-
2) пациенты с тяжелой аллергией на контраст, используемый при КТ-АГ;
-
3) пациенты с тяжелой почечной недостаточностью, что делает невозможным применение контраста, а, следовательно, и КТ-АГ.
КТ-АГ выполняется с помощью высокоскоростного спирального мультидетекторного томографа (16-детекторного).
Результат каждой КТ-АГ помимо специалиста по лучевой диагностике оценивался по крайней мере двумя нейрохирургами.
В ряде случаев до поступления в нейрохирургический центр производились МРТ головного мозга, МР-АГ интракраниальных артерий.
Среди оперированных больных дооперационно МРТ была выполнена у 16 пациентов; МР-признаки артериальных аневризм, позднее подтвержденные КТ-АГ и интраоперационными находками, были выявлены в 6 случаях.
МР-АГ интракраниальных артерий в этой группе прошли 7 человек, диагноз был подтвержден данными КТ-АГ и интраоперационными находками в 5 случаях.
Среди неоперированных больных МРТ головного мозга была выполнена у 4 человек; совпадение с данными КТ-АГ имело место в 2 случаях; МР-АГ в этой группе не проводилась.
В стандартный объем обследования для пациентов, участвовавших в исследовании помимо данных лучевой диагностики, клинического и неврологического осмотра, входили динамический мониторинг с помощью ТКУЗДГ, консультации нейроофтальмолога, нейроотиатра и, при наличии показаний, терапевта.
Для контроля послеоперационных изменений в большинстве случаев выполнялась КТ, которая в 5 случаях была дополнена ЦАГ.
Консервативное лечение пациентов, поступивших в остром периоде САК в основном было направлено либо на предотвращение развития церебрального ангиоспазма, либо на ликвидацию его проявлений и проводилось в условиях РАО и ПИТ.
Для оценки динамики ангиоспазма использовалась ТКУЗДГ.
В рутинном исследовании определяли ЛСК в СМА (Vm – средняя скорость,Vs – систолич., Vd – диастолич., Pi – пульсативный индекс Гослинга, Ri – резистивный индекс Pourcelot, Ko – коэфф. овер-шута).
Статистическая обработка результатов проводилась с использованием пакета программ Statistica и Biostat. Применялись методы статистического описания переменных, корреляционного, регрессионного анализов, конечной целью которых являлось выявление значимых результатов при p< 0,01.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Относительно КТ-ангиографии ряд авторов сообщает о наличии полного совпадения с данными ДСА относительно локализации и степени спазма в среднем в 86% случаев с коэффициентом корреляции 0,757 (р<0,001). Результаты были выше при отсутствии ангиоспазма (92%) и при наличии выраженного ангиоспазма (100%), чем при легком (57%) и умеренном спазме (64%) [7].
КТ-ангиография позволяет выявить ангиоспазм при разрыве артериальной аневризмы на 5-е–11-е сутки [16, 17].
Выполнение КТ-ангиографии перед рентгеноконтрастной ангиографией, по данным литературы, снижает потребность в выполнении инвазивного исследования на 20-80% и снижает суммарный риск внутригоспитальных осложнений [18].
В нашей практике появление КТ-ангиографии позволило почти полностью отказаться от использования ЦАГ в ургентной диагностике аневризматического субарахноидального кровоизлияния.
Из 108 человек в группе оперированных больных ЦАГ прошли 15 пациентов; из них 4 пациента прошли ЦАГ в качестве послеоперационного контроля для оценки адекватности клипирования; из этих 4 пациентов у двоих ЦАГ была выполнена на фоне генерализованного ангиоспазма. В качестве первичного метода диагностики ЦАГ прошли 8 человек, из которых 7 с момента поступления имели признаки церебрального ангиоспазма по данным КТ-АГ и ТКУЗДГ. По данным ЦАГ, ангиоспазм был диагностирован в 3 случаях. У 3 пациентов ЦАГ дополняла КТ-АГ для уточнения анатомии аневризмы или в случае наличия множественных аневризм. Небольшое количество пациентов, у которых была выполнена ЦАГ, не позволило выявить статистически значимых закономерностей.
Решение о тактике ведения больного принималось только на основании данных КТ-АГ у 121 пациента.
Хирургическое лечение только на основании данных КТ-АГ проведено у 96 пациентов. У всех пациентов интраоперационные данные относительно размеров и локализации артериальных аневризм в 100% случаев совпали с данными, полученными при КТ-ангиографии.
Результаты проведенных сопоставлений, хотя и на небольшом количестве пациентов, показывают высокую информативность КТ-ангиографии как для диагностики артериальной аневризмы как причины САК, так и церебрального ангиоспазма. В ходе исследования выявлено, что КТ-ангиография помимо
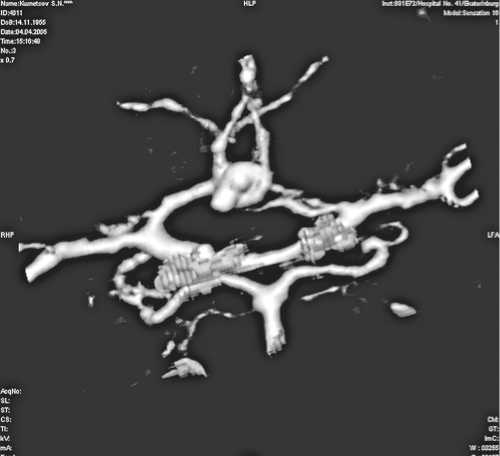
Рис. 1. КТ-3D-ангиограмма интракраниальных артерий пациента, включенного в исследование
Мужчина 50 лет поступил в клинику на 2-е сутки САК, Н-Н 3. КТ-АГ выполнена на 2-е сутки: выявлена мешотчатая аневризма ПСА, спазм А1 слева. При динамическом мониторинге ТКУЗДГ признаки спазма высокой степени выявлены на 6-е сутки развития заболевания. На 19-е сутки произведено клипирование аневризмы. На 5-е сутки после оперативного вмешательства диагностировано появление очага ишемии на КТ головного мозга, что совпало с появлением признаков отсроченной церебральной ишемии, повлекшей летальный исход установки диагноза, уточнения анатомии аневризмы позволяет определить наличие церебрального ангиоспазма, начиная с первых суток развития заболевания (рис. 1).
Использование термина «сосудистый спазм» нуждается в пояснении.
В.В. Крылов и соавт. (2001) определяют сосудистый спазм как сужение просвета артерий при САК, выявляемое с помощью церебральной ангиографии. Сосудистый спазм, определяемый с помощью ангиографии и сопровождающийся неврологическими расстройствами, относится к так называемому симптоматическому спазму.
Многие зарубежные авторы считают целесообразным выделение терминов «ранний вазоспазм» (ульт-раранний вазоспазм, острая церебральная вазоконстрикция или острый артериальный спазм) для обозначения сосудистого спазма, выявляемого при ангиографии в течение первых 48 часов после разрыва аневризмы, и «отсроченный церебральный вазоспазм» для определения сосудистого спазма, который возникает от 4 до 14 дня после САК.
Симптоматический спазм в литературе часто используется попеременно с понятиями «отсроченный ишемический неврологический дефицит» и/или «отсроченная церебральная ишемия». Последнюю наиболее целесообразно использовать для определения обратимого или стойкого неврологического ухудшения и/или образования церебрального инфаркта вследствие подтвержденного вазоспазма.
Woertgen и соавт. [15] определили отсроченную церебральную ишемию как новый инфаркт на КТ-сканах, которого не было при поступлении или в пределах одного дня после проведения оперативного лечения.
Claassen и др. [16] определили отсроченную церебральную ишемию как необъяснимое иначе клиническое ухудшение и/или новый инфаркт на КТ-сканах, которого не было сразу после начала лечения разорвавшейся аневризмы.
Образование церебрального инфаркта вследствие вазоспазма – радиологический диагноз, при постановке которого следует исключить другие причины (в т.ч. энцефаломаляцию при ВЧГ, осложнения ЦАГ или эндоваскулярного лечения –артериальную окклюзию или тромбоэмболию, осложнения хирургического лечения, полученные в результате тракции мозга, временного наложения клипсы/зажима и др.).
На первый взгляд, наличие прямого патогенетического пути: САК-ангиографически подтвержденный вазоспазм –церебральный инфаркт-неблагоприятный исход (смерть или инвалидизация) является очевидным и не требующим дальнейших исследований.
В таком случае, вероятно, ангиографический вазоспазм и/или образование ишемического инфаркта вследствие вазоспазма можно использовать в качестве прогностического маркера течения и исхода заболевания.
Однако подробные количественные данные на каждом пункте этой цепочки отсутствуют.
Недостаточно данных также относительно сравнительной значимости раннего и отсроченного вазоспазма для течения и исхода заболевания у оперированных и неоперированных пациентов.
При проведении анализа данных нами выделены группы больных с ранним ангиоспазмом, выявляемым ангиографически в течение первых 3 суток заболевания, и отсроченным ангиоспазмом, выявляемым начиная с 4-х суток от начала развития аневризматического субарахноидального кровоизлияния.
Из 129 пациентов у 17 (13,28%) был выявлен ранний ангиоспазм, у 31 (23,4%) – отсроченный и у 81 (63%) пациента не было ангиографически подтвержденного вазоспазма. Формирование очагов инфаркта вследствие спазма и церебральной ишемии, выявляемых на КТ головного мозга, было выявлено у 20 пациентов (15%); клинические признаки отсроченной церебральной ишемии наблюдались у 29 пациентов (22,65%), число летальных исходов – 22 (17,18%), число случаев тяжелой инвалидизации (2,3 балла по шкале исходов Глазго) – 14 (10,3%). Летальность в группе оперированных больных имела место в 14 случаях (12,96% из 108 оперированных), в группе неоперированных – в 8 случаях (36,3% из 21 соответственно).
В группе больных с ранним ангиоспазмом доля пациентов с развитием очаговых ишемических изменений на КТ головного мозга составила 41,17%,
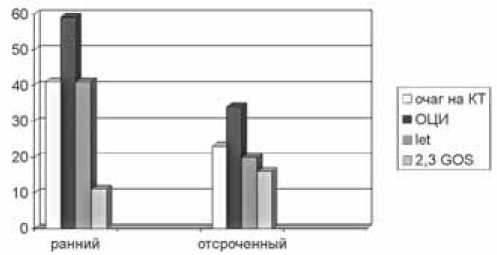
Рис. 2. Частота ишемии мозга по данным КТ, отсроченной церебральной ишемии, летальных исходов и исходов с тяжелой инвалидизацией при различных сроках церебрального ангиоспазма при аневризматическом САК*. По оси Х – распространенность сравниваемых показателей в группах больных с ранним и отсроченным ангиоспазмом. По оси Y – количество больных в %. *САК – субарахноидальное кровоизлияние, * Очаг на КТ – очаговое ишемическое поражение мозговой ткани, выявляемое на КТ головного мозга, не связанное с оперативным вмешательством, *ОЦИ – отсроченная церебральная ишемия, *Let – летальный исход, *2,3 GOS – оценка по шкале исходов Глазго 2,3 балла, что соответствует тяжелой инвалидизации отсроченная церебральная ишемия диагностирована в 58,82%, летальные исходы имели место в 41,17% случаев, тяжелая инвалидизация – в 11,76% случаев. В группе больных с отсроченным ангиоспазмом частота развития очаговых изменений на КТ головного мозга составила 23,32%, частота развития отсроченной церебральной ишемии – 34,66%, частота летальных исходов – 20% и частота случаев тяжелой инвалидизации 16,66% (рис. 2).
В ходе обработки данных получены статистически значимые корреляции между наличием раннего ангиоспазма и возникновением очагов ишемии на КТ головного мозга (r=0,5264, р=0,017), наличием раннего ангиоспазма и возникновением отсроченной церебральной ишемии (r=0,5273, р=0,017). В группе пациентов с ранним ангиоспазмом выявлены наиболее статистически значимые связи между наличием раннего ангиоспазма и развитием летального исхода (r=0,7291, р<0,01). Относительно отсроченного ангиоспазма не получено статистически значимых данных о корреляции с формированием очагов инфаркта на КТ головного мозга (r=0,0345, р=0,0851) и с развитием летального исхода (r=0,0894, р=0,05321), но получена статистически значимая корреляция с возникновением отсроченной церебральной ишемии (r=0,6991, р<0,01).
Получены статистически значимые корреляции между возникновением инфаркта на КТ и летальным исходом (r=0,6952, p=0,0000) и возникновением отсроченной церебральной ишемии и летальным исходом (r=0,6955, p=0,0000).
Транскраниальная ультразвуковая допплерография в условиях нашей клиники выполняется пациентам с острым аневризматическим САК с момента поступления в стационар. Во время пребывания больного в РАО, ПИТ прикроватный мониторинг ТКУЗДГ выполняется ежедневно. В таблице пред-
Таблица
Количественные показатели соответствия допплерографических и ангиографических данных
При проведении ТКУЗДГ определялись такие параметры, как Vm – средняя скорость, Vs – систо-лич. скорость, Vd – диастолич. скорость, Pi – пуль-сативный индекс Гослинга, Ri – резистивный индекс Pourcelot, Ko – коэфф. овершута. При обработке данных статистически значимые, но слабые корреляции при уровне p<0,05 (r=0,007) обнаружены между такими допплерографическими паттернами как Vm, Vs, Vd и исходом по 5-балльной шкале Глазго и летальностью, между Ri и показателями летальности.
В группе пациентов с ранним ангиоспазмом тяжесть состояния по шкале Hunt-Hess в большинстве случаев составляла 2 балла (58,82%) и 3 балла (35,29%) (рис. 3).
Показатели Vm и Vs у большинства этих пациентов колебались в диапазоне от 125 до 200 см/с и от 168 до 290 см/с соответственно, достигая максиму-
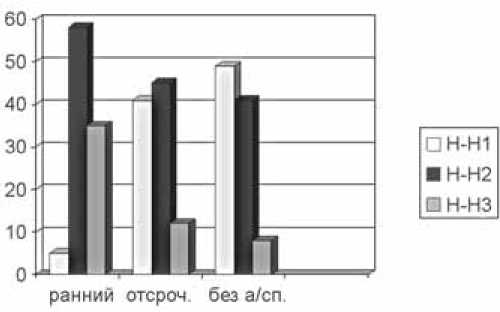
Рис. 3. Тяжесть состояния по Hunt-Hess у больных после разрыва аневризмы со спазмом и без спазма (n=129). По оси X – группы больных с ранним, отсроченным ангиоспазмом и без ангиографически подтвержденного ангиоспазма. По оси Y – количество больных в % ма в среднем на 3-и–5-е сутки от начала развития заболевания.
ВЫВОДЫ
По нашим данным, наиболее значимым клинико-инструментальным фактором прогноза течения и исхода заболевания у больных с острым аневризматическим субарахноидальным кровоизлиянием является ангиоспазм, выявляемый при проведении КТ-ангиографии.
КТ-ангиография позволяет выявить ангиоспазм при разрыве артериальной аневризмы, начиная с первых суток развития заболевания, что делает ее незаменимым инструментом ургентной диагностики ангиоспазма, его причин и связанных с ним очаговых ишемических изменений.
ТКУЗДГ является ценным дополнением для диагностики и методом выбора для динамической оценки ангиографически подтвержденного ангиоспазма.
Список литературы Оптимизация клинико-инструментальной диагностики церебрального ангиоспазма при аневризматическом субарахноидальном кровоизлиянии
- Свистов Д.В., Кандыба Д.В., Савелло А.В. и др. Современное состояние церебральной ангиографии и ее место в комплексе методов диагностики сосудистомозговых заболеваний//Материалы 3-го съезда нейрохирургов России -Спб. 2002. -С. 674675.
- Baba Y., Takahashi M, Kogori Y. Cost-effectiveness of screening unruptured cerebral aneurysms in Japan//Eur.Radiol. -2000. Vol. 10. -S. 362-365.
- Nolan Colum P., Macdonald R. Can angiographic vasospasm be used as a surrogate marker in evaluating therapeutic interventions for cerebral vasospasm ?//Neurosurg. Focus 21(3): El, 2006.
- Grzyska U., Freitag J., Zeumer H. Selective cerebral inra-arterial DSA: complication rate and control of risk factors//Neuroradiology -1990. -Vol. 32. № 2. P. 296-299.
- Heiserman J.E., Deam B.L. Neurologic complications of cerebral angiography//Am. J. Neuroradiol. -1994. -Vol. 15, № 10. -P. 14011407.
- Труфанов Г.Е., Рамешвили Т.Е., Фокин В.А., Свистов Д.В. Лучевая диагностика сосудистых мальформаций и артериальных аневризм головного мозга//Руководство для врачей -«ЭЛБИ-СПб» 2006.
- Anderson Glenn B., Asforth Rob, Steinke David E. CT angiography for the detection of cerebral vasospasm in patients with acute subarachnoid hemorrhage//Am.J.Neuroradiol. -2000 -21:1011-1015(6 2000)
- Grandin Cecile B., Cosnard Guy et al. Vasospasm after subarachnoid hemorrhage: Diagnosis with MR angiography//Am. J. Neuroradiol. -2000 -21:1611-1617(10 2000).
- Lysakowski C.,Walder B. et al. Transcranial doppler versus angiography in patients with vasospasm due to e ruptured cerebral aneurysm//Stroke 2001; 32:2292).
- Виберс Давид.О., Браун Роберт Д. и др. Руководство по цереброваскулярным заболеваниям.//М.: ЗАО «Издательство БИНОМ», 1999. -520 с.
- Link J., Brossman J. et al. Common carotid artery bifurcation: preliminary results of CT angiography and color-coded duplex sonography compared with digital subtraction angiography//Am.J.Roentgenol. -1997. -Vol. 168, № 2. -P. 361-365.
- Tanabe S., Ontaki M. et al. Three-dimensional CT angiography as a screening test for unruptured cerebral aneurysms: its possibilities and disadvantages//Clinical Neurology and Neurosurgery. -1997. -Vol. 99. -S. 80.
- Eberhardt K.E.W.,Laumer R. et al. CT-angiography (CTA) in patients with intracranial aneurysms. Comparison with MR-angiography (MRI) and digital subtraction angiography (DSA)//Clinical Neurology and Neurosurgery -1997. Vol. 99, № 1. -S. 98-99.
- Крылов В.В., Гусев С.А., Титова Г.П., Гусев А.С. Сосудистый спазм при субарахноидальном кровоизлиянии -2 изд., дополненное и переработанное -М.: «Аким», 2001.
- Woertgen C,Ullrich OW, Rothoerl RD: Comparison of the Claassen and Fisher CT classification scale to predict ischemia after aneurysmatic SAH. Zentrabl Neurochir 64: 104-108, 2003.
- Claassen J, Bernardini GL., Kreiter K et al.: Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: the Fisher scale revisited. Stroke 32: 2012 -2020, 2001.


