Оптимизация микрокапсулирования биологически активных веществ (пепсина) для использования в пищевой промышленности
Автор: Дьячкова А.В., Тихонов С.Л., Тихонова Н.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технология мясных, молочных и рыбных продуктов и холодильных производств (технические науки)
Статья в выпуске: 3 (78), 2020 года.
Бесплатный доступ
В статье представлены результаты исследования влияния монокомпонентного защитного материала микрокапсулы (мальтодекстрина) и двухкомпонентного (мальтодекстрина с гуммиарабиком и мальтодекстрина с желатином). Была проведена проверка влияния толщины защитного слоя на протеолитическую активность микрокапсулированного пепсина. Обнаружено значительное снижение протеолитической активности пепсина в контрольном образце (без капсулирования) во время хранения (р = 0,05); микрокапсулы с защитным слоем из мальтодекстрина и желатина, мальтодекстрина и гуммиарабика отличались более высокими исследуемыми показателями в сравнении с контрольными образцами и покрытыми только мальтодекстрином (р = 0,01), при этом двухкомпонентные защитные материалы не показали каких-либо существенных различий в защите (р = 0,05), и в сохранении активности микрокапсулированного пепсина в двухкомпонентные растворы с разной толщиной (4 и 6 мкм) при хранении. Результаты эксперимента по микрокапсуляции пепсина в псевдокипящем слое позволяют рекомендовать использовать раствор мальтодекстрина и гуммиарабика, при этом толщина покрытия должна быть не менее 2 мкм. Увеличение толщины защитного слоя может сопровождаться большими временными расходами и расходами материалов, не обеспечивая роста сохраняемости активности капсулированного фермента на значимом уровне (р = 0,01). Данная технология и материалы для капсулирования могут быть внедрены в пищевое производство.
Микрокапсулирование, пепсин, мальтодекстрин, желатин, гуммиарабик, псевдокипящий слой
Короткий адрес: https://sciup.org/142228788
IDR: 142228788 | УДК: 557.15
Текст научной статьи Оптимизация микрокапсулирования биологически активных веществ (пепсина) для использования в пищевой промышленности
Современная наука в области пищевой биотехнологии имеет значительный комплекс новых и усовершенствованных технологий, направленных на улучшения качества и полезности пищевой продукции. Известны различные технологии микрокапсулирования полезных пищевых ингредиентов (пробиотики, витамины, ферменты), исследованные в работах [1 - 8]. Исследователи пришли к выводу, что термостабильный и легкоусвояемый материал стенок является определяющим для стабильных витаминных микрокапсул. Природные пищевые углеводы или белки - подходящие кандидаты для материалов защитного слоя микрокапсул. Исследователи Ballesterosetal, Jeyakumarietal, Santanaetal, Вилесова и др. предлагают использовать различные материалы для стенок защитного слоя в капсулировании пищевых ингредиентов: хитозан, желатин, мальтодекстрин, сывороточный белок, казеинат натрия, модифицированные крахмалы, гуммиарабик [9 - 12].
Мальтодекстрин обычно используется для образования защитного слоя, получают микрокапсулы с высокой растворимостью в воде, низкой вязкостью, незначительным содержанием сахара. Эти свойства делают мальтодекстрин наиболее распространенным защитным материалом стенок при микрокапсулировании. Желатин также является хорошим выбором в качестве материала стенок, особенно при распылительной сушке, благодаря его хорошим свойствам эмульгирования, пленкообразования, растворимости в воде, высокой стабилизирующей активности и тенденции к образованию тонкой плотной сетки. Гуммиарабик, природный бесцветный растительный полисахаридный экссудат акации, хорошо известен как эффективный материал для стенок из-за его стабильного образования эмульсии и хорошего удержания летучих веществ и поэтому активно используется в течение многих лет [5].
На основе имеющегося опыта и анализа результатов научных исследований в области микрокапсулирования можно заключить, что в передовых научных исследованиях на данном этапе пока не выделяются однозначно эффективные технологии микрокапсулирования и универсальные материалы для стенок микрокапсул, но предлагаются варианты, которые отвечают задачам повышения качества пищевых продуктов. Данная идея находит свое подтверждение в работах [13, 14]. Каждый метод микрокапсулирования имеет преимущества и недостатки, в том числе неэффективный материал ядра, сложность процедуры, низкую эффективность инкапсуляции или проблемы с точки зрения воспроизводимости [15]. Ни один процесс инкапсуляции не может быть адаптирован ко всем основным материалам или применению продукта в силу несоответствия их конкретным задачам повышения качества пищевых продуктов. В работах по пищевой биотехнологии были предприняты попытки улучшить свойства микрокапсулирования, где изучалось использование смеси углеводов с белками и полисахаридами в различных пропорциях. Выбор полимерных смесей, которые могут привести к более высокой эффективности инкапсуляции и более низкой стоимости, чем отдельные биополимеры, был предметом повышенного интереса [5, 16 - 19].
Тем не менее в многочисленных работах [2, 5, 20, 21] обоснованным считают применение технологии микрокапсулирования в псевдокипящем слое. Сушка с распылением стала успешной промышленной технологией, основным используемым методом для капсулирова-ния пищевых ингредиентов из-за его невысокой стоимости обработки, быстрого испарения воды и простоты применения и масштабирования.
Выбор подходящего материала для защитных стенок является чрезвычайно важным фактором для капсулирования биологически активных соединений. Этот материал должен защищать вещество ядра от его разрушения, иметь требуемую механическую прочность, быть совместимым с пищевым продуктом, обеспечивать контролируемое высвобождение и/или иметь термические свойства, совместимые со свойствами продукта [17 - 19].
Признавая значимость и опираясь на результаты пищевой инженерии, считаем, что сегодня исследования должны быть направлены на поиск новых перспективных способов микрокапсулирования, включающих технологию микрокапсулирования и материал для защитного слоя. Результативной будет та технология, которая обеспечивает высокое качество микрокапсул, сохраняемость и технологичность капсулированного вещества и экономический эффект.
Цель работы – экспериментально обосновать состав защитного покрытия при микрокапсулировании фермента пепсина и разработать рекомендации по его микрокапсулированию.
Материал и методы исследований
Капсулируемое вещество – пепсин. В эксперименте были изготовлены микрокапсулы с защитным слоем из трех различных материалов: мальтодекстрин, мальтодекстрин с желатином в соотношении 3:1, мальтодекстрин с гуммиарабиком (Е414) в соотношении 3:1; указанная пропорция показала свою эффективность в работах [16 - 18].
При приготовлении мальтодекстрина (MD) в качестве защитного вещества была повторена технология, представленная в работе [21]. Мальтодекстрин и гуммиарабик растворяли (MD + GA) в теплой дистиллированной воде (70 °С) при постоянном перемешивании при 120 об./мин в течение 1 ч и выдерживали в течение ночи при 4 ± 2 °С для регидратации. Желатин растворяли в горячей дистиллированной воде при перемешивании до образования водного раствора, затем вносили мальтодекстрин при постоянном перемешивании до полного растворения всех материалов, получая микрокапсулы (MD + GE). Производство микрокапсул было проведено по единой технологии – в псевдокипящем слое. Микрокапсулы имели различную толщину защитного слоя, которая была обеспечена разной продолжительностью капсу-лирования (большее время нанесения защитного слоя приводит к его большей толщине [20]).
Протеолитическая активность пепсина оценивалась по методу, предлагаемому и апробированному в работах [22 - 24] - путем определения степени гидролиза раствора денатурированного гемоглобина ферментом после инкубации в течение 15 мин при 40 °С. Одна единица (U) активности фермента была принята за количество фермента, которое высвобождает 1 мкмоль тирозина (мин мл)-1. Реакцию начинали добавлением 0,4 мл раствора фермента (или 10 мг сухих хитозановых гранул, содержащих иммобилизованный фермент, после инкубации в 0,01 М 2 мл HCl при 40 °С для равновесия набухания) к 2,0 мл раствора денатурированного кислотой гемоглобина (10 г). L-1 приготовили в 0,01 М HCl и смесь осторожно перемешали в пробирке при 40 °С. Через промежутки времени после смешивания реакцию останавливали добавлением 4,0 мл 5,0 % (вес/объем) раствора ТСА. Образцы были подвергнуты центрифугированию и фильтрации. Активность пепсина оценивали по увеличению УФ-поглощения супернатанта при 280 нм.
Контрольными образцами являлся чистый некапсулированный пепсин. Полученные образцы хранили в защищенном от света месте при комнатной температуре. Проверены истинные различия в начале эксперимента и сделаны замеры по прошествии 3, 6, 12, 18 мес. хранения.
Результаты исследования и их обсуждение
Оптимизация микрокапсулирования пепсина означает решение задачи контроля за высвобождением капсулируемого биологически активного вещества и в то же время сохранении его активности при хранении.
В результате проведенного эксперимента были сделаны выводы о влиянии материала для микрокапсулирования на активность пепсина. Поскольку толщина покрытия защитным слоем также оказывает влияние на активность пепсина, то определена степень влияния указанных факторов. Первоначальная активность ферментного препарата рассматривалась в качестве стандарта для оценки его стабильности. Микрокапсулы с различной толщиной защитного слоя демонстрируют лучшее сохранение первоначальной активности фермента (рис. 1).
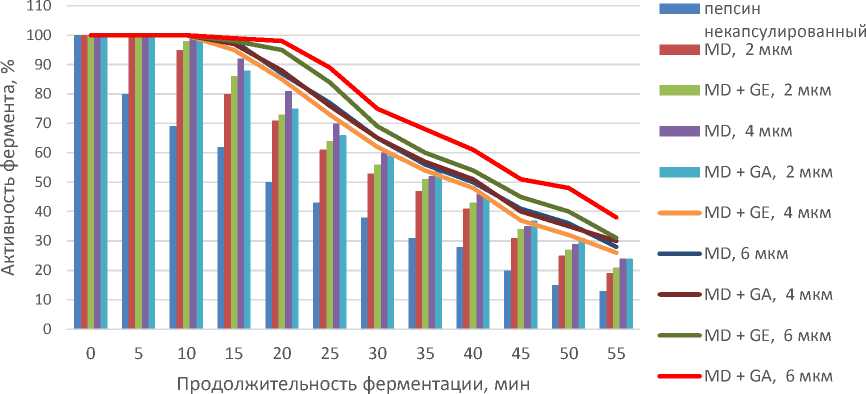
Рисунок 1 – Активность пепсина для различных микрокапсул
Из рисунка 1 видно, что сохранение наибольшей активности пепсина обеспечено микрокапсулами с двухкомпонентными растворами мальтодекстрина и гуммиарабика, мальтодекстрина и желатина с защитным слоем 6 мкм.
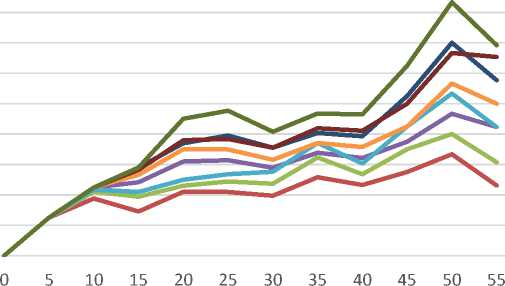
Поскольку наблюдается снижение активности как некапсулированного пепсина, так и в микрокапсулах, следует выявить скорость изменения активности в микрокапсулах по отношению к нативному ферменту. Для этого рассчитали коэффициент опережения, по которому соотносили активность фермента каждого вида образца микрокапсулы с некапсулируемым ферментом, на основе полученных данных построили график (рис. 2).
2,8
2,6
2,4
2,2
1,8
1,6
1,4
1,2
2 мкм
MD, 2 мкм
MD + GA, 2 мкм
MD + GA, 4 мкм
MD + GE, MD + GE, MD + GE,
4 мкм
6 мкм
MD, 4 мкм
MD, 6 мкм
MD + GA, 6 мкм
Рисунок 2 – Коэффициент опережения снижения активности фермента
Из рисунка 2 видно, что наибольшую результативность обеспечили микрокапсулы с защитным материалом из мальтодекстрина и гуммиарабика с защитным слоем толщиной 6 мкм. В целом было выявлено, что большая толщина слоя имеет больший защитный эффект.
18 месяцев хранения
0 3 6 9 12 15 18 месяцев хранения
Рисунок 3 - Динамика протеолитической активности пепсина
Микрокапсулы с пепсином с защитным материалом мальтодекстрина и желатина, мальтодекстрина и гуммиарабика с толщиной слоя 4 и 6 мкм не проявляли потери активности до 18 мес. хранения при 2 °С. У микрокапсул с однокомпонентным защитным слоем мальтодекстрина (при толщине стенок 2 и 4 мкм) протеолитическая активность пепсина снижалась через 8 мес., а не с первого месяца хранения, как для некапсулированного пепсина. Снижение активности объясняется зависящей от времени естественной потерей, и это может быть в значительной степени предотвращено путем микрокапсулирования. Зашитый в матрицу защитного материала из смеси мальтодекстрина с желатином или гуммиарабиком дает преимущество за счет увеличения стабильности фермента в течение всего срока хранения при 2 °С, что определено экспериментом по стабильности при хранении. Данные выводы согласуются с исследованиями [16 - 18].
Выводы
В результате проведенного эксперимента с микрокапсулированием пепсина с различными составами защитного покрытия и толщины были сделаны следующие выводы:
-
- снижение протеолитической активности пепсина в контрольном образце (без капсули-рования) во время хранения было значительным (на уровне значимости р = 0,05);
-
- микрокапсулы с защитным слоем из мальтодекстрина и желатина, мальтодекстрина и гуммиарабика отличались более высокими исследуемыми показателями в сравнении с контрольными образцами и покрытыми только мальтодекстрином (на уровне значимости р = 0,01);
-
- двухкомпонентные защитные материалы растворов мальтодекстрина и гуммиарабика, мальтодекстрина и желатина не показали каких-либо существенных различий в защите (на уровне значимости р = 0,05);
-
- отсутствие отличий в сохранении активности микрокапсулированного пепсина в двухкомпонентные растворы с разной толщиной (4 и 6 мкм) при хранении.
Результаты эксперимента по микрокапсуляции пепсина в псевдокипящем слое позволяют рекомендовать использование раствора мальтодекстрина и гуммиарабика, при этом толщина покрытия должна быть не менее 2 мкм. Увеличение толщины защитного слоя может сопровождаться большими временными расходами и расходами материалов, не обеспечивая роста сохраняемости активности капсулированного фермента на значимом уровне (р = 0,01).
Данная технология и материалы для капсулирования могут быть внедрены в пищевое производство.
Список литературы Оптимизация микрокапсулирования биологически активных веществ (пепсина) для использования в пищевой промышленности
- Dhakal Sh. P, He J. Microencapsulation of vitamins in food applications to prevent losses in processing and storage // A review. Food Research International. – 2020. - Vol. 137.
- Silva P.T., Fries L.L.M., Menezes C.R. et al. Microencapsulation: Concepts, mechanisms, methods and some applications in food technology // Ciencia Rural. - 2014. - N 44 (7). - P. 1304-1311.
- Desai K.G.H., Park H.J. Recent developments in microencapsulation of food ingredients // Dry. Technol. – 2005. - N 23. - P. 1361–1394.
- Petru A., Dima C. Microencapsulation in food products // Agro Life Scientific Journal. – 2014. - N 3. - P. 9-14.
- Gomes B., Barba F.J., Dominguez R. et al. Microencapsulation of antioxidant compounds through innovative technologies and its specific application in meat processing // Trends in Food Science & Technology. – 2018. - N 82. - P.135-147.
- Gbassi G.K., Vandamme T. Probiotic Encapsulation Technology: From Microencapsulation to Release into the Gut. Pharmaceutics, Mar. – 2012. – N 4 (1). - P. 149–163.
- Ramos P.E., Cerqueira M.A., Teixeira J.A. et al. Physiological protection of probiotic microcapsules by coatings. Crit. Rev. Food Sci. Nutr. – 2018. – N 58. - P. 1864–1877.
- Ying D., Sanguansri L., Weerakkody R. et al. Effect of encapsulant matrix on stability of microencapsulated probiotics // J. Funct. Foods. – 2016. - N 25.
- Ballesteros L.F., Ramirez M.J., Orrego C.E. et al. Encapsulation of antioxidant phenolic compounds extracted from spent coffee grounds by freeze-drying and spray-drying using different coating materials // Food Chemistry. - 2017. - N 237. - P. 623–631.
- Jeyakumari A., Zynudheen A.A., Parvathy U. Microencapsulation of bioactive food ingredients and controlled release - a review // ICAR-Mumbai research of centre of Central Institute of Fisheries Technology. – 2016. – Vol., Issue 6, 07. - P. 1-9.
- Santana A.A., Cano-Higuita D.M., De Oliveira R.A. et al. Influence of different combinations of wall materials on the microencapsulation of jussara pulp (Euterpe edulis) by spray drying Food Chem. – 2016. - N 212. - P. 1-9.
- Вилесова М.С., Айзенштадт Н.И., Босенко М.С. и др. Разработка микрокапсулированных и гелеобразных продуктов и материалов для различных отраслей промышленности // Российский химический журнал. - 2001. - № 5-6. - С. 1-10.
- Wilson N., Shah N.P. Microencapsulation of vitamins // International Food Research Journal. - 2007. - N 14. - P. 1–14.
- Mehran M., Masoum S., Memarzadeh M. Improvement of thermal stability and antioxidant activity of anthocyanins of Echium amoenumpetal using maltodextrin/modified starch combination as wall material // International Journal of Biological Macromolecules. – 2020. - Vol. - 148. - P. 768-776.
- Das S.K., David S.R.N., Rajabalaya R. et al. Microencapsulation techniques and its practice // International Journal of Pharmaceutical Science and Technology. - 2011. - N 6. - P. 1–23.
- Mahdavi S.A., Jafari S.M., Assadpoor E. et al. Microencapsulation optimization of natural anthocyanins with maltodextrin, gum Arabic and gelatin // International Journal of Biological Macromolecules. – 2016. - Vol. 85, April 2016. - P. 379-385.
- Mahdavee Khazaei K., Jafari S.M., Ghorbani M. et al. Application of maltodextrin and gum Arabic in microencapsulation of saffron petal’s anthocyanins and evaluating their storage stability and color Carbohydrate Polymers. - 2014. – N 105. - P. 57–62
- Ferrari C.C., Marconi Germer S.P., Alvim I.D. et al. Storage stability of spray-dried blackberry powder produced with maltodextrin or gum Arabic, Dry. Technol. – 2013. - N 31 (4). - P. 470–478.
- Boiero M.L., Mandrioli M., Vanden Braber N. et al. Montenegro Gum arabic microcapsules as protectors of the photoinduced degradation of riboflavin in whole milk // Journal of Dairy Science. – 2014. - N 97 (9). - P. 5328-5336.
- Kudryashov L.S., Uzakov Ya.M., Tikhonov S.L. et al. Microencapsulation of proteolytic enzymes for industrial application // Известия НАН РК. Серия геологии и технических наук. – 2020. - С. 161–170.
- Кудряшов Л.С., Тихонов С.Л., Тихонова Н.В. и др. Микрокапсулирование пепсина и оценка его протеолитических свойств // Вестник ВСГУТУ. – 2019. - № 3 (74). - С. 31-41.
- Cupp-Enyard, C. Sigma's Non-specific Protease Activity Assay - Casein as a Substrate // J. Vis. Exp. – 2008. - N 19.
- Hasem A.M. Purification and properties of a milk-clotting enzyme produced by Penicillium oxalicum // Bioresource Technology. - 2000. - № 75. - P. 219–222.
- Bergkvist R. The proteolytic enzyme of Aspergillus oryzae 1. Methods for the estimation and isolation of the proteolytic enzymes // Acta Chemica Scandinavica. - 1963. - N 17. - P. 1521–1540.


