Оптимизация определения параметров генетической чистоты линий подсолнечника на основе микросателлитных локусов ДНК
Автор: Гучетль С.З., Фролов С.С., Кузнецова Е.С.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 3 (175), 2018 года.
Бесплатный доступ
Широкое внедрение гибридов в производство в основном сдерживается из-за сложного семеноводства, предусматривающего поддержание родительских линий на высоком уровне генетический чистоты. Поэтому целью работы была оптимизация определения параметров генетической чистоты линий подсолнечника на основе микросателлитных локусов ДНК. Материалом для исследования служили 12 линий коллекции подсолнечника Армавирской опытной станции ВНИИМК. Геномную ДНК выделяли из 100 отдельных 5- 7-дневных этиолированных проростков подсолнечника каждого образца с использованием СТАВ-буфера. Показано, что 11 пар праймеров для ПЦР выявляют стабильный, воспроизводящийся полиморфизм фракций амплифицированной ДНК. В результате проведенных исследований для определения параметров генетической чистоты линий подсолнечника с помощью микросателлитных локусов ДНК с использованием критериев уровня полиморфизма были отобраны семь пар праймеров. Для оптимизации метода две пары праймеров (ORS 5 и Har 432) были объединены в мультиплексный набор. Остальные пять локусов (ORS 559, Har 432, ORS 5, ORS 815, ORS 1144) амплифицировались отдельно. Сократить количество анализов также позволяет создание смесей, состоящих из объединенных аликвот ДНК отдельных проростков в одной пробирке. В случае если после ПЦР на фореграмме обнаруживаются дорожки с несколькими фракциями, образцы ДНК, из которых собрана эта нетипичная смесь, амплифицируются отдельно, чтобы выяснить количество нетипичных семян.
Подсолнечник, линии, генетическая чистота, днк, микросателлитные локусы
Короткий адрес: https://sciup.org/142216735
IDR: 142216735 | УДК: 633.854.78:575 | DOI: 10.25230/2412-608X-2018-3-175-34-39
Текст научной статьи Оптимизация определения параметров генетической чистоты линий подсолнечника на основе микросателлитных локусов ДНК
The wide introduction of hybrids into production is mainly limited by complicated seed growing foreseeing maintenance a high level of genetic purity of parental lines. So the work purpose was to optimize determination of parameters of sunflower lines genetic purity basing on DNA microsatellite loci. We used 12 sunflower lines from collection of the Armavir experimental station of the All-Russian research institute of oil crops (Krasnodar region). A genomic DNA was isolated from 100 separate 5–7-days growing etiolated sunflower seedlings of each sample using STAB-buffer. The 11 pairs of primers for PCR showed stable repeating polymorphism of fractions of amplified DNA. Seven pairs of primers were chosen as a result of determination of parameters of sunflower lines genetic purity using DNA loci and criteria of polymorphism level. To optimize the method two pairs of primers (ORS 5 and Har 432) were united into multiplex set. The last five loci (ORS 559, Har
432, ORS5, ORS 18, ORS 1144) were amplified separately. Creation of mixture containing united aliquots of DNA of the separate seedling in a vial allows decrease analyses quantity. In case of detection the ways with several fractions on phoregram after PCR, DNA samples of this atypical mixture are amplified apart to ascertain amount of off-type seeds.
Введение. Подсолнечник является основной масличной культурой в Российской Федерации, причем межлинейные гибриды занимают значительные посевные площади. Широкое внедрение гибридов в производство главным образом сдерживается сложностью их семеноводства, предусматривающего поддержание родительских линий и поколения F1 на высоком уровне генетический чистоты [1]. Существующий для определения генетической чистоты метод грунтового контроля семян энергозатратен, а получаемая оценка субъективна и требует длительного времени. Наиболее удобными для характеристики генотипов являются маркеры, основанные на полиморфизме биохимических признаков, таких как изоферменты и запасные белки [2; 3; 4], а также нуклеотидные последовательности ДНК (ДНК-маркеры) [5; 6; 7]. С помощью данных маркеров можно проводить как оценку гибридной чистоты партий семян, так и осуществлять идентификацию линий и гибридов сельскохозяйственных культур. На подсолнечнике в разных учреждениях оценивают генетическую чистоту линий и гибридов всеми перечисленными выше способами [2; 4; 7; 8]. Кроме того, в 2015 г. Международной организацией стандартизации (ISO) издан стандарт ISO/TR 17622:2015 по определению типичности подсолнечника с помощью ДНК-маркеров [9]. В данном стандарте для анализа генетической чистоты подсолнечника предложено использовать шестнадцать пар микросател-литных праймеров к SSR-локусам. Микросателлитные повторы ДНК (SSR) являются вполне приемлемыми в качестве генетических маркеров, поскольку расположены в геноме эукариот случай- ным образом, обладают высоким уровнем полиморфизма, кодоминантны, хорошо воспроизводятся при повторном проведении полимеразной цепной реакции. Но, несмотря на несомненную привлекательность применения ДНК маркеров для селекционно-генетических исследований, ограничением их использования может быть стоимость расходных материалов и лимит времени, накладываемый требованиями экспресс-анализа. Поэтому многими группами исследователей преследуется цель создания эффективной и экономичной системы анализа. Так, чтобы упростить процедуру и уменьшить стоимость флюоресцентного анализа SSR, были оптимизированы условия мультиплексного ПЦР и гель электрофореза в генетическом исследовании инбредных линий подсолнечника Helianthus annuus L. [10]. Акинина Г.Е. с соавторами объединили шестнадцать пар микросателлит-ных праймеров к SSR-локусам, предложенным к использованию в стандарте ISO/TR 17622:2015 для определения генетической чистоты подсолнечника, в пять мультиплексов в зависимости от температуры отжига и размеров продуктов амплификации [7]. Исследовательской группой Супруна И.И. разработан мультиплексный набор ДНК локусов для маркерной селекции яблони на устойчивость к парше и для идентификации штаммов парши яблони [11; 12].
Целью нашей работы была оптимизация определения параметров генетической чистоты линий подсолнечника на основе микросателлитных локусов ДНК.
Материалы и методы. Материалом для исследования служили 12 линий подсолнечника коллекции АОС ВНИИМК: ВА 93, ВА 760, ВА 761, ВА 4, ВА 6, ВА 384, ВА 389, ВА 317, ВА 325, ВК 21, ВА 337, ВА 737. Геномную ДНК выделяли из 100 отдельных 5–7-дневных этиолированных проростков подсолнечника каждого образца с помощью модифицированного метода Saghai-Maroof et аl. [13] с использованием СТАВ буфера.
Для проведения ПЦР использовали
25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5–3 мM MgCl2; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы. Амплификацию проводили в приборе Терцик (ДНК-технология, Россия). Условия амплификации: начальная денатурация при 96 оС в течение 2 мин, затем 30 циклов при соблюдении температурновременного режима: отжиг при 55–60 оС в течение 40 с, элонгация – 1 мин при
70 оС, денатурация при 94 оС – 30 с, финальная элонгация – 2 мин. Использовали 11 SSR-локусов, описанных в работе Гу-четль С.З. с соавторами [14]. Электрофорез продуктов амплификации проводили в агарозном геле (2 % агароза, 1 × ТАЕ-буфер и 1 × SB-буфер) с использованием камеры для горизонтального электрофореза (SE. 2, ДНК-технология, Россия) в течение 1–1,5 ч при силе тока 60 mA и напряжении 90–100 V. Последующее окрашивание осуществляли бромистым этидием. Визуализация и документирование результатов электрофореза обеспечивались при помощи трансиллюминатора ECX-F20.M (WILBER LOURMAT, Франция) и фотоаппарата Canon EOS 550D (Япония). Идентификацию и определение размеров аллелей микросателлитных локусов проводили путём сравнения со стандартным образцом – маркером молекулярной массы 100 bp (СИБЭНЗИМ, Москва).
Индекс полиморфного содержания (PIC) [15] и эффективное число аллелей (n e ) [16] вычисляли по формулам:
PICi=1-∑ ij2, где Р – частота j паттерна для локуса i и суммирование распространяется на n паттернов.
ne=1/ ∑ ij2, где ne – эффективное число аллелей.
Результаты и обсуждение. Для оценки генетической чистоты линий предварительно была выполнена их паспортизация по микросателлитным локусам. В резуль-36
тате исследований, проведенных Гу-четль С.З. с соавторами [14] для линий АОС ВНИИМК, было показано, что 11 пар праймеров для ПЦР из 18 изученных выявляют стабильный воспроизводящийся полиморфизм фракций амплифициро-ванной ДНК, что позволяет использовать их для молекулярно-генетической паспортизации. Эти праймеры пригодны и для оценки генетической чистоты партий семян. При отборе маркеров, оптимальных для данной цели, использовали такой критерий, как уровень полиморфизма. Для этого в пределах использованной группы линий вычисляли такие показатели, как наблюдаемое число аллелей на полиморфный локус (n a ), индекс полиморфного содержания (PIC) и эффективное число аллелей (n e ). Характеристики ДНК-локусов представлены в таблице.
Таблица
Характеристика ДНК-локусов, использованных для паспортизации линий подсолнечника АОС ВНИИМК
Армавирская ОС ВНИИМК, 2018 г.
|
Локус |
Молекулярный вес продукта (п.н.) |
Температура отжига (0C) |
PIC |
n a |
n e |
|
Har 514 |
180–190 |
55 |
0,58 |
3 |
2,38 |
|
Har 1608 |
240–280 |
55 |
0,69 |
4 |
3,22 |
|
ORS 559 |
100–150 |
55 |
0,48 |
2 |
1,96 |
|
ORS 1287 |
200–210 |
55 |
0,48 |
2 |
1,96 |
|
Har 432 |
175–180 |
60 |
0,41 |
2 |
1,69 |
|
Har 1327 |
195–205 |
60 |
0,17 |
2 |
1,20 |
|
Har 432 |
0–165 |
60 |
0,49 |
2 |
1,96 |
|
ORS 5 |
320–350 |
60 |
0,46 |
2 |
1,85 |
|
ORS 815 |
180–200 |
60 |
0,48 |
2 |
1,96 |
|
ORS 1144 |
136–177 |
60 |
0,46 |
2 |
1,85 |
|
ORS 533 |
170–175 |
60 |
0,48 |
2 |
1,96 |
Примечание: PIC – индекс полиморфного содержания; n a – наблюдаемое число аллелей; n e – эффективное число аллелей
Наиболее полиморфными локусами были Har 514 и Har 1608 (наибольшее na, PIC и ne). Остальные локусы, за исключением Har 1327 с низкими показателями полиморфизма, имели средний уровень полиморфизма (na равное 2, PIC от 0,41 до 0,49, ne от 1,69 до 1,9 (таблица). Поэтому в работе использовали как максимально полиморфные маркеры, так и маркеры со средним уровнем полиморфизма: Har 514, Har 1608, ORS 559, Har 432, ORS 5, ORS 815, ORS 1144.
Традиционный лабораторный метод определения генетической чистоты линий сельскохозяйственных культур включает анализ 50–100 семян по 4–16 биохимическим или молекулярным маркерам [2; 5; 6; 7; 8]. Для снижения стоимости и времени проведения анализа, включая как этап ПЦР, так и электрофорез продуктов реакции, некоторые локусы нами были объединены в мультиплексы. Мультиплексная ПЦР является вариантом ПЦР технологии, где амплифицируются два или больше локуса одновременно в той же самой реакции. При объединении ДНК-маркеров в мультиплексы учитывали размеры амплифицируемых фрагментов и температуру отжига праймеров (таблица). Четко визуализированные продукты реакции с неперекрывающимися диапазонами размеров фрагментов ДНК удалось получить лишь для двух пар праймеров – Har 432 и ORS 5 (рис. 1).
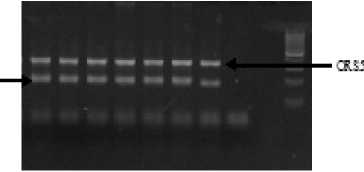
Рисунок 1 – Электрофоретические спектры продуктов амплификации ДНК мультиплексных локусов SSR ORS 5 и Har 432 у линии подсолнечника ВА 760
Поэтому эти две пары SSR-праймеров анализировались вместе, а не вошедшие в мультиплексы использовались для амплификации ДНК отдельно. Затем готовили смеси ДНК экспериментальных образцов путем объединения аликвот из пяти ДНК проростков в одной пробирке, т.е. получали 20 пробирок со смесью ДНК по каждому образцу. Далее проводили амплификацию по одному мультиплексу и пяти парам праймеров. Для выявления типичных генотипов сравнивали полученные элекрофоретические спектры экспериментальных образцов с молекулярно-генетическими паспортами линий. Поскольку инбредные линии подсолнечника представляют собой выровненный материал, объединенный образец ДНК должен быть представлен, по большей части, одной фракцией, типичной для данной линии. В случае если на форе-грамме обнаруживаются дорожки с несколькими фракциями, образцы ДНК, из которых собрана эта нетипичная смесь, амплифицируются отдельно (рис. 2), чтобы выяснить количество нетипичных семян.
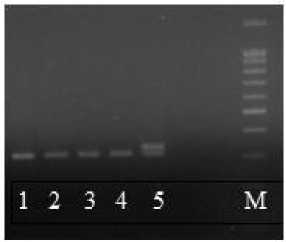
А
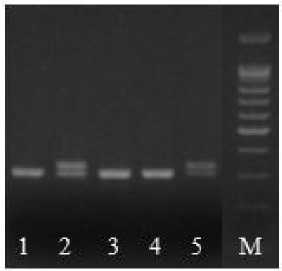
Б
Рисунок 2 – Электрофоретические спектры продуктов амплификации ДНК локуса SSR ORS 5. А – амплифицирован-ные фрагменты ДНК объединенных аликвот из пяти ДНК проростков: дорожки 1–4 – типичные; дорожка 5 – нетипичные. Б – ДНК-фрагменты пяти проростков из нетипичной объединенной смеси ДНК, амплифицированные отдельно: дорожки 1, 3, 4 – типичные; дорожки 2, 5 – нетипичные
Для определения генетической чистоты линий, вычисляли процент типичных растений в анализированной выборке.
Заключение. В сравнении с методами определения генетической чистоты, используемыми другими исследователями [5; 7; 8], предлагаемый оптимизированный способ является более экономичным. Он позволяет сократить количество анализов за счет использования мультиплексного набора и объединения ДНК, выделенной из отдельных проростков, в смеси.
Таким образом, для определения параметров генетической чистоты линий подсолнечника с помощью микросател-литных локусов ДНК, с использованием критериев уровня полиморфизма были отобраны семь пар праймеров. Для оптимизации метода две пары праймеров – ORS 5 и Har 432, были объединены в мультиплексный набор. Остальные пять локусов амплифицировались отдельно. Сократить количество анализов также позволяет объединение аликвот ДНК отдельных проростков в смеси в одной пробирке.
Список литературы Оптимизация определения параметров генетической чистоты линий подсолнечника на основе микросателлитных локусов ДНК
- Зайцев Н.И., Деревенец В.Н., Фролов С.С. Эффективные приемы гибридного семеноводства подсолнечникa//Земледелие. -2009. -№ 8. -С. 9-10.
- Гучетль С.З., Челюстникова Т.А., Антонова Т.С. Некоторые особенности определения генетической чистоты линий и гибридов подсолнечника методом изоферментного анализа//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2015. -№ 4 (164). -С. 14-19.
- Zhuang S. Application of esterase isozyme for identifying the purity of hybrid rice cultivars//Fujian Journal of Agricultural Sciences. -2004. -Vol. 1. -Is. 4. -Р. 247-249.
- Nikolic Z., Vujakovic M., Jevtic A. Genetic purity of sunflower hybrids determined on the basis of isozymes and seed storage proteins//Helia. -2008. -Vol. 31. -No 2 (48). -P. 47-54.
- Сахарова А.Н., Андреева Г.Н., Фесенко И.А., Хрусталева Л.И., Карлов Г.И. Применение SSR-маркеров для оценки уровня гибридности семян F1 огурца//Известия ТСХА. -2011. -Вып. 6. -С. 150-155.
- Дубина Е.В., Королёва С.В., Гаркуша С.В., Юрченко С.А, Есаулова Л.В. Разработка методической схемы оценки гибридности семян F1 Brassica oleracea L., основанной на полиморфизме микросателитных ДНК-маркеров//Достижения науки и техники АПК. -2016. -Т. 30. -№ 8. -С. 49-51.
- Акинина Г.Е., Тереняк Ю.Н., Шарыпина Я.Ю., Попов В.Н. Генетическая чистота семян -актуальный вопрос современной генетики и селекции растений//Фактори експериментальної еволюцiї органiзмiв. -2016. -Т. 18. -С. 56-60.
- Способ оценки типичности инбредных линий и уровня гибридности семян F1 подсолнечника: патент № 2294965 РФ/Антонова Т.С., Челюстникова Т.А., Гучетль С.З., Рамазанова С.А.; заявл. 04.07. 05, опубл. 10.03.07. -Бюл. № 17. -С.1-7.
- Molecular biomarker analysis -SSR analysis of sunflower. ISO/TR 17622:2015. International standard. -2015. -11 p.
- Zhang L.-S., Becquet V., Shao-Hua L., Zhang D. Optimization of multiplex PCR and multiplex gel electrophoresis in sunflower SSR analysis using infrared fluorescence and tailed primers//Acta Botanica Sinica. -2003. -Vol. 45. -Is. 11. -P. 1312-1318.
- Супрун И.И., Токмаков С.В., Степанов И.В., Иванова А.М. Разработка мультиплексного набора для маркерной селекции яблони на устойчивость к парше//Научные труды Государственного научного учреждения Северо-Кавказского зонального научно-исследовательского института садоводства и виноградарства Российской академии сельскохозяйственных наук. -2017. -Т. 12. -С. 26-30.
- Токмаков С.В., Супрун И.И., Насонов А.И. Разработка мультиплексной SSR-маркерной системы для идентификации штаммов парши яблони//Микология и фитопатология. -2017. -Т. 51. -№ 6. -С. 394-403.
- Saghai-Maroof M.A., Soliman K.M., Jorgensen R.A., Allard R.W. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics//PNAS USA. -1984. -Vol. 81. -P. 8014-8018.
- Гучетль С.З., Фролов С.С., Зайцев Р.Н., Кузнецова Е.С. Паспортизация линий и гиб-ридов подсолнечника селекции Армавирской опытной станции ВНИИМК: подбор оптимальных ДНК локусов и условий ПЦР//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2017. -№ 3 (171). -С. 23-28.
- Использование ПЦР-анализа в генетико-селекционных исследованиях: Научно-методическое руководство/Под ред. Сиволапа Ю.М. -Киев: Аграрна наука, 1998. -156 с.
- Айала Ф., Кайгер Д. Современная генетика. -М.: МИР, 1988. -Т. 3. -332 с.


