Оптимизация параметров энуклеации и слияния ооцита с соматической клеткой при получении клонированных эмбрионов млекопитающих
Автор: Сингина Г.Н., Лопухов А.В., Зиновьева Н.А., Шапканова Е.В., Пузик А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технологии получения трансгенных животных
Статья в выпуске: 2 т.48, 2013 года.
Бесплатный доступ
Установлено, что эффективность электрослияния зависит от напряжения, продолжительности и кратности импульса. Определены оптимальные параметры электрослияния для мультипоратора (фирма «Eppendorf», Германия): два последовательных импульса постоянного электри-чекого поля с напряжением 30 В продолжительностью 15 мкс, которым предшествует импульс переменного электрического поля с напряжением 5 В продолжительностью 10 с. Установлено, что при «слепом» методе энуклеации первое полярное тельце, служащее ориентиром расположения хромосом, не должно отклоняться от места их локализации более чем на 10°.
Культивирование in vitro, ооцит, пересадка ядер соматических клеток крупного рогатого скота, электрослияние, энуклеация
Короткий адрес: https://sciup.org/142133392
IDR: 142133392 | УДК: 636.2:576.315.086.862:591.39
Текст научной статьи Оптимизация параметров энуклеации и слияния ооцита с соматической клеткой при получении клонированных эмбрионов млекопитающих
Соматическое клонирование широко используется при получении трансгенных животных и в биомедицинских исследованиях (1).
Несмотря на то, что в последние годы в области клонирования достигнуты определенные успехи, эффективность метода у крупного рогатого скота, а также других домашних животных остается крайне низкой, высока частота аномального эмбрионального развития, а рожденное потомство менее жизнеспособно (2-4).
Сущность клонирования заключается в удалении собственного генетического материала зрелой яйцеклетки и замены его на генетический материал соматической клетки (реконструкция). Чаще всего для этого осуществляют полную энуклеацию хромосом ооцита на стадии метафазы II деления мейоза с последующей инъекцией в его перивителлиновое пространство соматической клетки-донора (5).
Для визуализации метафазных хромосом ооциты окрашивают флуоресцентным витальным красителем Hoechst 33342 и процедура энуклеации проводится в ультрафиолетовом свете (6). Однако такой методический прием негативно влияет на жизнеспособность яйцеклеток, а впоследствии и эмбрионов (7). Возможное решение проблемы — так называемая слепая энуклеация, когда ориентиром расположения метафазных хромосом служит первое полярное тельце. С точки зрения сохранения полноценности и способности к последующему эмбриональному развитию слепой метод энуклеации рассматривается как наиболее эффективный (8). Однако и здесь могут возникнуть проблемы. После выделения первого направительного тельца метафазная пластинка какое-то время находится в непосредственной близости с ним. Затем по мере старения яйцеклетки связь между хромосомами и направительным тельцем разрушается и оно начинает мигрировать в перивителлиновом пространстве. Подобное обстоятельство приводит к затруднению или невозможности качественной энуклеации (9).
Поэтому требуется идентификация факторов, влияющих на эффективность слепого метода удаления хромосом.
По завершении энуклеации выполняют слияние цитопласта и кариопласта с образованием новой реконструированной клетки. Дальнейшее развитие клонированных эмбрионов напрямую зависит от результативности объединения реципиента и донорской клетки, а также сохранения жизнеспособности образовавшегося гибрида (10-14).
В практике соматического клонирования широкое распространение получила методика слияния цитопласта и кариопласта с использованием явления электропробоя мембран контактирующей пары в импульсном электрическом поле (метод электрослияния). Электрический импульс индуцирует обратимое нарушение целостности клеточной мембраны. При этом образуются трансмембранные поры, в результате чего мембрана разряжается и сжимается. Нарушение целостности мембраны способствует слиянию клеток. В местах контакта между клетками образуются каналы цитоплазматических мембран, по которым происходит обмен цитоплазматическим коллоидом. В результате из двух клеток формируется одна. Неиспользованный мембранный материал оказывается включенным в цитоплазматические вакуоли (15).
В специальной литературе описано множество разнообразных методов электрослияния клеток, что обусловлено как техническими характеристиками приборов, используемых для этих целей, так и особенностями различных типов клеток. К факторам, влияющим на эффективность объединения цитопласта и кариопласта, относятся напряжение, продолжительность и повторяемость электрического импульса.
Нашей целью было изучение эффективности слепой энуклеации ооцитов коров в зависимости от расположения первого направительного тельца относительно хромосом на метафазе II, а также оптимизация параметров слияния энуклеированного ооцита и соматической клетки методом электропробоя мембран контактирующей пары в импульсном электрическом поле.
Методика . Источником ооцит-кумулюсных комплексов (ОКК) служили яичники коров и телок, отобранные после убоя. Транспортировку яичников осуществляли в физиологическом растворе при температуре 2835 °C в течение 3-4 ч. Выделенные методом рассечения видимых фолликулов ОКК культивировали группами по 35-40 ооцитов в модифицированной среде ТС 199, содержащей HEPES (25 мМ), Na-пируват (1 мМ), фетальную бычью сыворотку (10 %), гонадотропины (ФСГ и ЛГ — фолликулостимулирующий и лютеинизирующий гормоны) и гентамицин (50 мкг/мл). Через 20-24 ч созревания ОКК обрабатывали 0,1 % раствором гиалуронидазы, механически удаляли кумулюсные клетки (КК) и отбирали ооциты с первым полярным тельцем (ППТ).
Для изучения эффективности слепой энуклеации в зависимости от места локализации ППТ относительно хромосом оголенные ооциты окрашивали витальным флуоресцентным красителем Hoechst 33342 и разделяли на группы: I группа — ориентированные ооциты, у которых хромосомы расположены рядом с ППТ (0-5°); II группа — ооциты, в которых наблюдается отклонение ППТ не более чем на 10°; III и IV группы — ооциты c отклонением ППТ в диапазоне соответственно от 11 до 30° и более 31°. Локализацию ППТ определяли на флуоресцентном микроскопе (Axiovert 40 CFL, «Carl Zeiss GmbH», Германия), измеряя угол между линиями, соединяющими центр ооцита с первым полярным тельцем и с метафазной пластинкой. После процедуры слепой энуклеации ооциты повторно окра- шивали Hoechst 33342 с последующей оценкой эффективности удаления их собственного генетического материала на флуоресцентном микроскопе.
В качестве кариопластов использовали фетальные фибробласты крупного рогатого скота, выделенные и подготовленные к переносу, как описано ранее (16).
Энуклеацию ооцитов и перенос соматических клеток осуществляли методом прямого прокола зоны пеллюцида c помощью трехмерного гидравлического микроманипулятора с точной настройкой (фирма «Narishige», Япония), контролируя процедуру под микроскопом Diaphot (фирма «Ni-con», Япония). Слияние цитопласта и кариопласта проводили с использованием мультипоратора фирмы «Eppendorf» (Германия ) . Для этого реконструированные ооциты помещали в предварительно заполненную буфером (Eppendorf № 4308070.536) микрокамеру с расстоянием между электродами 0,2 мм. С целью определения условий электрослияния было проведено два эксперимента. В первом ооциты подвергали воздействию электрического поля переменного тока (3 и 5 В) в течение 5, 10, 15, 20 и 25 с, оценивая их расхождение к электродам и ориентацию места контакта между клетками относительно силовых линий электрического поля. Во втором эксперименте после воздействия электрического поля переменного тока, параметры которого были определены в первом эксперименте, ооциты подвергались действию одного и двух последовательных прямоугольных импульсов постоянного тока (20, 25, 30, 35, 40, 45 и 50 В) продолжительностью 15 и 30 мкс. Обработанные таким образом ооциты затем кратковременно культивировали в течение 2 ч в среде CR1aa (17). В этих экспериментах также оценивали качество гибридов по наличию или отсутствию дегенеративных изменений (сжатие и/или лизис содержимого). Результативность слияния определяли по доле образования из комплексов цитопласт—ка-риопласт морфологически нормальных стабилизированных гибридов.
Полученные данные выражали как средние проценты, подвергали арксинусной трансформации и затем обрабатывали методом однофакторного дисперсионного анализа. Для оценки достоверности различий сравниваемых средних значений использовали критерий Тьюки. Статистическую обработку проводили при помощи компьютерной программы SigmaStat. Повторность экспериментов 3-кратная.
Результаты . Эффективность слепой энуклеации ооцитов снижалась с увеличением угла отклонения ППТ от места расположения хромосом (табл.).
|
Эффективность слепой энуклеации в зависимости от расположения первого полярного тельца ( ППТ) в ооцитах коров |
||||
|
Группа |
Угол отклонения ППТ |
Всего ооцитов, n |
Получено цитопластов |
|
|
n |
| %, X ± х |
|||
|
I |
0-5 ° |
110 |
109 |
97,2±2,2 |
|
II |
6-10 ° |
62 |
51 |
82,3±3,4 |
|
III |
11-30 ° |
57 |
35 |
61,4±4,3 |
|
IV |
31-90 ° |
47 |
12 |
25,5±3,5 |
Наибольший выход цитопластов получили в I группе из ооцитов, у которых хромосомы располагались рядом с ППТ. В случае когда ППТ отклонялось от места локализации метафазы II на 6° и более, эффективность энуклеации достоверно снижалась. Так, во II, III и IV группах доля энуклеированных клеток была меньше, чем в I группе, соответственно на 14,9 (р < 0,05); 35,8 и 71,7 % (р < 0,001).
Кроме того, проявилась зависимость результативности слияния цитопласта и кариопласта от показателей применяемого электрического поля.
Так, на эффективность расхождение ооцитов к электродам и ориентацию места контакта между клетками относительно силовых линий электрического поля влияло как напряжение импульса, так и его продолжительность (первый эксперимент). В варианте с напряжением 3 В полное расхождение ооцитов к электродам происходило только при длительности импульса 20 и 25 с, однако такое воздействие сопровождалось сжатием и лизисом содержимого ооцитов. Оптимальными параметрами переменного электрического поля, обеспечивающими успешное расхождение ооцитов к электродам и сохранение их качества, следует считать импульс с напряжением 5 В и продолжительностью 10 с. Увеличение периода воздействия, как и в первом варианте, приводило к появлению дегенеративных изменений в ооцитах.
Во втором эксперименте (рис.) наибольшая доля образования гибридов наблюдалась при использовании двух последовательных импульсов постоянного электрического поля с напряжением 30 В и продолжительностью 15 мкс. Дальнейшее повышение напряжения до 35 В не приводило к положительным результатам: доля слияния циопластов с кариопластами уменьшилась на 14,5 % и составила 68,8 % (см. рис., Б). При росте продолжительности двух последовательных импульсов (см. рис., Г) эффективность слияния цитопласта и кариопласта снижалась. С повышением напряжения импульса с 25 до 40 В происходило плавное увеличение доли гибридов с дегенеративными изменениями (с 16,6 до 80,0 %).
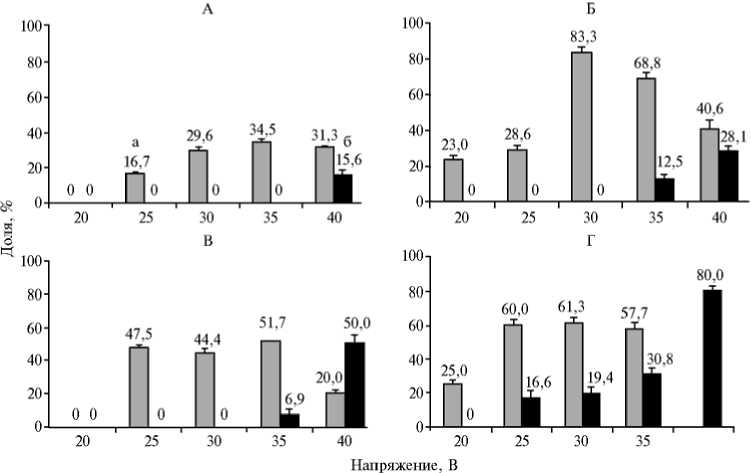
Эффективность слияния цитопласта и кариопласта коров в зависимости от напряжения, числа и продолжительности импульса постоянного электрического поля: А — 1 импульс продолжительностью 15 мкс, Б — 2 импульса продолжительностью 15 мкс, В — 1 импульс продолжительностью 30 мкс, Г — 2 импульса продолжительностью 30 мкс; а — доля слияния, %, б — доля регенерации, %.
Малоэффективным с точки зрения образования гибридов оказалось использование однократного электрического импульса продолжительностью 15 мкс (см. рис., А). Однократное воздействие в течение 30 мкс (см. рис., В) при использовании импульсов с напряжением 25, 30 и 35 В примерно в равной степени повышало долю слияния по сравнению с вариантом 20 В — соответственно на 47,5; 44,4 и 57,4 % (р < 0,001).
Необходимо отметить, что несмотря на повышение доли слияние при росте продолжительности воздействия однократного электрического импульса (см. рис., В), его эффект по сравнению с таковым от двух последовательных импульсов меньшей продолжительности (см. рис., Б) оказался ниже. При режиме 25 В/30 мкс было получено соответственно на 35,8 (р < 0,001) и 21,3 % (р < 0,001) меньше гибридов, чем в вариантах 30 В/15 мкс и 35 В/15 мкс.
Следует также отметить, что увеличение кратности импульса усиливало образование гибридов независимо от силы импульса. Так, в вариантах с 20, 25, 30, 35 и 40 В при двух последовательных импульсах частота слияния повышалась на 23,0; 10,1; 53,7 (р < 0,001); 34,3 (р < 0,001) и 9,3 % по сравнению с показателями при соответствующих однократных воздействиях.
Итак, для эффективного удаления хромосом из ооцита крупного рогатого скота первое полярное тельце, служащее ориентиром их расположения при слепой энуклеации, не должно отклоняться от места локализации метафазы II более чем на 10°. Результативность слияния цитоплазм эмбрионального фибробласта и энуклеированного ооцита коровы зависит от напряжения, продолжительности и кратности электрического импульса. В случае использования для этих целей мультипоратора фирмы «Eppen-dorf» (Германия) оптимальный режим воздействия включает два последовательных импульса постоянного электричекого поля с напряжением 30 В и продолжительностью 15 мкс, которому предшествует импульс переменного электрического поля с напряжением 5 В и продолжительностью 10 с. Полученные данные позволяют рекомендовать описанные режимы электрослияния в последующих экспериментах по получению клонированных эмбрионов крупного рогатого скота.


