Оптимизация процесса иммобилизации клеток алканотрофных родококков на хвойных опилках в условиях колоночного биореактора
Автор: Куюкина М.С., Ившина И.Б., Серебренникова М.К.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Биотехнология
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
Подобран оптимальный режим проведения иммобилизации клеток родококков на гидрофобизованных хвойных опилках в условиях лабораторного колоночного биореактора. Показано, что в иммобилизованном состоянии клетки родококоов сохраняют высокую дыхательную активность в присутствии модельной нефти.
Алканотрофные родококки, иммобилизованные клетки, колоночный биореактор, респирометрия, модельная нефть
Короткий адрес: https://sciup.org/147204883
IDR: 147204883 | УДК: 579.22+579.695
Текст научной статьи Оптимизация процесса иммобилизации клеток алканотрофных родококков на хвойных опилках в условиях колоночного биореактора
Метод адсорбционной иммобилизации клеток микроорганизмов широко используется в различных отраслях биотехнологии, в том числе процессах биокатализа, а также при решении экологических проблем (Козляк и др., 1991). Иммобилизованные микроорганизмы характеризуются повышенной жизнеспособностью, устойчивостью к действию неблагоприятных факторов внешней среды и высокой каталитической активностью, которая во многих случаях возрастает в несколько раз по сравнению со свободными клетками (Синицин и др., 1994). Кроме того, иммобилизация позволяет концентрировать большие количества биомассы и избегать ее значительных потерь, что важно в условиях биореактора, а также при внесении бактериальных клеток в окружающую среду (Podorozhko et al., 2008).
В настоящее время метод адсорбции используется преимущественно для иммобилизации микроорганизмов, участвующих в очистке загрязненного воздуха или сточных вод (Пирог и др., 2005). Наиболее эффективно применение адсорбированных микроорганизмов в системах биофильтров и мембранных биореакторов, предназначенных для обработки жидких и летучих промышленных отходов (Prieto et al., 2002).
Актинобактерии рода Rhodococcus широко используются в биотехнологических процессах. Родо-кокки способны синтезировать поверхностноактивные трегалозолипиды (биосурфактанты), витамины, ферменты, усваивать многие труднодоступные и токсичные для других микроорганизмов органические субстраты, расти в экстремальных условиях среды (Ившина, 1997). Представители от- дельных видов (R. erythropolis, R. ruber и R. opacus) родококков являются активными биодеструкторами нефтяных углеводородов и других ксенобиотиков (Ившина и др., 2006). Закрепление клеток родокок-ков на поверхности носителя позволит более эффективно очищать загрязненную воду от нефти и нефтепродуктов. При этом необходимым условием результативности процесса биодеструкции является достижение высокой численности иммобилизованных клеток и их прочное закрепление на поверхности носителя. В этой связи цель настоящей работы – подбор оптимального режима адсорбционной иммобилизации клеток алканотрофных родококков на органическом носителе в условиях лабораторного колоночного биореактора для последующего использования их в биотехнологии очистки нефтезагрязненной воды.
Материалы и методы
В работе использовали штаммы R. ruber ИЭГМ 615 и R. opacus ИЭГМ 249 из Региональной профилированной коллекции алканотрофных микроорганизмов (акроним ИЭГМ, iegmcol). Клетки родококков выращивали в 250-мл колбах Эрленмейера, содержащих 100 мл мясопептонного бульона (Oxoid Ltd, Англия) на орбитальном шейкере (160 об/мин) при 28°С в течение 24 ч. Непосредственно перед иммобилизацией бактериальные клетки отмывали от питательной среды натрийфосфатным буфером следующего состава, г/л: Na2HPO4 – 3.53; KH2PO4 – 3.39.
В качестве адсорбента клеток родококков использовали твердый органический носитель – хвойные опилки с размером частиц d = 1–3 мм. С целью повышения сродства органического материала к клеткам алканотрофных родококков и углеводородному субстрату носитель предварительно обрабатывали смесью олифы и Rhodococcus -биосурфактанта в соотношении 1:1 (Патент РФ 2298033). Непосредственно перед использованием носитель отмывали дистиллированной водой и стерилизовали автоклавированием (121оС, 15 мин).
Процесс иммобилизации клеток родококков проводили в лабораторном колоночном биореакторе (рис. 1), представляющем собой стеклянную колонку (12.0×1.4 см), заполненную гидрофобизо-ванными опилками (2 г). Колонка соединялась при помощи силиконовых трубок с колбой, содержащей суспензию (2.0×107 кл/мл; 200 мл) клеток R. ruber ИЭГМ 615 и R. opacus ИЭГМ 249, отобранных в равном соотношении. Клеточная суспензия подавалась в колонку с помощью перистальтического насоса через нижнее входное отверстие со скоростью 0.6; 1.2; 2.0 и 2.8 мл/мин, орошала носитель в направлении снизу-вверх, вытекала из колонки через верхнее выходное отверстие и возвращалась в колбу. Таким образом, биореактор являлся замкнутой циркуляционной системой с переменной скоростью потока. Процесс иммобилизации осуществляли при комнатной температуре и контролировали путем измерения оптической плотности (ОП 600 нм ) клеточной суспензии с помощью спектрофотометра Lambda EZ 201 (Perkin Elmer, США) в течение 7 сут. Все эксперименты проводили в трехкратной повторности.
Определение каталитической активности иммобилизованных клеток родококков проводили с использованием 6-канального респирометра Micro-Oxymax® (Columbus, США). Оценивали скорость дыхания (в мкл мин-1), а также количество потребленного кислорода и углекислого газа (в мкл) иммобилизованными клетками родококков в присутствии модельной нефти. В качестве модельной нефти использовали 2% водную эмульсию смеси углеводородов (н-декан, н-ундекан, н-додекан, н-тетрадекан, н-гексадекан, н-гептадекан, н-нонадекан – по 12%, пристан – 6%, нафталин, аценафтен, фенантрен, антрацен – по 2%), стабилизированную 0.1% раствором твина 60. Углеводородную эмульсию подвергали УЗ-обработке (Soniprep 150, SANYO, Япония) в течение 2 мин и вносили в колонки с иммобилизованными клетками родокок-ков и неинокулированным носителем, используемым в качестве контроля. Заполненные колонки помещали в измерительные камеры респирометра. Измерения респираторной активности проводили при 22±2оС, интервал между измерениями составлял 0.42 ч.
Результаты и их обсуждение
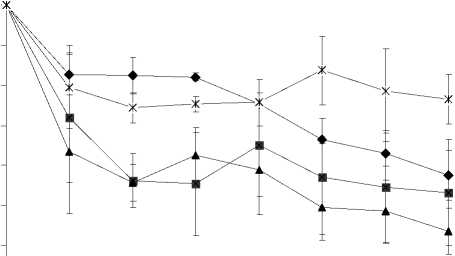
Анализ динамики иммобилизационного процесса в условиях колоночного биореактора (рис. 2) свидетельствует о том, что закрепление клеток ро-дококков на органическом носителе происходит наиболее интенсивно в течение первых суток эксперимента, в результате чего иммобилизуется от 18 до 36% бактериальных клеток. В дальнейшем наблюдается постепенное замедление процесса клеточной адсорбции и последующая стабилизация показателя оптической плотности суспензии на постоянном уровне, что свидетельствует о достижении уровня адсорбционного насыщения носителя. Следует отметить довольно большие величины доверительных интервалов средних значений показателя оптической плотности суспензии родо-кокков в аналогичных колонках, которые, вероятно, обусловлены неравномерностью распределения адсорбированных бактериальных клеток на поверхности носителя вследствие клеточной ко-агрегации и мозаичности распределения гидрофобных участков материала носителя (Podorozhko et al., 2008). При этом обнаруживаются существен-

Рис. 1. Колоночный биореактор (А) и экспериментальная установка (Б) по изучению процесса иммобилизации клеток родококков:
1 – подача жидкости в колонку; 2 – стеклянный фильтр; 3 – гидрофобизованные опилки с иммобилизованными клетками родококков; 4 – выход жидкости из колонки; 5 – суспензия клеток родококков; 6 – перистальтический насос; 7 – колонка

0,9
0,8
0,7
0,6
0,5
0,4
0,3
А
Б
В
Г
Продолжительность иммобилизации, сут
Рис. 2. Динамика процесса иммобилизации клеток родококков в колоночном биореакторе.
Скорость подачи клеточной суспензии в биореактор, мл/мин: А – 2.8; Б – 1.2; В – 0.6; Г – 2.0
ные различия в степени иммобилизации родокок-ков в зависимости от скорости подачи клеточной суспензии в биореактор. Так, наиболее высокая (57%) степень клеточной адсорбции регистрируется при скорости подачи суспензии, равной 2.0 мл/мин, в то время как соответствующие показатели при низкоскоростных (0.6 и 1.2 мл/мин) режимах работы биореактора составляют 46 и 41%, соответственно. Установлено, что дальнейшее увеличение (до 2.8 мл/мин) скорости подачи клеточной суспензии в биореактор не приводит к повышению эффективности иммобилизационного процесса. В частности, показатель оптической плотности суспензии родококков возрастает незначительно к концу наблюдения (рис. 2), что может быть обусловлено физико-химическим процессом вымывания материала носителя и биологическим процессом фрагментации клеточного мицелия при высокоскоростном режиме работы биореактора (Куюкина и др., 2007).
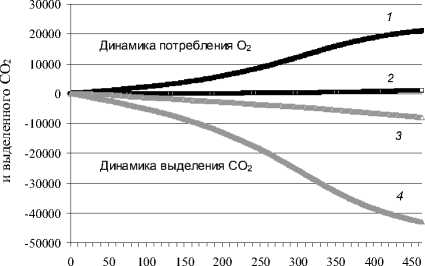
В результате респирометрических исследований установлено, что родококки в иммобилизованном состоянии характеризуются высокой каталитической активностью в отношении модельной нефти. Так, динамика дыхательной активности адсорбированных клеток родококков (рис. 3) характеризуется равномерным увеличением количества потребленного кислорода и выделенного углекислого газа, суммарные величины которых к концу эксперимента превышают контрольные показатели в 5 и 20 раз, соответственно. Кроме того, в условиях колоночного биореактора удельная скорость потребления О 2 иммобилизованными родококками достигает 0.6, а выделения СО 2 – 1.6 мкл/мин∙мг сухих клеток (рис. 4). Такая высокая скорость клеточного дыхания в присутствии нефтяных углеводородов поддерживается в течение 460 ч инкубирования, что свидетельствуют о функциональной стабильности иммобилизованных клеток родокок-ков и перспективности их использования для очистки нефтезагрязненной воды.
Время, ч
Рис. 3. Динамика респираторной активности иммобилизованных клеток родококков в условиях колоночного биореактора.
Варианты опыта: 1, 4 – адсорбированные клетки; 2, 3 – неинокулированный ноститель (контроль)
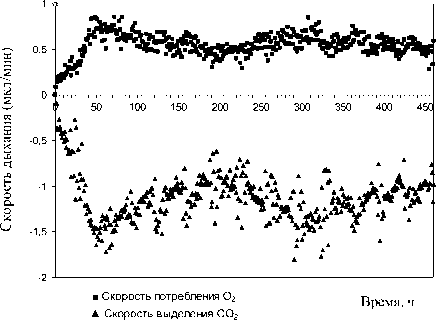
Рис. 4 . Скорость дыхания иммобилизованных клеток родококков в присутствии модельной нефти
Заключение
Определены оптимальные условия проведения иммобилизации клеток алканотрофных родокок-ков на гидрофобизованных древесных опилках в условиях лабораторного колоночного биореактора. Установлено, что данный процесс при заданном режиме (2.0 мл/мин) подачи клеточной суспензии в биореактор и концентрации клеток (2.0×107 кл/мл) завершается на 5-е сутки и характеризуется высокой (57%) степенью иммобилизации родокок-ков на органическом носителе. Посредством респирометрии показано, что родококки в иммобилизованном состоянии проявляют стабильно высокую каталитическую активность в отношении нефтяных углеводородов, поддерживаемую в течение трех недель. Таким образом, полученные результаты свидетельствуют о возможности использования иммобилизованных клеток родококков в биотехнологическом процессе очистки нефтезагрязненной воды и перспективности осуществления данного процесса в колоночном биореакторе.
Исследование выполнено при поддержке грантов ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009–2013 гг. и программы Президиума РАН «Молекулярная и клеточная биология».
Список литературы Оптимизация процесса иммобилизации клеток алканотрофных родококков на хвойных опилках в условиях колоночного биореактора
- Ившина, И.Б. Бактерии рода Rhodococcus (иммунодиагностика, детекция, биоразнообразие): дис. докт. биол. наук./Ившина Ирина Борисовна. Пермь, 1997. 197 с.
- Ившина, И.Б. Алканотрофные родококки как катализаторы процесса биодеструкции непригодных к использованию лекарственных средств/И.Б. Ившина, М.И. Рычкова, Е.В. Вихарева [и др.]//Прикл. биохим. микробиол. 2006. № 4. С. 443-447.
- Козляк, Е.И. Физико-химические основы иммобилизации клеток методом сорбции (Обзор)/Е.И. Козляк, М.М. Якимов, И.Б. Уткин [и др.]//Прикл. биохим. микробиол. 1991. Т. 27, вып. 6. С. 788-801.
- Куюкина, М.С. Кинетическая модель процесса иммобилизации на твердом носителе/М.С. Куюкина, И.Б. Ившина, М.А. Осипенко [и др.]//Рос. журн. биомеханики. 2007. Т. 11, № 2. С. 79-87.
- Пирог, Т.П. Использование иммобилизованных на керамзите клеток нефтеокисляющих микроорганизмов для очистки воды от нефти/Т.П. Пирог, Т.А. Шевчук, И.Н. Волошина, Н.Н. Грегирчак//Прикл. биохим. микробиол. 2005. Т. 41, № 1. С. 58-63.
- Пат. 2298033 Российская Федерация. Композиция для получения носителя иммобилизованных микроорганизмов, расщепляющих углеводороды, и способ получения носителя/Подорожко Е.А., Куюкина М.С., Ившина И.Б., Филп Д.К., Лозинский В.И. Приоритет изобретения 19.04.2005. Зарег. в Госреестре изобр. 27.04.2007.
- Синицын, А.П. Иммобилизованные клетки микроорганизмов/А.П. Синицын, Е.И. Райнина, В.И. Лозинский, С.Д. Спасов. М.: Изд-во МГУ, 1994. 288 с.
- Podorozhko, E.A. Hydrophobised sawdust as a carrier for immobilisation of the hydrocarbon-oxidizing bacterium Rhodococcus ruber/E.A. Podorozhko, V.I. Lozinsky, I.B. Ivshina [et al.]//Biores. Technol. 2008. Vol. 99. P. 2001-2008.
- Prieto, M.B. Biodegradation of phenol in synthetic and industrial wastewater by Rhodococcus erythropolis UPV-1 immobilized in an air-stirred reactor with clarifier/M.B. Prieto, A. Hidalgo, C. Rodríguez-Fernández [et al.]//Appl. Microbiol. Biotechnol. 2002. V. 58. P. 853-859.


