Оптимизация процесса криоконсервации спермы осетровых рыб при использовании различных сред
Автор: Пономарева Е.Н., Богатырева М.М., Антонова Н.А., Осипова В.П.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы
Статья в выпуске: 1-2 т.11, 2009 года.
Бесплатный доступ
Сохранение генетической информации ценных видов рыб, находящихся на грани исчезновения, является важной проблемой криобиологии. Основной проблемой при криоконсервации является подбор протекторов, обеспечивающих максимальное количество активных сперматозоидов после дефростации. Исследования по оптимизации процесса криоконсервации спермы русского осетра при использовании различных сред показали, что скорость перекисного окисления липидов оказывает прямое воздействие на выживаемость сперматозоидов.
Криоконсервация, сперма осетровых рыб, перекисное окисление липидов
Короткий адрес: https://sciup.org/148198273
IDR: 148198273 | УДК: 639.3.034.001.26:[577.121.7:547.441]
Текст научной статьи Оптимизация процесса криоконсервации спермы осетровых рыб при использовании различных сред
Криоконсервация остается одним из наиболее эффективных и быстроразви-вающихся направлений сохранения редких и исчезающих видов. Наличие в криобанке генетически репрезентативных коллекций геномов рыб из маточных стад на осетровых рыбоводных заводах и из естественных популяций позволяет с максимальным эффектом сохранить генетическое разнообразие этих ценных промысловых объектов. В последнее время широкое применение получили проникающие криопротекторы, которые являются наиболее эффективными в сравнении с непроникающими, но и они оказывают повреждающее действие в цикле криоконсервирования, и даже на этапе подготовки к замораживанию. Причиной этого является то, что протекторы неиндифферентны по отношению к клеткам. Криопротекторы оказывают воздействие на физико-химические и функциональные свойства цитоплазматических и митохондриальных мембран спермиев, изменяют активность ферментов [3]. Установлено, что после замораживания в мембране митохондрий развивается перекисное окисление полиненасыщенных кислот
в β-положении фосфолипидных молекул, что приводит к нарушению структуры клеточных мембран. Развитие этого процесса характерно как для внутренней мембраны митохондрий, так и для целых органелл. Снижение содержания фосфолипидов сопровождается ослаблением гидрофобных липид-липидных и липид-белковых связей в мембране. Появление перекисных группировок в мембране вызывает в первую очередь резкое уменьшение связывания липидов с белками, что ведет к существенным изменениям каталитических свойств ферментов и подавлению функциональной активности митохондрий [1].
Основной задачей наших исследований явилась оптимизация процесса криоконсервации спермы рыб методом подбора оптимальных криопротекторов и снижения их негативного воздействия на клетки.
Материалом для исследования служила сперма русского осетра, полученная на осетровых рыбоводных заводах Нижней Волги: Бертюльский, Лебяжий, Сергиевский. Исследования проводились в 2005-2008 гг. Получение спермы осуществляли методом гипофизарных инъекций. Активность половых клеток определяли по 5-ти бальной шкале Г.М. Персова [4]. В исследованиях по криоконсервации использовали сперму активностью 4 и 5 баллов. В качестве криопротекторов использовали среду Штайна (NaCl, KCl, NaHCO 3 , глюкозы, 12,5% яичного желтка, 12,5% ДМСО) и разработанную нами криосреду
№ 3 (NaCl, KCl, NaHCO 3 , CaCl 2 , маннит, сахароза, 10% яичного желтка, 10% ДМСО). Замораживание проводили по методике [6].
Об интенсивности пероксидного окисления липидов (ПОЛ) спермы судили по накоплению одного из конечных продуктов – малонового диальдегида (МДА), реагирующего с тиобарбитуровой кислотой по стандартной методике [5]. Расчет проводили по формуле:
Х=(Е*3*3,2) / (0,156*2), где Х – содержание малонового диальдегида в сперме, нмоль; Е – экстинкция проб; 3,2 – общий объем исследуемых проб, мл; 2 – объем надосадочной жидкости, взятой на определение малонового диальдегида, мл; 3 – объем проб, мл; 0,156 – экстинкция 1 нмоль малонового диальдегида в 1 мл при 532 нм.
Исследование активности сперматозоидов осуществляли на трех этапах: нативная сперма, после эквилибрации, деф-ростированная сперма. Выживаемость сперматозоидов в процессе криоконсервации постепенно снижается, причем в среде Штайна отмечается меньшее количество живых клеток после дефростации по сравнению с криосредой № 3 (рис. 1).
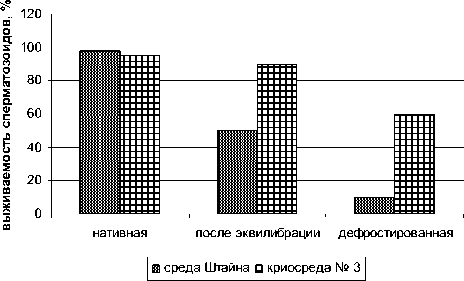
Рис. 1. Выживаемость спермы русского осетра в разных средах
Криопротекторы в той или иной степени оказывают токсическое действие на клетки при проникновении внутрь. В связи с этим после двойного температурного шока токсическое действие протектора может иметь решающее значение при восстановлении клетками процессов дыхания и метаболизма. Нами отмечен латентный период активности сперматозоидов после оттаивания, они начинают проявлять признаки жизни лишь через 30-40 секунд после активации водой, что может быть связано с отрицательным действием протекторов.
Для установления токсического воздействия протектора на сперму русского осетра проводили опыты по определению пероксидного окисления липидов до замораживания, и после дефростации материла (рис. 2). Увеличение скорости процесса ПОЛ спермы способствует повреждению мембран, что приводит к снижению смачиваемости сперматозоидов и вследствие этого к уменьшению подвижности, аномальному строению, потере жизнеспособности [7].
Полученные результаты свидетельствуют о возрастании уровня пероксидного окисления липидов спермы на исследуемых этапах криоконсервации как со средой Штайна, так и с криосредой №3, что согласуется с литературными данными о возрастании скорости ПОЛ после замораживания [2]. Установлено усиление ПОЛ спермы при криоконсервации с криосредами, несмотря на то, что один из компонентов сред – желток куриного яйца стабилизирует клеточные мембраны входящими в его состав фосфолипидами. Следует отметить, что в криосреде №3 скорость накопления МДА на всех этапах меньше, чем в среде Штайна. В связи с этим, целесообразно рассматривать добавление антиоксидантов в криосреды. Известны примеры использования синтетических жирорастворимых антиоксидантов фенольного ряда в качестве криопротекторов спермы сельскохозяйственных животных [2].
В результате проведенных экспериментов установлено, что выживаемость сперматозоидов с поступательным движением на всех этапах процесса замораживания-оттаивания выше в криосреде № 3 по сравнению со средой Штайна. Так, после эквилибрации количество активных сперматозоидов составляет 90% и 50%, а после дефростации – 60% и 10%, соответственно. Это обусловлено более интенсивным процессом ПОЛ спермы русского осетра во время криоконсервации при использовании среды Штайна. Содержание малонового диальдегида в варианте со средой Штайна по сравнению с криосредой № 3 в 1,6 раза выше после эквилибрации и в 2,4 раза выше после дефростации.
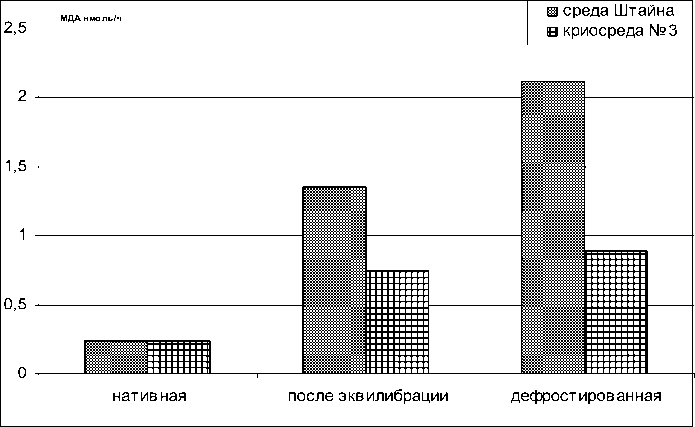
Рис. 2. Изменение уровня пероксидного окисления липидов спермы русского осетра до и после криоконсервации
Список литературы Оптимизация процесса криоконсервации спермы осетровых рыб при использовании различных сред
- Белоус, А.М. Замораживание и криопротекция. Биохимия мембран, кн. 3 (под ред А.А. Болдырева)./А.М. Белоус, Е.А. Гордиенко, Л.Ф. Розанов//М., Высшая школа, 1987.
- Ерохин, А.С. Новый антиоксидант-криопротектор спермы барана/А.С. Ерохин, Т.М. Епишина, И.Е. Чернова//Зоотехния. -1994. -№10. -С. 28-29.
- Овсянников, С.Е. Влияние проникающих криопротекторов на интенсивность перекисного окисления липидов мембран спермиев птиц при гипотермии/С.Е. Овсянников, И.Н. Мартынюк, Ю.В. Никитченко, Т.П. Линник//Мат. конф. «Криоконсервация как способ сохранения биологического разнообразия» (28-30 октября 2008 г., г. Пущино). 2008. -С. 99.
- Персов, Г.М. Дозирование спермиев как способ управления оплодотворением яйцеклеток осетровых: Докл. АН СССР. -1953. -90, № 6. -С. 1183-1185.
- Строев, Е.Н. Практикум по биологической химии/Е.Н. Строев, В.Г. Макарова//М.: Высшая школа. -1986. -279 с.
- Цветкова, Л.И. Методическое пособие по криоконсервации спермы карпа, лососевых и осетровых видов рыб./Л.И. Цветкова, С.И. Савушкина//М.: ВНИИПРХ, 1997. -11 с.
- Цебржинський, О.I. Оксидативна активнiсть у сперматозоїдах//Фiзiол. журн. -2000. -Т.46, №4. -C. 71-75.


