Оптимизация режимов заместительной почечной терапии, по почечным и внепочечным показаниям, у больных с тяжелым острым панкреатитом
Автор: Ветшева М.С., Подкорытова О.Л., Лубенников А.Е.
Журнал: Хирургическая практика @spractice
Рубрика: Хирургия и смежные специальности
Статья в выпуске: 3, 2014 года.
Бесплатный доступ
Острый панкреатит (ОП) остается одним из самых распространенных заболеваний в абдоминальной хирургии. При развитии синдрома полиорганной недостаточности (СПОН) развивается тяжелый острый панкреатит (ТОП), летальность при котором достигает 25-80%, по данным разных авторов. Наиболее грозным осложнением в структуре СПОН является острая почечная недостаточность (ОПН), которая в разы утяжеляет состояние больного и прогноз заболевания. В последнее время для диагностики и оценки тяжести почечного повреждения используется шкала RIFLE, имеющая 4 стадии: риск (Risk), повреждение (Injury), недостаточность (Failure), потеря (Loss), стойкая потеря функции (End stage renal disease). Шкала RIFLE позволяет более детально оценить степень повреждение почек и определить показания к началу заместительной почечной терапии (ЗПТ). Методы ЗПТ позволяют как замещать функцию почки, так и элиминировать провоспалительные цитокины, продукты метаболизма и различные биологически активные вещества. Применение методов ЗПТ в комплексной терапии ТОП позволяет снизить летальность у данной группы больных.
Яжелый острый панкреатит, синдром системного воспалительного ответа, полиорганная недостаточность, заместительная почечная терапия, доза конвекции/диализа
Короткий адрес: https://sciup.org/142211597
IDR: 142211597 | УДК: 616.61;
Текст научной статьи Оптимизация режимов заместительной почечной терапии, по почечным и внепочечным показаниям, у больных с тяжелым острым панкреатитом
Острый панкреатит является одним из распространенных заболеваний абдоминальной хирургии и составляет в ее структуре 8 - 12%. Ежегодно отмечается нарастание заболеваемости ОП от 5,4 до 79,8 на 100 тыс. населения [1 - 8].
По данным литературы, в 10 - 20% острый панкреатит осложняется синдромом системного воспалительного ответа (ССВО) с развитием синдрома полиорганной недостаточности (СПОН), что расценивается как тяжелый острый панкреатит. Летальность при этой форме ОП, по мнению ведущих специалистов, может достигать 80% [4, 5, 7 - 10].
Для оценки тяжести состояния больных и прогноза летального исхода при остром панкреатите используются общепринятые шкалы, такие как SAPS II и APACHE II, SOFA. Однако эти шкалы не позволяют выявить начальную стадию повреждения почек и динамику почечного повреждения, что, безусловно, может приводить к такому грозному осложнению, как острое почечное повреждение (ОПП), либо острая почечная недостаточность (ОПН), оказывающее значительное влияние на прогноз заболевания. Как известно, при остром панкреатите ОПН имеет преренальную форму на фоне гиповолемии или ренальную - вследствие ишемии, внутрисосудистой коагулопатии и воспаления под действием эндотоксина, вызывающего вазоконстрикцию почечных сосудов [5, 10].
В 2002 году на Международной конференции по острому диализу в городе Виченце (Vicenza) Италия была организована рабочая группа ADQI (Acute Dialysis Quality Initiative (ADQI) Group («Инициатива Качества Острого Диализа»), которая предложила заменить термин «острая почечная недостаточность» термином «острое почечное повреждение» (ОПП) и разработала критерии оценки тяжести ОПП (шкала RIFLE) [11].
В классификации острого почечного повреждения (ОПП) RIFLE, выделяют 4 стадии ОПП: риск (Risk), повреждение (Injury), недостаточность (Failure), потеря (Loss), стойкая потеря функции (End stage renal disease). В ее основу положены градации тяжести ОПП. Шкала RIFLE высокочувствительна и специфична, удобна для повседневного применения и оценки функционального состояния почек, в том числе и у больных с ОПП в рамках СПОН на фоне тяжелого острого панкреатита [11, 12].
Для улучшения результатов лечения этой тяжелой категории пациентов, как правило, в комплексную терапию включают те или иные экстракорпоральные методы детоксикации, такие как плазмаферез, продленная низкопоточная вено-венозная ге-мофильтрация/гемодиафильтрация (ПНВВГФ/ГДФ), высокообъемная продленная гемофильтрация (ВПГФ), LPS – сорбция (липополисахарид-сорбция эндотоксина) и др., но даже при проведении полноценной патогенетической терапии летальность при ТОП остается достаточно высокой, о чем свидетельствуют данные литературы [15, 16, 17, 18, 19, 20, 21].
Цель работы. Определить показания и способы проведения экстракорпоральной детоксикации с использованием шкалы RIFLE у больных с тяжелым острым панкреатитом и ОПП в рамках СПОН.
Материалы и методы
Проведен ретроспективный анализ 99 историй болезни больных с острым почечным повреждением в рамках СПОН на фоне тяжелого острого панкреатита, осложнившегося ССВО/ сепсисом, и нуждавшихся в проведении интенсивной терапии с использованием заместительной почечной терапии (ЗПТ) за период с 2000 по 2011 гг. (мужчин – 71, женщин –28).
Пациенты были переведены в ОРИТ из хирургических отделений на 3 - 5 сутки от дня госпитализации. Возраст пациентов колебался от 21 до 70 лет. Средний возраст составил 45,5±15 лет. При этом большинство пациентов (57%) было моложе 60 лет.
При поступлении больного в ОРИТ нами были использованы общеизвестные интегральные шкалы оценки тяжести состояния APACHE II и SAPS II, но в дальнейшем для определения прогнозируемой летальности применялась шкала APACHE II [22]. Степень нарушения сознания и выраженность комы определялось по шкале ком Глазго. Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле Кокрофта–Голта [23].
Основные клинико-лабораторные показатели у больных с ТОП, ССВО/сепсисом и острым почечным повреждением разной степени выраженности к началу заместительной почечной терапии представлены в таблице 1.
Как видно из таблицы 1, все больные имели мультиорган-ную дисфункцию/недостаточность с числом пораженных органов от 2 - 5, с поражением печени, почек, сердечно-сосудистой
Таблица 1
Основные клинико-лабораторные параметры у больных с ТОП, ССВО/сепсисом и острым почечным повреждением (ОПП) к началу заместительной почечной терапии (n=99)
Статистическая обработка полученных данных выполнялась с использованием пакета SPSS 13.0 (SPSS Inc., Chicago, 2004). Значимыми считались различия при р<0,05.
Результаты исследования и их обсуждение
Общая летальность составила 39,5%, при прогнозируемой летальности по шкале APACHE II - 50%. Для более детальной оценки летальности у больных с ТОП ССВО/сепсисом, СПОН все пациенты были разделены на 3 группы с учетом балла по шкале APACHE II (группа 1 балл по шкале APACHE II до 21, группа 2 - балл по шкале APACHE II до 30, группа 3 – свыше 30 баллов по шкале APACHE II), полученные данные представлены на рисунке 1.
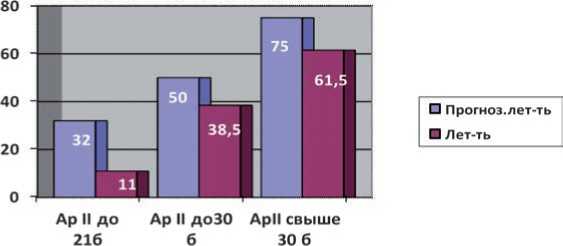
Рис. 1. Сравнение летальности в общей группе больных ТОП с прогнозируемой по шкале APACHE II
Как видно из рисунка 1 летальность в каждой исследуемой группе оказалась ниже прогнозируемой.
Для определения вклада почечного повреждения в тяжесть состояния больных с ТОП каждая из 3-х групп по шкале APACHE II была дополнительно разделена с учетом шкалы RIFLE на 3 группы - RIFLE-Risk (R-R); RIFLE-Injury (R-I); RIFLE-Failure (R-F) (табл. 2).
Как видно из таблицы 2, в группе 1 превалировали больные с почечным повреждением в стадии Risk (67%). Несмотря на то, что балл по шкале APACHE II до 21, - 33% пациентов имели ОПП в стадии Injury, больных с выраженной почечной недо-
Таблица 2
Вклад тяжести повреждения почек (RIFLE) в общую оценку тяжести больных по шкале APACHE II
В дальнейшем каждая группа пациентов, разделенная по шкале RIFLE, будет подробно рассмотрена в отдельности как по динамике клинико-лабораторных показателей, так и по виду и способу проведения экстракорпоральной детоксикации (ЭКД).
Всем пациентам с момента поступления в ОРИТ начиналась заместительная почечная терапия (ЗПТ), наряду с комплексным лечением панкреонекроза. Показаниями к ней были как почечные – острое почечное повреждение – начало ОПП (риск развития ОПН), так и внепочечные – удаление гуморальных факторов, участвующих в патогенезе ССВО/сепсиса СПОН, тяжелая токсическая энцефалопатия, ОРДС.
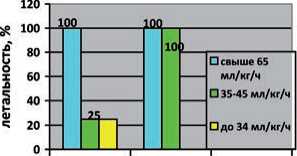
Анализ архивного материала показал, что больные получали различные виды ЗПТ: продленные – низкопоточную вено-венозную гемофильтрацию (ПНВВГФ), низкопоточную вено-венозную гемодиафильтрацию (ПНВВГДФ) и интермиттирующие – гемодиафильтрацию on line (иГДФ). Указанные выше процедуры ЭКД проводились с различными дозами кон-векции/диализа (скорость инфузии замещающих растворов), которые подбирались в основном эмпирически без учета ОПП по шкале RIFLE (табл. 3).
По данным архивного материала, с учетом данных шкал APACHE II и RIFLE можно заключить, что доза конвекции 25 мл/кг/ч не является оптимальной даже при APACHE II до 21 балла (группа 1) и шкале RIFLE-Risk, а показано проведение ПНВВГФ с дозой конвекции не менее 35 мл/кг/ч. При APACHE II до 30 баллов (группа 2) в стадии Risk целесообразно использовать дозу конвекции не менее 45 мл/кг/ч, а при APACHE II выше 30 баллов доза конвекции должна быть выше 45 мл/кг/ч.
При повреждении почек в стадии RIFLE-Injury к продленным низкопоточным методикам присоединяется диализный компонент (гемодиафильтрация). При анализе архивного материала выявлено, что во второй группе больных (балл по APACHE II до 30), получающих ЗПТ с дозой конвекции 25 мл/кг/ч, отмечался высокий уровень летальности, в то время как при большей дозе конвекции от 35 - 45 мл/кг/ч и выше 65 мл/кг/ч процент летальности существенно снижался, что более наглядно продемонстрировано при дозе диализа 65 мл/кг/ч.
К самой тяжелой категории больных относились пациенты с ТОП и ОПП в стадии RIFLE-Failure. Все больные этой группы имели высокие баллы по шкале APACHE II. Надо отметить, что у больных в 3 группе с ОПП в стадии RIFLE-Failure оптимальная доза диализа должна быть не менее 65 мл/кг/ч.
Очевидным является то, что при проведении ЭКД следует учитывать не только шкалу RIFLE, но и нарушение функции других систем, вносящих свой вклад в СПОН (сердечно-сосудистой,
Таблица 3
Влияние дозы конвекции/диализ на летальность у больных ТОП, СПОН и ОПП
|
АРACHE II, балл |
Доза конвекции/диализа и % летальности |
||||||||
|
25 мл/кг/ч |
35 - 45 мл/кг/ч |
Свыше 65 мл/кг/ч |
|||||||
|
R-R |
R-I |
R-F |
R-R |
R-I |
R-F |
R-R |
R-I |
R-F |
|
|
До 21 (группа 1) (n=18) |
17% |
50% |
(-) |
0% |
0% |
(-) |
(-) |
(-) |
(-) |
|
До 30 (группа 2) (n=52) |
67% |
67% |
75% |
20% |
0% |
33% |
0% |
0% |
25% |
|
Свыше 30 (группа 3) (n=29) |
50% |
100% |
100% |
0% |
50% |
50% |
(-) |
0% |
0% |
(-) – больные отсутствовали
дыхательной, печеночной и других), о чем свидетельствуют работы ряда авторов [1 - 3], и что отмечалось у больных второй группы с более выраженным повреждением дыхательной, сердечнососудистой и центральной нервной систем.
Таким образом, ретроспективный анализ историй болезни позволил определить оптимальные дозы ПНВВГФ/ГДФ у пациентов со СПОН ССВО, применение которых позволяет снизить летальность у этой тяжелой категории больных.
Летальность в группе больных с R-R составила 30% (12 из 40 больных), 28-дневная выживаемость - 72,6%. У пациентов в группе ОПП R-I умерли 34,7% пациентов (8 из 23 больных), 28-дневная выживаемость составила 65,2%. Самая высокая летальность оказалась в группе больных с ОПП R-F - 50% (18 из 36 больных), а 28-дневная выживаемость в подгруппах больных, разделенных по видам ЗПТ (иЗПТ и ПЗПТ), составила также по 50% в каждой подгруппе.
Всем больным на всех этапах лечения проводился непрерывный мониторинг гемодинамики и газообмена, оценка тяжести состояния по шкалам APACHE II, Глазго, а также оценка динамики уровня креатинина, билирубина, аминотрансфераз, амилазы, альбумина, С-реактивного белка (С-РБ) плазмы крови.
Анализируя архивные данные в группе умерших и выживших, мы видели значительную разницу в динамике основных показателей. В таблице 4 представлены основные клинические и лабораторные показатели пациентов на начало ЗПТ, динамику основных клинико-лабораторных показателей в конце ЗПТ, ных. Количество баллов по шкале Глазго колебалось от 7,0 до 10,8. На фоне ЗПТ у пациентов с благоприятным исходом происходило полное восстановление сознания, а в группе умерших положительной динамике не отмечено.
В целом в общей группе больных с ТОП ССВО/сепсисом и СПОН инотропную терапию, на начало ЗПТ получали 35,4% больных, из них в группе R-R 21% выживших и 50% умерших; в группе R-I – по 50% в каждой подгруппе; у больных с ОПП R-F - 50% умерших получали вазопрессорную поддержку. В конце ЗПТ выжившим больным в группах R-R и R-I инотропная терапия была прекращена, а в группе R-F ее процент значительно снизился (с 28% до 17%).
За время лечения ЗПТ отмечалась нормализация САД у больных с нестабильной гемодинамикой во всех группах, что позволяло полностью отменить инотропную терапию. Даже при летальном исходе, САД имело тенденцию к повышению и уменьшению числа больных, нуждавшихся в инотропной терапии, что свидетельствовало о положительном влиянии ЭКД на гемодинамику.
У 46% больных с ТОП в общей группе применялась механическая вентиляция легких. Наибольший процент нуждающихся в ИВЛ (75%) имелся в подгруппе умерших пациентов с ОПП R-I. В остальных группах этот процент больных колебался от 43 до 17%. В процессе лечения с использованием методов ЗПТ в подгруппах выживших пациентов отмечалось снижение процента нуждавшихся в механической вентиляции легких, а в подгруппах умерших все больные оставались на ИВЛ.
Как видно из таблицы 4, на фоне проведения ЭКД наблюдалась отчетливая положительная динамика уровня амилазы плазмы крови как у выживших, так и у умерших пациентов. Отмечалось и снижение маркера системной воспалительной реакции – С-РБ, хотя в подгруппах больных с летальным исходом динамика этого показателя была не выражена.
и их различие в подгруппах умерших и выживших.
Как видно из таблицы 4, у 100 % пациентов (n=99) диагностирован СПОН. В группе R-R на начало ЗПТ имелись достаточно высокие баллы по шкалам APACHE II - у выживших 25,3±8,3 и у умерших - 28±6,3, при ОПП в стадии R-I соответственно - 23,3 ± 6,7 у выживших и 29±4,7 балла при неблагоприятном исходе. Наиболее высокие баллы по APACHE II отмечались при ОПП в стадии R-F (27,9±4,0 и 28,6±4,1). На фоне ЗПТ отмечалась четкая тенденция к снижению балла по шкале APACHE II во всех группах выживших больных и незначительная динамика у пациентов с летальным исходом.
Тяжелая энцефалопатия наблюдалась во всех трех группах к началу проведения ЭКД, как у выживших, так и умерших боль-
ВЫЖИВШИЕ
УМЕРШИЕ
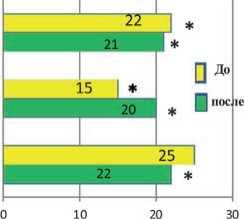
Рис. 2. Динамика альбумина плазмы крови (г/л) на фоне ЗПТ
Таблица 4
Распределение больных с ТОП по исходу заболевания и динамика основных мониторируемых показателей
|
Показатели |
RIFLE |
Выжившие, R-R n=28 R-I n=15 R-F n=18 |
Умершие, R-R n=12 R-I n=8 R-F n=18 |
||
|
До начала ЗПТ |
После ЗПТ |
До начала ЗПТ |
После ЗПТ |
||
|
APACHE II, баллы |
R-R |
25,3 ± 8,3 |
19 ± 3,2 |
28 ± 6,3 |
29,2 ± 1,3 |
|
R-I |
23,3 ± 6,7 |
19,7 ± 3,1 |
29 ± 4,7 |
30,1 ± 2,4 |
|
|
R-F |
27,9±4,0 |
23,5±2,5 |
28,6±4,1 |
29,3±3,3 |
|
|
Глазго, баллы |
R-R |
10,7 ± 2,3 |
14 ± 1,3 |
10,8 ± 2,6 |
10 ± 2,3 |
|
R-I |
11,5 ± 3,4 |
14,5 ± 1,3 |
7,7 ± 4 |
10,5 ± 2,4 |
|
|
R-F |
10±2 |
13±1,2 |
10±3,3 |
9±2,3 |
|
|
ИВЛ, % больных |
R-R |
43 % |
14 % |
17 % |
17 % |
|
R-I |
33 % |
2 % |
75 % |
75 % |
|
|
R-F |
22% |
17% |
28% |
28% |
|
|
Инотр. поддер., % больных |
R-R |
21 % |
0 |
50 % |
32 % |
|
R-I |
50 % |
0 |
50 % |
45 % |
|
|
R-F |
28% |
17% |
33% |
39% |
|
|
САД , мм рт. ст. |
R-R |
82 ± 4,5 |
104 ± 3,0 |
67,5 ± 3,2 |
96 ± 3,1 |
|
R-I |
59,3 ± 2,1 |
100 ± 3,0 |
52,0 ± 1,2 |
87 ± 3,1 |
|
|
R-F |
97,8±2,1 |
105±2,5 |
71,8±2,8 |
80,4±2,6 |
|
|
Амилаза, Ед/л |
R-R |
591 ± 536 (28 - 1850) |
120 ± 67 (31 - 261) |
2668 ± 3080 (123 - 8700) |
449 ± 414 (76 - 1162) |
|
R-I |
957 ± 864 (99 - 2010) |
86 ± 50 (11 - 158) |
667,8 ± 553 (9,0 - 1408) |
120 ± 100 (7 - 231) |
|
|
R-F |
958±863 (3 - 2456) |
169±105 (38 - 379) |
535±690 (4 - 2190) |
211±212 (13 - 540) |
|
|
С-РБ нг/мл |
R-R |
98 ± 22 |
79 ± 24 |
108 ± 31 |
94 ± 19 |
|
R-I |
76 ± 20 |
56 ± 23 |
115 ± 16 |
97,3 ± 12 |
|
|
R-F |
102±21 |
96,4±15 |
80±32 |
90±25 |
|
|
Альбумин, г/л |
R-R |
25,3 ± 5,3 |
28 ± 3,4 |
28 ± 1,4 |
22,0 ± 3,4 |
|
R-I |
26,5 ± 5,2 |
30 ± 5,1 |
15,1 ± 4,6 |
20,0 ± 4,0 |
|
|
R-F |
27±5,2* |
32±3,3* |
21,6±3,5* |
21,0±2,1* |
|
|
Креатинин, мколь/л |
R-R |
156 ± 34 |
87 ± 39 |
161 ± 28 |
132 ± 48 |
|
R-I |
285 ± 33 |
126 ± 43 |
264 ± 28 |
154 ± 62 |
|
|
R-F |
710±150 |
160±70* |
670±148 |
450±150* |
|
|
СКФ, мл/мин |
R-R |
63,4 |
109 |
56,6 |
69 |
|
R-I |
36,2 |
81 |
32,4 |
55 |
|
|
R-F |
15 |
64* |
16,7 |
24* |
|
|
Средняя доза/кон-векции, мл/кг/час |
R-R |
44,5± 0,7 * |
21,5 ± 1,5 * |
||
|
R-I |
52,2 ± 0,9* |
30,7 ± 1,1* |
|||
|
R-F |
56,5 ± 0,3* |
30,0±2,6* |
|||
* р < 0,05 – достоверность различий между умершими и выжившими
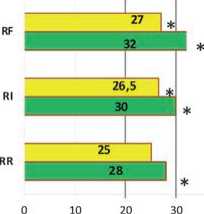
Многие пациенты имели низкие концентрации альбумина плазмы крови, обусловленные ССВО или сепсисом.
Как видно из рисунка 2, уровень альбумина плазмы крови на начало терапии колебался от 15 г/л до 30 г/л в разных группах. При анализе архивного материала выявлено, что у выживших пациентов уровень альбумина плазмы крови повышался на фоне ЗПТ, а в группах умерших даже снижался, и эти различия были статистически достоверны (р<0,05).
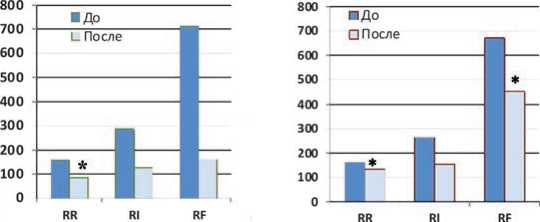
Еще более показательной была динамика креатинина плазмы крови и СКФ на фоне применения ЗПТ, особенно в группе пациентов с ОПП в стадии R-F по шкале RIFLE, имеющих значительное повреждение почек.
Как видно на рисунке 3, если в группе больных с благоприятным исходом (R-F) мы наблюдали полное восстановление функции почек, то в группе умерших имелось лишь небольшое снижение уровня креатинина, и эти различия также были достоверны (р<0,05).
Ретроспективно анализируя исходы лечения в зависимости от основного параметра проведения экстракорпоральной детоксикации – дозы конвекции/ диализа, оказалось, что во всех группах больных, разделенных по шкале RIFLE, выжившие пациенты получали более эффективную ЭКД, средняя доза диа-лиза/конвекции у них составила: в группе R-R - 44,5±0,7 мл/кг/час, R-I - 52,2± 0,9 мл/кг/час, R-F - 56,5±0,3 мл/кг/час. У умерших пациентов средняя доза диализа/ конвекции оказалась значительно ниже, лишь 27,1±1,5 мл/кг/час у больных с ОПП в стадии R-R, 30,7±1,1 мл/кг/час в группе умерших R-I и 30,0±2,6 мл/кг/час при повреждении почек в стадии R-F (р<0,05).
Таким образом, острое почечное повреждение влияет на исход у больных с тяжелым острым панкреатитом. Чем выше степень нарушения функции почек у больных с ТОП, тем выше летальность. Использование шкалы RIFLE для определения вклада ОПП в структуру СПОН, позволяет нам определить необходимую дозу конвекции/диализа при проведении ЗПТ.
ВЫЖИВШИЕ УМЕРШИЕ
* - р<0,05 значимость различий межу выжившими и умершими (Манн - Уитни)
Рис. 3. Динамика креатинина плазмы крови (мкмоль/л) на фоне ЗПТ
Особого внимания заслуживают данные последних лет о значении дозы конвекции, оцениваемой по скорости инфузии замещающего раствора в мл/кг массы тела/час [22, 23].
Наши наблюдения полностью согласуются с этими данными. Исход болезни и, соответственно, эффект от применения ЗПТ тесно коррелировал с дозой диализа/конвекции. Дополнительно проведенный многофакторный анализ (общая предсказательная способность модели составила 89,6%) выявил значение как предикторов смерти у больных с ТОП и ОПП в рамках СПОН таких показателей, как баллы по APACHE II и SAPS II, уровень альбумина плазмы, а также скорость объема замещения (табл. 5). Пороговым значением, по нашим данным, была доза конвекции/диализа не менее 35 мл/кг/час.
Как видно из таблицы 5, в результате логистического регрессионного анализа для каждого из значимо влияющих на прогноз лечения показателей было получено значение отношения шансов (ОШ), которое следует рассматривать как шанс наступления неблагоприятного исхода в группе пациентов с данным значением показателя. В рассматриваемой модели имеется достаточно высокая внутренняя корреляция между скоростью замещения (дозой конвекции) и балла по APACHE II.
Таким образом, это свидетельствует об увеличении риска фатального исхода в 15 раз у больных, имеющих балл по APACHE II выше 21, и этот риск возрастает до 29 раз при проведении ЗПТ с дозой конвекции/диализа менее 35 мл/кг/ч.
Проведенный сравнительный анализ и ЗПТ, и ПЗПТ свидетельствует об одинаковой возможности применении данных методик у больных с ТОП СПОН и ОПП. Однако следует отме-
Таблица 5
Результаты многофакторного анализа факторов риска смерти наблюдавшихся больных с ТОП
Как видно из рисунка 4, пациентам с ТОП, СПОН и сочетанным доминирующим повреждением почек и сердечнососудистой системы целесообразно использовать ПЗПТ в дозе от 45 до 65 мл/кг/ч.
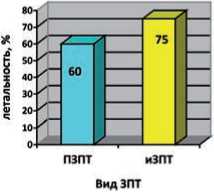
Рис. 4. Сравнительная характеристика методов ЭКД, дозы диализа у пациентов с ТОП ОПП и ССН
ПЗПТ ИЗПТ
САД до 58.313.2 55,311,2 ммц>т.ст
САД после 10011.2 7913.2 мм.рт.ст
На рисунке 4 также представлено сопоставление ПЗПТ и иЗПТ. ИЗПТ, согласно литературным данным, довольно часто используется при лечении этой категории пациентов однако, надо учитывать, что в структуре СПОН может доминировать не только ОПП, но и сердечно-сосудистая недостаточность, ОРДС и др., и таким образом, при тяжелом СПОН с ССН следует отдавать предпочтение ПЗПТ.
Выводы
-
1. Изучив структуру летальности и причину неудовлетворительных результатов лечения, следует заключить, что в значительной степени летальность может зависть от недоучета степени поражения почек в структуре СПОН. Видимо, следует рассмотреть вопрос о более раннем переводе этой тяжелой категории пациентов в отделение реанимации.
-
2. Сравнительный анализ и ЗПТ, и ПЗПТ свидетельствует о возможности использования обоих методов в лечения ОПП при ТОП, однако учитывая другие органные повреждения в структуре СПОН, особенно нестабильную гемодинамику, предпочтение следует отдавать продленным методам.
-
3. У больных с ТОП ССВО/сепсис и ОПП, даже при умеренных повышениях уровня креатинина плазмы крови, следует использовать шкалу RIFLE и таким образом определять режимы проведения ЗПТ.
-
4. Выбор дозы диализа/конвекции при проведении ЗПТ у больных с ТОП и ОПП играет значительную роль в эффективности терапии и ведет к снижению летальности.
-
5. Всем больным с ТОП ССВО/сепсис СПОН и ОПП показано обязательное проведение ЗПТ как по почечным, так и внепочечным показаниям. Предпочтение следует отдавать продленным методикам, выбор доз диализа производить с учетом шкалы RIFLE.
-
6. При ОПП по шкале RIFLE в стадии RIFLE-I к фильтрационному компоненту следует добавить диализный компонент (ПНВВГДФ).
Список литературы Оптимизация режимов заместительной почечной терапии, по почечным и внепочечным показаниям, у больных с тяжелым острым панкреатитом
- Пугаев А.В., Ачкасов Е.Е. Острый панкреатит. М.: ПРОФИЛЬ,2007. 336 с.
- Савельев В.С., Филимонов М.И., Бурневич С.З. Панкреонекрозы. М.: ООО «Медицинское информационное агентство», 2008. 264 с.
- Савельев В.С., Филимонов М.И., Гельфанд Б.Р., Бурневич С.З., Орлов Б.Б., Цыденжапов Е.Ц. Острый панкреатит как проблема ургентной хирургии и интенсивной терапии//Consilium Medicum. 2000.Т. 2, №9.
- Савельев В.С., Кириенко А.И. Клиническая хирургия: национальное руководство в 3 т./под ред. В.C. Савельева, А.И. Кириенко. М.: ГЭОТАР-Медиа, 2009. Т. II. 832 с.
- Pathophysiology of Acute Pancreatitis: Potential Applicationfrom Experimental Models and Human Medicine to Dogs Caroline Mansfield*Article first published online: 7 JUN 2012 DOI: 10.1111/j.1939-1676.2012.00949
- Bassi C. et al. Identification of pancreatic infection./In: buchler M.(ed). Acute pancreatitis: Novel Concepts in biology and Therapy. boston:blackwell Science, 1999. P. 277-282.
- Шугаев А.И., Гера И.Н., Мосоян С.С. и соавт. Факторы, определяющие развитие гнойных осложнений острого деструктивного панкреатита в реактивной фазе//Вестник хирургии им. И.И. Грекова.2009. Т. 168, № 1. С. 54-56.
- Andrew Kingsnorth. Acute pancreatitis//bMJ. 2006, May 6. Vol. 332(7549). P. 1072-1076.
- Dervenis C., Johnson C.D., Bassi C. et al. Diagnosis, objective assessment of severity, and management of acute pancreatitis. Santorini consensus statement//Int. J. Pancreatol. 1999. Vol. 25. P. 195-210.
- D.J. van Westerloo et al. New Insights into Pathophysiology and Severity Assessment of Acute Pancreatitis. Yearbook of Intesive Care and Emergency Medicine, 2003. P. 823-844
- Bellomo R., Ronco C., Kellum J.A. et al. Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group//Crit. Care. 2004. Vol. 8. R. 204-212.
- Bagshaw S.M., George C., Bellomo R. A comparison of the RIFLE and AKIN criteria for acute kidney injury in critically ill patients//Nephrol. Dial. Transplant. 2008. Vol. 23. P. 1569-1574.
- Chon G.R., Chang J.W. A comparison of the time from sepsis to inception of continuous renal replacement therapy versus RIFLE criteria in patients with septic acute kidney injury//Shock. 2012, Jul. Vol. 38(1).P. 30-36.
- Blinzler L., Sieberth H.G., Stummvoll H.K. Conservative treatment of server necrotizing pancreatitis using early continuous veno-venous HF//Contrib. Nephrol. 1991. Vol. 93. P. 234-236.
- Cole L., Bellomo R., Journois D. et al. A phase II randomized, controlled trial of continuous hemofiltraition in sepsis//Crit. Care Med.2002. Vol. 30. P. 100-106.
- Charuhas V. Thakar et al. Degree of Acute Kidney Injury beforeDialysis Initiation and Hospital Mortality in Critically Patients//International Journal of Nephrology. Vol. 2013. Article ID 827459, 7 p.
- Connor S., Raraty M.G., Howes N., Evans J., Ghaneh P., Sutton R. et al. Surgery in the treatment of acute pancreatitis -minimal access pancreatic necrosectomy//Scand. J. Surg. 2005. Vol. 94. P. 135-142.
- Guo J., Huang W., Yang X.N. et al. Short-term continuous high-volume hemofiltration on clinical outcomes of severe acute pancreatitis//Pancreas. 2014, Mar. Vol. 43(2). P. 250-254.
- Hao Wang, Wei-Qin Li, Wei Zhou, Ning Li, Jie-Shou Li. Clinical effectsof continuous high volume hemofiltration on severe acute pancreatitiscomplicated with multiple organ dysfunction syndrome//World J. Gastroenterology. 2003, Sept. Vol. 9(9). P. 2096-2099.
- Ronco C. et al. Adsorption in sepsis//Kidney International. 2000. Vol. 58, Suppl. 76. S148-S155.
- Knaus W.A. et al. APACHE II: A severity of disease classification system//Crit. Care Med. 1985. Vol. 13. P. 818-829.
- Cockcroft D.W., Gault M.H. Prediction of creatinine clearance from serum creatinine//Nephron. 1976. Vol. 16(1). P. 31-41. PubMed PMID:1244564.


